Бластоциста - Blastocyst
| Бластоциста | |
|---|---|
 Бластоциста непосредственно перед имплантация | |
 Бластоциста человека с внутренняя клеточная масса вверху справа | |
| Подробности | |
| Этап Карнеги | 3 |
| Дней | 5–9 |
| Дает начало | Гаструла |
| Идентификаторы | |
| латинский | Бластоцисты |
| MeSH | D001755 |
| TE | E2.0.1.2.0.0.12 |
| FMA | 83041 |
| Анатомическая терминология | |
В бластоциста это структура, сформированная на раннем этапе развития млекопитающие. Он обладает внутренняя клеточная масса (ICM), которая впоследствии формирует эмбрион. Внешний слой бластоцисты состоит из клеток, которые вместе называются трофобласт. Этот слой окружает внутреннюю клеточную массу и заполненную жидкостью полость, известную как бластоцель. Трофобласт дает начало плацента. Название «бластоциста» происходит от Греческий βλαστός бласты («росток») и κύστις Кистис («мочевой пузырь, капсула»). У других животных это называется бластула.
У человека образование бластоцисты начинается примерно через 5 дней после оплодотворение когда полость, заполненная жидкостью, открывается в морула, ранняя эмбриональная стадия клубка из 16 клеток. Бластоциста имеет диаметр около 0,1–0,2 мм и составляет 200–300 клетки после быстрого расщепление (деление клеток). Примерно через семь дней после оплодотворения[1] бластоциста подвергается имплантация, встраивание в эндометрий из стенка матки. Там он претерпит дальнейшие процессы развития, в том числе гаструляция. Для внедрения бластоцисты в эндометрий необходимо, чтобы она люки от zona pellucida, что препятствует соблюдению фаллопиевых труб пока преэмбрион продвигается к матке.
Использование бластоцист в in vitro оплодотворение (ЭКО) включает культивирование оплодотворенной яйцеклетки в течение пяти дней перед ее переносом в матку. Это может быть более эффективный метод лечения бесплодия, чем традиционное ЭКО. Внутренняя клеточная масса бластоцист является источником эмбриональные стволовые клетки, которые широко применяются в терапии стволовыми клетками, включая восстановление, замену и регенерацию клеток.
Цикл разработки
В течение эмбриональное развитие человека, примерно через 5–6 дней после оплодотворение, клетки морула начать проходить дифференциация клеток, и морула превращается в бластоцисту. В матке zona pellucida окружающая бластоциста разрушается, позволяя ей имплант в стенку матки примерно через 6 дней после оплодотворения. Имплантация знаменует конец зародышевый этап эмбриогенеза.[2]
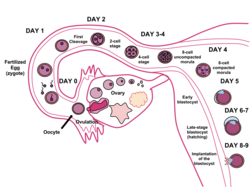
Образование бластоцисты
В зигота развивается митоз, и когда он превратился в 16 ячеек, становится известным как морула. До этого этапа развития все клетки (бластомеры) автономны и никуда не деться. У многих животных морула затем развивается в результате кавитации и становится бластулой. Затем при клеточной дифференцировке клетки бластулы делятся на два типа: клетки трофобласта, окружающие бластоцель, и внутреннюю массу клеток (эмбриобласт). Концептус тогда известен как бластоциста.[3] Сторона бластоцисты, на которой образуется внутренняя клеточная масса, называется животным полюсом, а противоположная сторона - вегетативным полюсом. Внешний слой клеток трофобласта, образующийся в результате уплотнения, закачивает ионы натрия в бластоцисту, что заставляет воду проникать через осмос и образуют внутреннюю заполненную жидкостью полость бластоцисты (бластоцель). Бластоцель, клетки трофобласта и клетки внутренней клеточной массы являются отличительными признаками бластоцисты.[4]
Имплантация
Имплантация имеет решающее значение для выживания и развития раннего эмбриона человека. Он устанавливает связь между матерью и ранним эмбрионом, которая будет сохраняться на протяжении оставшейся части беременности. Имплантация стала возможной благодаря структурным изменениям как бластоцисты, так и стенки эндометрия.[5] В zona pellucida окружающие бластоцисты, называемые вылупление. Это снимает ограничение на физический размер эмбриональной массы и открывает доступ к внешним клеткам бластоцисты во внутреннюю часть матки. Более того, гормональный изменения в матери, особенно пик лютеинизирующий гормон (LH), подготовьте эндометрий для приема и обволакивания бластоцисты. В иммунная система также модулируется, чтобы обеспечить инвазию чужеродных эмбриональных клеток. После связывания с внеклеточным матриксом эндометрия клетки трофобласта секретируют ферменты и другие факторы, встраивая бластоцисты в стенку матки. Выделяемые ферменты разрушают слизистую оболочку эндометрия, в то время как автокринный факторы роста, такие как хорионический гонадотропин человека (ХГЧ) и инсулиноподобный фактор роста (IGF) позволяют бластоцисте проникать в эндометрий.[6]
Имплантация в стенку матки позволяет сделать следующий шаг в эмбриогенезе, гаструляция, который включает образование плаценты из трофобластических клеток и дифференцировку внутренней клеточной массы в амниотической мешок и эпибласт.
Структура
Есть два типа бластомерных клеток:[7]
- Внутренняя клеточная масса, также известная как эмбриобласт, порождает примитивная энтодерма и собственно эмбрион (эпибласт).
- Примитивная энтодерма развивается в амниотической мешок который образует заполненную жидкостью полость, в которой находится эмбрион во время беременности.[8]
- Эпибласт дает начало трем ростковые отростки развивающегося эмбриона во время гаструляции (энтодерма, мезодерма, и эктодерма ).
- Трофобласт - это слой клеток, образующий внешнее кольцо бластоцисты, который соединяется с материнским эндометрием, образуя плаценту. Клетки трофобласта также секретируют факторы, образующие бластоцель.[9]
- После имплантации цитотрофобласт внутренний слой трофобласта, состоящий из стволовые клетки которые дают начало клеткам, содержащим ворсинки хориона, плацента, и синцитиотрофобласт.
- После имплантации синцитиотрофобласт это самый внешний слой трофобласта. Эти клетки секретируют протеолитические ферменты для разрушения внеклеточного матрикса эндометрия для имплантации бластоцисты в стенку матки.[10]
Жидкая полость бластоцеля содержит аминокислоты, факторы роста, и другие молекулы, необходимые для клеточная дифференциация.[11]
Спецификация ячейки
Множественные процессы контролируют спецификацию клеточного клона в бластоцисте, чтобы произвести трофобласт, эпибласт и примитивную энтодерму. Эти процессы включают экспрессию генов, передачу сигналов клеток, межклеточный контакт и позиционные отношения, а также эпигенетика.
Как только ICM устанавливается в бластоцисте, эта клеточная масса готовится к дальнейшей спецификации в эпибласт и примитивную энтодерму. Этот процесс спецификации частично определяется фактор роста фибробластов (FGF) сигнализация, которая генерирует MAP киназа путь к изменению клеточных геномов.[12] Дальнейшая сегрегация бластомеров на трофобласт и внутреннюю клеточную массу регулируется гомеодомен белок Cdx2. Этот фактор транскрипции подавляет экспрессию 4 октября и Наног факторы транскрипции в трофобласт.[13] Эти геномные изменения делают возможной прогрессивную спецификацию клонов как эпибластов, так и примитивной энтодермы в конце фазы развития бластоцисты, предшествующей гаструляции. Большая часть исследований, проводимых на этих ранних эмбриональных стадиях, проводится на эмбрионах мышей, и у разных млекопитающих могут различаться конкретные факторы.
Во время имплантации трофобласт дает начало экстраэмбриональным мембранам и типам клеток, которые в конечном итоге сформируют большую часть плаценты плода, специализированного органа, через который эмбрион получает материнское питание, необходимое для последующего экспоненциального роста.[14] Спецификация трофобласта контролируется комбинацией морфологических сигналов, возникающих из клеточной полярности, с дифференциальной активностью сигнальных путей, таких как Hippo и Notch, и ограничением внешними клетками спецификаторов клонов, таких как CDX2.[15]
В мышке первозданный стволовые клетки указаны из эпибласт клетки, процесс, который сопровождается обширными геном -широкий эпигенетический перепрограммирование.[16] Перепрограммирование требует глобального Деметилирование ДНК и хроматин реорганизация в результате клеточного тотипотентность.[16] Процесс геном - широкое деметилирование включает ДНК базовая эксцизионная пластика путь.[17]
Трофобласты экспрессируют интегрин на их клеточных поверхностях, которые обеспечивают адгезию к внеклеточному матриксу стенки матки. Это взаимодействие делает возможной имплантацию и запускает дальнейшую спецификацию в трех разных типах клеток, подготавливая бластоцисту для гаструляции.[18]
Клинические последствия
Эта секция нужны дополнительные цитаты для проверка. (Декабрь 2013) (Узнайте, как и когда удалить этот шаблон сообщения) |
Тесты на беременность
Уровень хорионический гонадотропин человека секретируемый бластоцистой во время имплантации фактор, измеряемый в тест на беременность. ХГЧ можно измерить как в крови, так и в моче, чтобы определить, беременна ли женщина. Больше ХГЧ секретируется при многоплодной беременности. Анализы крови на ХГЧ также можно использовать для проверки аномальной беременности.[19]
В пробирке оплодотворение
В пробирке оплодотворение (ЭКО) - альтернатива традиционным in vivo оплодотворение для оплодотворения яйцеклетки спермой и имплантации эмбриона в утробу женщины. В течение многих лет эмбрион вводился в матку через два-три дня после оплодотворения. Однако на этой стадии развития очень трудно предсказать, какие эмбрионы будут развиваться лучше всего, и обычно имплантировалось несколько эмбрионов. Несколько имплантированных эмбрионов увеличили вероятность развития плода, но также привели к развитию нескольких плодов. Это было серьезной проблемой и недостатком использования эмбрионов в ЭКО.
Использование бластоцист для человека in vitro оплодотворение оказалось успешным и является обычным вариантом для пар, не способных зачать ребенка естественным путем. Бластоциста имплантируется через пять-шесть дней после оплодотворения яиц.[20] Через пять или шесть дней намного легче определить, какие эмбрионы приведут к здоровым живорожденным. Знание того, какие эмбрионы будут успешными, позволяет имплантировать только одну бластоцисту, что значительно снижает риск для здоровья и расходы, связанные с многоплодием. Теперь, когда определены потребности в питательных веществах для развития эмбриона и бластоцисты, гораздо проще дать эмбрионам правильные питательные вещества, чтобы поддержать их в фазе бластоцисты.
Имплантация бластоцисты после in vitro оплодотворение - это безболезненная процедура, при которой во влагалище вводится катетер, проводимый через шейка матки с помощью ультразвука и в матку, где бластоцисты вводятся в матку.
Бластоцисты также имеют преимущество, потому что их можно использовать для генетического тестирования клеток на предмет генетических проблем. В бластоцисте достаточно клеток, чтобы несколько трофэктодерма клетки могут быть удалены без нарушения развивающейся бластоцисты. Эти клетки можно проверить на хромосома анеуплоидия с помощью предимплантационный генетический скрининг (PGS) или особые условия, такие как кистозный фиброз, часто известный как предимплантационная генетическая диагностика (ПГД).[21]
Смотрите также
Рекомендации
Эта статья включает текст в всеобщее достояние из 20-го издания Анатомия Грея (1918)
- ^ ВанПутте C (2020). Анатомия и физиология Сили. Нью-Йорк: Макгроу-Хилл. п. 1092. ISBN 978-1-260-56596-6. OCLC 1099344977.
- ^ Шерк, Стефани Дионн (2006). «Пренатальное развитие». Энциклопедия здоровья детей Гейла. Архивировано из оригинал на 2013-12-01. Получено 2013-12-07.
- ^ Ниссен С.Б., Перера М., Гонсалес Дж. М., Моргани С. М., Дженсен М. Х., Снеппен К. и др. (Июль 2017 г.). «Четыре простых правила, которых достаточно для образования бластоцисты млекопитающих». PLOS Биология. 15 (7): e2000737. Дои:10.1371 / journal.pbio.2000737. ЧВК 5507476. PMID 28700688.
- ^ Гилберт С.Ф. (2000). «Раннее развитие млекопитающих». Биология развития (6-е изд.). Сандерленд (Массачусетс): Sinauer Associates.
- ^ Чжан С., Линь Х, Конг С., Ван С., Ван Х, Ван Х, Армант Д.Р. (октябрь 2013 г.). «Физиологические и молекулярные детерминанты имплантации эмбриона». Молекулярные аспекты медицины. 34 (5): 939–80. Дои:10.1016 / j.mam.2012.12.011. ЧВК 4278353. PMID 23290997.
- ^ Шрисупарп С., Стракова З., Фазлеабас А.Т. (2001). «Роль хорионического гонадотропина (ХГ) в имплантации бластоцисты». Архив медицинских исследований. 32 (6): 627–34. Дои:10.1016 / S0188-4409 (01) 00330-7. PMID 11750740.
- ^ Гилберт SF (15 июля 2013 г.). Биология развития. Sinauer Associates, Incorporated. ISBN 978-1-60535-173-5.[страница нужна ]
- ^ Schoenwolf GC, Ларсен WJ (2009). Эмбриология человека Ларсена (4-е изд.). Филадельфия: Черчилль Ливингстон / Эльзевьер.[страница нужна ]
- ^ Джеймс JL, Stone PR, Chamley LW (июль 2005 г.). «Дифференциация цитотрофобластов в первом триместре беременности: доказательства наличия отдельных предшественников вневорсинчатых трофобластов и синцитиотрофобластов». Размножение. 130 (1): 95–103. Дои:10.1530 / rep.1.00723. PMID 15985635.
- ^ Вичовац Л., Аплин Дж. Д. (1996). «Эпителиально-мезенхимальный переход при дифференцировке трофобластов». Acta Anatomica. 156 (3): 202–16. Дои:10.1159/000147847. PMID 9124037.
- ^ Гасперович М., Натале Д.Р. (апрель 2011 г.). «Установление трех линий бластоцист - что тогда?». Биология размножения. 84 (4): 621–30. Дои:10.1095 / биолрепрод.110.085209. PMID 21123814.
- ^ Яманака Ю., Ланнер Ф., Россант Дж. (Март 2010 г.). «Зависимая от сигнала FGF сегрегация примитивной энтодермы и эпибласта в бластоцисте мыши». Разработка. 137 (5): 715–24. Дои:10.1242 / dev.043471. PMID 20147376.
- ^ Штрампф Д., Мао К.А., Яманака Ю., Ральстон А., Чавенгсаксофак К., Бек Ф., Россант Дж. (Май 2005 г.). «Cdx2 необходим для правильной спецификации клеточной судьбы и дифференцировки трофэктодермы в бластоцисте мыши». Разработка. 132 (9): 2093–102. Дои:10.1242 / dev.01801. PMID 15788452.
- ^ Менчеро С., Сайнс де Аха Дж., Мансанарес М. (2018). «Наш первый выбор: клеточные и генетические основы идентичности и дифференцировки трофэктодермы в эмбрионе млекопитающих». Актуальные темы биологии развития. Эльзевир. 128: 59–80. Дои:10.1016 / bs.ctdb.2017.10.009. ISBN 978-0-12-804252-6. PMID 29477171.
- ^ Менчеро С., Роллан И., Лопес-Искьердо А., Андреу М.Дж., Сайнс де Аха Дж., Канг М. и др. (Апрель 2019 г.). «Изменения в активности клеток во время раннего развития мышей управляются Notch». eLife. 8: e42930. Дои:10.7554 / eLife.42930. ЧВК 6486152. PMID 30958266.
- ^ а б Hackett JA, Sengupta R, Zylicz JJ, Murakami K, Lee C, Down TA, Surani MA (январь 2013 г.). «Динамика деметилирования ДНК зародышевой линии и стирание отпечатка с помощью 5-гидроксиметилцитозина». Наука. 339 (6118): 448–52. Bibcode:2013Наука ... 339..448H. Дои:10.1126 / science.1229277. ЧВК 3847602. PMID 23223451.
- ^ Хайкова П., Джеффрис С.Дж., Ли С., Миллер Н., Джексон С.П., Сурани М.А. (июль 2010 г.). «Полногеномное перепрограммирование в зародышевой линии мыши влечет за собой основной путь эксцизионной репарации». Наука. 329 (5987): 78–82. Bibcode:2010Sci ... 329 ... 78H. Дои:10.1126 / science.1187945. ЧВК 3863715. PMID 20595612.
- ^ Дамски С.Х., Либрах С., Лим К.Х., Фицджеральд М.Л., Макмастер М.Т., Джанатпур М. и др. (Декабрь 1994 г.). «Переключение интегрина регулирует нормальную инвазию трофобласта». Разработка. 120 (12): 3657–66. PMID 7529679.
- ^ «Хорионический гонадотропин человека (ХГЧ)». WebMD. 2010. Получено 2013-12-07.
- ^ Фонг CY, Bongso A, Ng SC, Anandakumar C, Trounson A, Ratnam S (март 1997 г.). «Продолжающаяся нормальная беременность после переноса бластоцист без зоны: последствия для переноса эмбриона у человека». Репродукция человека. 12 (3): 557–60. Дои:10.1093 / humrep / 12.3.557. PMID 9130759.
- ^ Ван Дж., Зауэр М.В. (декабрь 2006 г.). «Экстракорпоральное оплодотворение (ЭКО): обзор трех десятилетий клинических инноваций и технологических достижений». Терапия и управление клиническими рисками. 2 (4): 355–64. Дои:10.2147 / tcrm.2006.2.4.355. ЧВК 1936357. PMID 18360648.
