Горение с химическим циклом - Chemical looping combustion
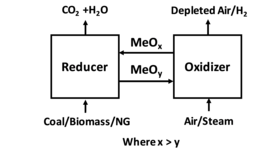

Химическое петлевое горение (CLC) представляет собой технологический процесс, обычно использующий двойное псевдоожиженный слой система. CLC, работающий с взаимосвязанным движущимся слоем с системой псевдоожиженного слоя, также использовался в качестве технологического процесса. В CLC оксид металла используется в качестве материала слоя, обеспечивающего кислород для горения в топливный реактор. Восстановленный металл затем переносится во второй слой (воздушный реактор ) и повторно окислили перед тем, как снова ввести в топливный реактор, завершив цикл. На рис. 1 показана упрощенная схема процесса CLC. На фиг.2 показан пример системы циркулирующего реактора с двойным псевдоожиженным слоем и системы циркулирующего реактора с псевдоожиженным слоем.
Изоляция топлива от воздуха упрощает количество химические реакции в горение. Найма кислород без азот а следовые газы, обнаруженные в воздухе, устраняют основной источник для образования оксид азота (НЕТ
Икс), производит дымовые газы состоит в основном из углекислый газ и водяной пар; другой след загрязняющие вещества зависит от топливо выбрано.
Описание
Химическое петлевое горение (CLC) использует две или более реакций для окисления углеводородного топлива. В простейшей форме частицы, несущие кислород (обычно металл), сначала окисляются на воздухе, образуя оксид. Затем этот оксид восстанавливают с использованием углеводорода в качестве восстановителя во второй реакции. В качестве примера утюг система сжигания чистого углерода будет включать в себя два редокс реакции:
- C (s) + Fe
2О
3(s) → Fe
3О
4(s) + CO
2(грамм)(1)
(2)
Если (1) и (2) добавляются вместе, реакционная смесь сводится к окислению прямого углерода, то есть:
- C (s) + О
2(г) → CO
2(грамм)(3)
CLC впервые был изучен как способ производства CO
2 из ископаемого топлива с использованием двух взаимосвязанных псевдоожиженных слоев.[3] Позже она была предложена как система повышения КПД электростанции.[4] Повышение эффективности возможно благодаря повышенной обратимости двух окислительно-восстановительных реакций; при традиционном одноступенчатом сгорании выделение энергии топлива происходит необратимым образом, значительно отклоняясь от равновесия. В CLC, если выбран соответствующий переносчик кислорода, обе окислительно-восстановительные реакции могут протекать почти обратимо и при относительно низких температурах. Теоретически это позволяет электростанции, использующей CLC, приближаться к идеальной выходной мощности для двигателя внутреннего сгорания, не подвергая компоненты воздействию чрезмерных рабочих температур.
Термодинамика

Рис. 3 графически иллюстрирует обмен энергией в системе CLC и показывает Диаграмма Санки потоков энергии, возникающих в реверсивном двигателе на основе CLC. Изучая рис.1, а Тепловой двигатель приспособлен для получения тепла при высоких температурах от экзотермический реакция окисления. После преобразования части этой энергии в работу тепловая машина отклоняет оставшуюся энергию в виде тепла. Почти весь этот отвод тепла может быть поглощен эндотермический реакция восстановления, происходящая в редукторе. Такое расположение требует, чтобы окислительно-восстановительные реакции были экзотермическими и эндотермическими соответственно, но это обычно имеет место для большинства металлов.[5] Требуется дополнительный теплообмен с окружающей средой, чтобы удовлетворить второй закон; теоретически для обратимого процесса теплообмен связан с изменением энтропии в стандартном состоянии ΔSо, первичной реакции окисления углеводородов следующим образом:
- Qо = TоΔSо
Однако для большинства углеводородов ΔSо это небольшая величина, и, как следствие, теоретически возможен двигатель с высоким общим КПД.[6]
CO2 захватывать
Несмотря на то, что это было предложено как средство повышения эффективности, в последние годы интерес к CLC проявился как улавливание углерода техника.[7][8] Улавливание углерода облегчается с помощью CLC, потому что две окислительно-восстановительные реакции генерируют два по сути разделенных потока дымовых газов: поток из воздушного реактора, состоящий из атмосферных N
2 и остаточный О
2, но разумно свободный от CO
2; и поток из топливного реактора, содержащий преимущественно CO
2 и ЧАС
2О с очень небольшим количеством разбавляющего азота. Дымовой газ воздушного реактора может выбрасываться в атмосферу, что вызывает минимальное CO
2 загрязнение. Выходящий из редуктора газ содержит почти все CO
2 генерируемый системой и CLC, поэтому можно сказать, что он демонстрирует «естественный улавливание углерода», поскольку водяной пар можно легко удалить из второго дымового газа посредством конденсации, что приведет к потоку почти чистого CO
2. Это дает CLC явные преимущества по сравнению с конкурирующими технологиями улавливания углерода, поскольку последние обычно связаны со значительными потерями энергии, связанными либо с системами очистки после сжигания, либо с затратами труда, необходимыми для установок разделения воздуха. Это привело к тому, что CLC был предложен в качестве энергоэффективной технологии улавливания углерода,[9][10] способен улавливать почти весь CO2, например, с завода по производству угля с прямым химическим циклом (CDCL).[11][12] Непрерывная 200-часовая демонстрация результатов 25 кВтth Субпилотная установка CDCL показала почти 100% конверсию угля в CO.2 без уноса углерода в воздушный реактор.[13][14]
Развитие технологий
Первая операция химико-петлевого сжигания газообразного топлива была продемонстрирована в 2003 году.[15] а затем на твердом топливе в 2006 году.[16] Суммарный стаж эксплуатации у 34 пилотов мощностью от 0,3 до 3 МВт более 9000 часов.[17][18][19] Используемые в процессе работы материалы-носители кислорода включают монометаллические оксиды никеля, меди, марганца и железа, а также различные комбинированные оксиды, включая оксиды марганца, связанные с кальцием, железом и кремнеземом. Также используются природные руды, особенно для твердого топлива, включая железные руды, марганцевые руды и ильменит.
Стоимость и штраф за энергию
Детальная технологическая оценка химико-петлевого сжигания твердого топлива, то есть угля, на 1000 МВт.th Электростанция показывает, что дополнительные затраты на реактор CLC по сравнению с обычным котлом с циркулирующим псевдоожиженным слоем невелики из-за сходства технологий. Основные затраты вместо CO2 сжатие, необходимое для всех CO2 технологии улавливания и производство кислорода. Производство молекулярного кислорода может также потребоваться в определенной конфигурации CLC для очистки газообразного продукта из топливного реактора. В целом добавленные затраты были оценены в 20 евро за тонну CO.2 тогда как штраф за энергию составлял 4%.[20]
Вариантом CLC является химико-петлевое горение с разъединением кислорода (CLOU), где используется переносчик кислорода, который выделяет кислород в газовой фазе в топливном реакторе, например CuO /Cu
2О.[21] Это полезно для достижения высокой конверсии газа, особенно при использовании твердого топлива, когда можно избежать медленной паровой газификации полукокса. Работа CLOU на твердом топливе показывает высокую производительность[22][23]
Химическая петля также может использоваться для производства водорода в Химический риформинг (CLR) процессы.[24][25] В одной из конфигураций процесса CLR водород получают из угля и / или природного газа с использованием топливного реактора с подвижным слоем, объединенного с паровым реактором и воздушным реактором с псевдоожиженным слоем. Эта конфигурация CLR может обеспечить чистоту H более 99%.2 без потребности в CO2 разделение.[19][26]
Исчерпывающие обзоры этой области даны в недавних обзорах технологий химических петель.[7][27][28]
Таким образом, CLC может обеспечить как повышение эффективности электростанции, так и улавливание углерода с низкими потерями энергии. Проблемы с CLC включают в себя работу с двойным псевдоожиженным слоем (поддержание псевдоожижения носителя без раздавливания и истирания[29]) и поддержание стабильности носителя на протяжении многих циклов.
Смотрите также
- Химический риформинг и газификация
- Горение
- Кислородное горение
- Окислитель
- Редокс (реакция восстановления / окисления)
- Улавливание и хранение углерода
- Лейн производитель водорода
Рекомендации
- ^ Стрёле, Йохен; Орт, Матиас; Эппл, Бернд (январь 2014 г.). «Проектирование и эксплуатация химического петлевого завода мощностью 1 МВт». Прикладная энергия. 113: 1490–1495. Дои:10.1016 / j.apenergy.2013.09.008. ISSN 0306-2619.
- ^ Лян-Ши, Фань. Химическое парциальное окисление: газификация, риформинг и химический синтез. Кембридж. ISBN 9781108157841. OCLC 1011516037.
- ^ Льюис У., Гиллиланд Э. и Суини М. (1951). «Газификация углерода». Прогресс химического машиностроения. 47: 251–256.CS1 maint: несколько имен: список авторов (связь)
- ^ Richter, HJ; Knoche, K.F. (1983). «Обратимость процессов горения, в эффективности и стоимости - второй закон анализа процессов». Серия симпозиумов ACS (235): 71–85. Цитировать журнал требует
| журнал =(помощь) - ^ Jerndal, E., Mattisson, T. и Lyngfelt, A. (2006). «Термический анализ химико-петлевого горения». Химико-технические исследования и разработки. 84 (9): 795–806. Дои:10.1205 / cherd05020.CS1 maint: несколько имен: список авторов (связь)
- ^ МакГлашан, Н. (2008). «Химическая петля горения - термодинамическое исследование». Proc. Inst. Мех. Англ. C. 222 (6): 1005–1019. CiteSeerX 10.1.1.482.5166. Дои:10.1243 / 09544062JMES790. S2CID 14865943.
- ^ а б Лян-Ши., Фан (2010). Системы химического цикла для преобразования ископаемой энергии. Хобокен, Нью-Джерси: Уайли-Айше. ISBN 9780470872888. OCLC 663464865.
- ^ Фань, Лян-Ши; Цзэн, Лян; Ван, Уильям; Ло, Сивэй (2012). «Химические циклические процессы для улавливания CO2 и конверсии углеродсодержащего топлива - перспективы и возможности». Энергетика и экология. 5 (6): 7254. Дои:10.1039 / c2ee03198a. ISSN 1754-5692.
- ^ Ishida, M .; Джин, Х. (1997). "CO
2 Рекуперация на электростанции с химическим петлевым сжиганием ». Конв. Энергии MGMT. 38: S187 – S192. Дои:10.1016 / S0196-8904 (96) 00267-1. - ^ Brandvoll, Ø .; Болланд, О. (2004). "Врожденный CO
2 улавливание с использованием химического замкнутого горения в цикле сжигания природного газа ». Пер. КАК Я. 126 (2): 316–321. Дои:10.1115/1.1615251. - ^ Гордер, Пэм (5 февраля 2013 г.). «Новая угольная технология использует энергию без сжигания, приближается к опытно-промышленной разработке». researchchnews.osu.edu. Архивировано из оригинал 21 декабря 2016 г.. Получено 2016-11-04.
- ^ Бейхэм, Самуэль; МакГиверон, Омар; Тонг, Эндрю; Чанг, Елена; Кате, Мандар; Ван, Давэй; Цзэн, Лян; Фань, Лян-Ши (май 2015 г.). «Параметрические и динамические исследования железосодержащей угольной установки прямой химической петли мощностью 25 кВт с использованием полубитуминозного угля». Прикладная энергия. 145: 354–363. Дои:10.1016 / j.apenergy.2015.02.026. ISSN 0306-2619.
- ^ Bayham, Samuel C .; Kim, Hyung R .; Ван, Давэй; Тонг, Эндрю; Цзэн, Лян; МакГиверон, Омар; Kathe, Mandar V .; Чанг, Елена; Ван, Уильям (2013-03-08). «Процесс сжигания железного угля с прямым химическим циклом: 200 часов непрерывной работы 25-киловаттной вспомогательной установки». Энергия и топливо. 27 (3): 1347–1356. Дои:10.1021 / ef400010s. ISSN 0887-0624.
- ^ Чунг, Ченг; Поттимурти, Ясванф; Сюй, Минъюань; Се, Тянь-Линь; Сюй, Дикай; Чжан, Итао; Чен, Юй-Йен; Он, Пэнфэй; Пикарс, Маршалл (декабрь 2017 г.). «Судьба серы в угольных системах прямого химического цикла». Прикладная энергия. 208: 678–690. Дои:10.1016 / j.apenergy.2017.09.079. ISSN 0306-2619.
- ^ Lyngfelt, А. (2004). «Новая технология сжигания». Проблемы парниковых газов. №73: 2–3.
- ^ Люнгфельт, А. (2007). «Химико-петлевое сжигание твердого топлива». Проблемы парниковых газов. № 85: 9–10.
- ^ Люнгфельт, А. (2011). «Кислородоносители для химико-петлевого горения - 4000 ч. Опыта». Нефтегазовая наука и технологии. 66:2 (2): 161–172. Дои:10.2516 / ogst / 2010038.
- ^ Lyngfelt, A; Линдерхольм, К. "Химическое горение твердого топлива - состояние и недавний прогресс". 13-я Международная конференция по технологиям контроля парниковых газов, GHGT-13, 14–18 ноября 2016 г., Лозанна, Швейцария.
- ^ а б Тонг, Эндрю; Бейхэм, Самуэль; Kathe, Mandar V .; Цзэн, Лян; Ло, Сивэй; Фань, Лян-Ши (январь 2014 г.). «Разработка процесса химического замкнутого цикла синтез-газа на основе железа и химического замкнутого цикла с прямым углем в Университете штата Огайо». Прикладная энергия. 113: 1836–1845. Дои:10.1016 / j.apenergy.2013.05.024. ISSN 0306-2619.
- ^ Люнгфельт, Андерс; Лекнер, Бо (01.11.2015). «Котел мощностью 1000 МВт для химического сжигания твердого топлива - Обсуждение проекта и стоимости». Прикладная энергия. 157: 475–487. Дои:10.1016 / j.apenergy.2015.04.057.
- ^ Маттиссон, Т., Люнгфельт, А. и Лейон, Х. (2009). «Химическая петля с кислородным отсоединением для сжигания твердого топлива». Международный журнал по контролю за парниковыми газами. 3: 11–19. Дои:10.1016 / j.ijggc.2008.06.002.CS1 maint: несколько имен: список авторов (связь)
- ^ Абад А., Аданес-Рубио, И. Гаян, П. Гарсиа-Лабиано, Ф. де Диего Л. Ф. и Аданес Дж. (2012). «Демонстрация химического цикла с отсоединением кислорода (CLOU) в непрерывно работающей установке мощностью 1,5 кВт с использованием носителя кислорода на основе меди». Международный журнал по контролю за парниковыми газами. 6: 189–200. Дои:10.1016 / j.ijggc.2011.10.016. HDL:10261/75134.CS1 maint: несколько имен: список авторов (связь)
- ^ Чжоу, Чжицюань; Хан, Лу; Норднесс, Оскар; Боллас, Джордж М. (2015-05-01). «Непрерывный режим химико-петлевого горения (ХЖК) и химико-петлевого с кислородно-разобщающей реакционной способностью носителей кислорода CuO». Прикладной катализ B: Окружающая среда. 166–167: 132–144. Дои:10.1016 / j.apcatb.2014.10.067.
- ^ Rydén, M .; Люнгфельт, А. (2006). «Использование парового риформинга для производства водорода с улавливанием диоксида углерода путем химического горения». Журнал водородной энергетики. 31 (10): 1631–1641. Дои:10.1016 / j.ijhydene.2005.12.003.
- ^ Rydén, M .; Lyngfelt, A. & Mattisson, T. (2006). «Производство синтез-газа путем химического реформинга в лабораторном реакторе непрерывного действия». Топливо. 85 (12–13): 1631–1641. Дои:10.1016 / j.fuel.2006.02.004.
- ^ Тонг, Эндрю; Шридхар, Дипак; Сунь, Чжэньчао; Kim, Hyung R .; Цзэн, Лян; Ван, Фэй; Ван, Давэй; Kathe, Mandar V .; Луо, Сивэй (январь 2013 г.). «Непрерывное производство водорода высокой чистоты на субпилотной установке с химическим контуром синтез-газа мощностью 25 кВт со 100% улавливанием углерода». Топливо. 103: 495–505. Дои:10.1016 / j.fuel.2012.06.088. ISSN 0016-2361.
- ^ Lyngfelt, A. и Mattisson, T. (2011) «Материалы для горения с химическим контуром», в D. Stolten и V. Scherer, Эффективное улавливание углерода для угольных электростанций, Weinheim, WILEY-VCH Verlag GmbH & Co .. KGaA , 475-504.
- ^ Adánez, J .; Абад, А. Гарсиа-Лабиано; Ф. Гаян П. и де Диего, Л. (2012). «Прогресс в технологиях горения и риформинга с химическим циклом.'". Прогресс в области энергетики и горения. 38 (2): 215–282. Дои:10.1016 / j.pecs.2011.09.001. HDL:10261/78793.
- ^ Ким, Дж. Я., Эллис, Н., Лим, К. Дж. И Грейс, Дж. Р. (2019). «Истирание бинарных смесей твердых тел в установке струйного истирания». Порошковая технология. 352: 445–452. Дои:10.1016 / j.powtec.2019.05.010.CS1 maint: несколько имен: список авторов (связь)
внешняя ссылка
- http://www.entek.chalmers.se/lyngfelt/co2/co2.htm
- chemical-looping.at
- Химическая петля, Институт горения, Университет Западного Кентукки.
- http://www.icb.csic.es/index.php?id=144&L=1
- http://www3.imperial.ac.uk/carboncaptureandstorage
- http://www.encapco2.org/sp4.htm
- Технология улавливания углерода и химического образования петель - последняя информация о прогрессе. Запись вебинара, Карл Боззуто и Global CCS Institute, 11 июля 2012 г.
