Краун эфир - Crown ether
Краун эфиры цикличны химические соединения которые состоят из кольца, содержащего несколько эфир группы. Самые распространенные краун-эфиры - циклические. олигомеры из окись этилена, повторяющееся звено - этиленокси, то есть –CH2CH2O–. Важными членами этой серии являются тетрамеры (п = 4), пентамер (п = 5), а гексамер (п = 6). Термин «корона» относится к сходству между структурой краун-эфира, связанного с катион, а Корона сидя на голове человека. Первое число в названии краун-эфира относится к числу атомов в цикле, а второе число относится к числу тех атомов, которые кислород. Краун-эфиры намного шире, чем олигомеры оксида этилена; важная группа происходит из катехол.
Краун-эфиры прочно связывают определенные катионы, образуя комплексы. Атомы кислорода хорошо расположены для координации с катионом, расположенным внутри кольца, тогда как внешняя часть кольца гидрофобна. Образующиеся катионы часто образуют соли, растворимые в неполярных растворителях, и по этой причине краун-эфиры полезны в фазовый катализ. В дентальность полиэфира влияет на сродство краун-эфира к различным катионам. Например, 18-краун-6 имеет высокое сродство к катиону калия, 15-краун-5 - к катиону натрия и 12-краун-4 - к катиону лития. Высокое сродство 18-краун-6 к ионам калия способствует его токсичности. Самый маленький краун-эфир, все еще способный связывать катионы, - это 8-краун-4,[1] с самым большим, экспериментально подтвержденным краун-эфиром является 81-краун-27.[2] Краун-эфиры - не единственные макроциклические лиганды, которые обладают сродством к катиону калия. Ионофоры Такие как валиномицин также проявляют заметное предпочтение катиона калия перед другими катионами.
Было показано, что краун-эфиры взаимодействуют с Кислоты Льюиса через электростатическое, σ-отверстие (см. галогенная связь ) взаимодействия между основными атомами кислорода Льюиса краун-эфира и электрофильным кислотным центром Льюиса.[3][4]
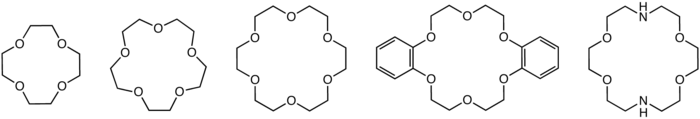 Структуры обычных краун-эфиров: 12-крон-4, 15-крон-5, 18-крон-6, дибензо-18-краун-6, и диаза-18-корона-6
Структуры обычных краун-эфиров: 12-крон-4, 15-крон-5, 18-крон-6, дибензо-18-краун-6, и диаза-18-корона-6
История
В 1967 г. Чарльз Педерсен, кто был химик работая в DuPont, открыл простой метод синтеза краун-эфира, когда пытался приготовить комплексообразователь за двухвалентные катионы.[5][6] Его стратегия заключалась в соединении двух катехолат группы через один гидроксил на каждой молекуле. Это связывание определяет полидентатный лиганд, который может частично охватывать катион и, за счет этого, ионизация фенольных гидроксилов нейтрализует связанный дикатион. Он был удивлен изолировать побочный продукт это сильно комплексовало калий катионы. Ссылаясь на более ранние работы по роспуску калий в 16-корон-4,[7][8] он понял, что цикличность полиэфиры представляет собой новый класс комплексообразователей, способных связывать щелочной металл катионы. Он приступил к сообщению о систематических исследованиях синтеза и связывающих свойств краун-эфиров в основополагающей серии статей. Поля органический синтез, катализаторы межфазного переноса, и другие новые дисциплины выиграли от открытия краун-эфиров. Педерсен особенно популяризировал дибензо краун-эфиры.[9]

Педерсен поделился 1987 Нобелевская премия по химии за открытие путей синтеза и связывающих свойств краун-эфиров.
Сродство к катионам
Из-за хелатный эффект и макроциклический эффект, краун-эфиры проявляют более сильное сродство к различным катионам, чем их разделенные или ациклический аналоги. Таким образом, селективность катионов по ионам щелочных металлов в основном зависит от размера и плотности заряда иона, а также от размера полости краун-эфира.[11]
| Коронный эфир | Размер полости / Å[12] | Предпочтительный щелочной ион[13] | Эффективные ионные радиусы / Å[14] |
|---|---|---|---|
| 12-крон-4 | 0.6-0.75 | Ли+ | 0.76 |
| 15-крон-5 | 0.86-0.92 | Na+ | 1.02 |
| 18-крон-6 | 1.34-1.55 | K+ | 1.38 |
| 21-крон-7 | 1.7-2.1 | CS+ | 1.67 |
Сродство данного краун-эфира к катионам литий, натрий, и калий могут меняться на несколько величин, что объясняется большой разницей в их плотности заряда. Между катионами калия, рубидий, и изменения сродства цезия менее заметны, так как их плотность заряда меняется меньше, чем у щелочных металлов в более ранние периоды.[11]
Помимо высокого сродства к катионам калия, 18-крон-6 может также связываться с протонированными аминами и образовывать очень стабильные комплексы как в растворе, так и в газовой фазе. Немного аминокислоты, Такие как лизин, содержат первичный амин на их боковых цепях. Эти протонированные аминогруппы могут связываться с полостью 18-краун-6 и образовывать стабильные комплексы в газовой фазе. Водородные связи образуются между тремя атомами водорода протонированных аминов и тремя атомами кислорода 18-краун-6. Эти водородные связи делают комплекс стабильным аддуктом. За счет включения люминесцентных заместителей в их основную цепь эти соединения оказались чувствительными ионными зондами, поскольку изменения в поглощении или флуоресценции фотоактивных групп могут быть измерены для очень низких концентраций присутствующего металла.[15] Некоторые привлекательные примеры включают макроциклы, содержащие доноры кислорода и / или азота, которые присоединены к полиароматическим соединениям, таким как антрацены (через положения 9 и / или 10).[16] или нафталины (через позиции 2 и 3).[17] Некоторые модификации ионофоров красителей краун-эфирами обнаруживают коэффициенты экстинкции которые зависят от длины цепи связанных катионов.[18]
Смотрите также
Рекомендации
- ^ ван дер Хам, Алекс; Хансен, Томас; Лоддер, Геррит; Codée, Jeroen D.C .; Hamlin, Trevor A .; Филиппов, Дмитрий В. (2019). «Вычислительные и ЯМР-исследования комплексообразования литий-иона с 8-краун-4». ХимФисХим. 20 (16): 2103–2109. Дои:10.1002 / cphc.201900496. ISSN 1439-7641. ЧВК 6772996. PMID 31282054.
- ^ Ян, Чжао; Ю, Га-Эр; Кук, Дженнифер; Али-Абид, Зиад; Вирас, Кириакос; Мацуура, Хироатсу; Райан, Энтони Дж; Бут, Колин (1996). «Получение и кристалличность большого незамещенного краун-эфира, циклической гептакозы (оксиэтилен) (cyc2o = E2, 81-краун-27), изученных с помощью спектроскопии комбинационного рассеяния, рассеяния рентгеновских лучей и дифференциальной сканирующей калориметрии». J. Chem. Soc., Faraday Trans.. 92 (17): 3173–3182. Дои:10.1039 / FT9969203173.
- ^ Марченко, К. М .; Мерсье, Х. П. А .; Шробильген, Г. Дж. (2018). «Стабильный комплекс краун-эфира с соединением благородного газа». Энгью. Chem. Int. Эд. 57 (38): 12448–12452. Дои:10.1002 / anie.201806640. PMID 29953704.
- ^ Lipkowski, J .; Fonari, M. S .; Кравцов, В. Ц .; Симонов, Ю. А .; Ганин, Э. В .; Гембольдт В. О. (1996). «Фторид сурьмы (III): комплексы включения с краун-эфирами». J. Chem. Кристаллогр. 26 (12): 823. Дои:10.1007 / BF01670315. S2CID 93153773.
- ^ Педерсен, К. Дж. (1967). «Циклические полиэфиры и их комплексы с солями металлов». Журнал Американского химического общества. 89 (26): 7017–7036. Дои:10.1021 / ja01002a035.
- ^ Педерсен, К. Дж. (1967). «Циклические полиэфиры и их комплексы с солями металлов». Журнал Американского химического общества. 89 (10): 2495–2496. Дои:10.1021 / ja00986a052.
- ^ ГБ 785229, Stewart, D.G .; D. Y. Waddan & E. T. Borrows, выпущенный 1957-10-23
- ^ Down, J. L .; Lewis, J .; Мур, Б .; Уилкинсон, Г. (1959). «761. Растворимость щелочных металлов в эфирах». Журнал химического общества: 3767. Дои:10.1039 / jr9590003767.
- ^ Педерсен, Чарльз Дж. (1988). "Макроциклические полиэфиры: простой полиэфир дибензо-18-краун-6 и дициклогексил-18-краун-6 полиэфир". Органический синтез.; Коллективный объем, 6, п. 395
- ^ Ashton, P.R .; Goodnow, T. T .; Kaifer, A.E .; Реддингтон, М. В .; Славин, А. М. З .; Spencer, N .; Stoddart, J. F .; Vicent, C .; Уильямс, Д. Дж. (1989). "A [2] Catenane на заказ". Angewandte Chemie International Edition на английском языке. 28 (10): 1396–1399. Дои:10.1002 / anie.198913961.CS1 maint: использует параметр авторов (ссылка на сайт)
- ^ а б Лиу, Цзянь-Чжун; Бродбелт, Дженнифер С. (июль 1992 г.). «Определение порядков относительного сродства к ионам щелочных металлов краун-эфиров и ациклических аналогов кинетическим методом». Журнал Американского общества масс-спектрометрии. 3 (5): 543–548. Дои:10.1016 / 1044-0305 (92) 85031-э. ISSN 1044-0305. PMID 24234497.
- ^ Christensen, J.J .; Изатт, Р. (1978), "ПРЕДИСЛОВИЕ", Синтетические мультидентатные макроциклические соединения, Elsevier, стр. Ix – x, Дои:10.1016 / b978-0-12-377650-1.50005-8, ISBN 978-0-12-377650-1
- ^ Френсдорф, Ханс К. (февраль 1971 г.). «Константы устойчивости циклических полиэфирных комплексов с одновалентными катионами». Журнал Американского химического общества. 93 (3): 600–606. Дои:10.1021 / ja00732a007. ISSN 0002-7863.
- ^ Шеннон, Р. Д. (1976-09-01). «Пересмотренные эффективные ионные радиусы и систематические исследования межатомных расстояний в галогенидах и халькогенидах». Acta Crystallographica Раздел A. 32 (5): 751–767. Дои:10.1107 / s0567739476001551. ISSN 0567-7394.
- ^ Fabbrizzi, L .; Francese, G .; Licchelli, M .; Pallavicini, P .; Perotti, A .; Poggi, A .; Sacchi, D .; Тальетти, А. (1997). Desvergne, J. P .; Чарник, А. В. (ред.). Хемосенсоры распознавания ионов и молекул. Серия ASI НАТО C. 492. Дордрехт: Kluwer Academic Publishers. п. 75.
- ^ Bouas-Laurent, H .; Desvergne, J. P .; Fages, F .; Марсау, П. (1993). A. W., Чарник (ред.). Флуоресцентные хемосенсоры для распознавания ионов и молекул. Серия симпозиумов ACS 538. Вашингтон, округ Колумбия: Американское химическое общество. п.59.
- ^ Шарги, Всевышний; Эбрахимпурмогхаддам, Сакине (2008). «Удобный и эффективный метод получения уникальных флуорофоров нафто-аза-краун-эфиров лариата». Helvetica Chimica Acta. 91 (7): 1363–1373. Дои:10.1002 / hlca.200890148.
- ^ Фудзи, Каору; Цубаки, Кадзунори; Танака, Киёси; Хаяси, Нориюки; Оцубо, Тадамуне; Киношита, Такаяоши (апрель 1999 г.). «Визуализация молекулярной длины α, ω-диаминов и температуры рецептором на основе фенолфталеина и краун-эфира». Журнал Американского химического общества. 121 (15): 3807–3808. Дои:10.1021 / ja9836444. ISSN 0002-7863.
внешняя ссылка
- Педерсен, Чарльз (1987). «Нобелевская лекция» (PDF). Нобелевская премия.
- Молекулярная корона


