Кубический атом - Cubical atom
В кубический атом был ранним атомный модель, в которой электроны были расположены в восьми углах куба в неполярном атоме или молекуле. Эта теория была разработана в 1902 г. Гилберт Н. Льюис и опубликована в 1916 году в статье «Атом и молекула» и использовалась для объяснения феномена валентность.[1] Теория Льюиса была основана на Правило Абегга. Дальнейшее развитие он получил в 1919 г. Ирвинг Ленгмюр как кубический октет атома.[2] На рисунке ниже показаны структурные изображения элементов второго ряда периодическая таблица.
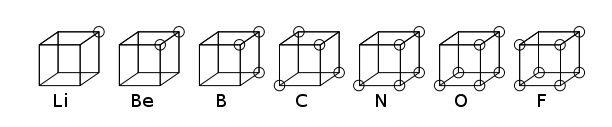
Хотя от кубической модели атома вскоре отказались в пользу квантово-механический модель на основе Уравнение Шредингера, и поэтому в настоящее время представляет принципиальный исторический интерес, он представляет собой важный шаг к пониманию химической связи. В статье Льюиса 1916 г. также была введена концепция электронная пара в Ковалентная связь, то Правило октета, и теперь называемый Структура Льюиса.
Связь в модели кубического атома
Одинарные ковалентные связи образуются, когда два атома имеют общий край, как в структуре C ниже. Это приводит к разделению двух электронов. Ионные связи образуются при переносе электрона от одного куба к другому без общего ребра (структура А). Промежуточное состояние, при котором используется только один угол (структура B) также постулировал Льюис.

Двойные связи образуются разделением грани между двумя кубическими атомами. Это приводит к разделению четырех электронов:
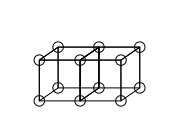
Тройные связи не могут быть объяснены с помощью модели кубического атома, потому что невозможно иметь два куба с тремя параллельными ребрами. Льюис предположил, что электронные пары в атомных связях обладают особым притяжением, что приводит к тетраэдрической структуре, как на рисунке ниже (новое расположение электронов представлено пунктирными кружками в середине толстых краев). Это позволяет образовывать одинарную связь, разделяя угол, двойную связь, разделяя край, и тройную связь, разделяя границу. Он также учитывает свободное вращение вокруг одинарных связей и тетраэдрическую геометрию метана.

Смотрите также
Рекомендации
- ^ Льюис, Гилберт Н. (1916-04-01). «Атом и молекула». Журнал Американского химического общества. 38 (4): 762–785. Дои:10.1021 / ja02261a002.
- ^ Ленгмюр, Ирвинг (1919-06-01). «Расположение электронов в атомах и молекулах». Журнал Американского химического общества. 41 (6): 868–934. Дои:10.1021 / ja02227a002.
