Микрочип ДНК - DNA microarray
А Микрочип ДНК (также широко известный как ДНК чип или биочип ) представляет собой набор микроскопических пятен ДНК, прикрепленных к твердой поверхности. Ученые используют ДНК микрочипы измерить выражение уровни большого количества генов одновременно или генотип несколько регионов генома. Каждое пятно ДНК содержит пикомоли (10−12 родинки ) определенной последовательности ДНК, известной как зонды (или же репортеры или же олигосы ). Это может быть короткий отрезок ген или другой элемент ДНК, который используется для гибридизировать а кДНК или образец кРНК (также называемый антисмысловой РНК) (называемый цель) в условиях повышенной жесткости. Гибридизация зонд-мишень обычно выявляется и количественно определяется путем обнаружения флуорофор -, серебро-, или хемилюминесценция меченые мишени для определения относительного количества последовательностей нуклеиновых кислот в мишени. Исходные массивы нуклеиновых кислот представляли собой макро-массивы размером примерно 9 см × 12 см, а первый компьютерный анализ на основе изображений был опубликован в 1981 году.[1] Это было изобретено Патрик О. Браун.
Принцип
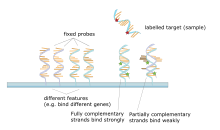
Основным принципом микрочипов является гибридизация двух цепей ДНК, свойство дополнительный последовательности нуклеиновых кислот для специфического спаривания друг с другом путем образования водородные связи между дополнительными пары нуклеотидных оснований. Большое количество комплементарных пар оснований в нуклеотидной последовательности означает более плотную нековалентный соединение между двумя прядями. После смывания неспецифических связывающих последовательностей только сильно спаренные цепи останутся гибридизированными. Флуоресцентно меченые последовательности-мишени, которые связываются с последовательностью зонда, генерируют сигнал, который зависит от условий гибридизации (таких как температура) и отмывки после гибридизации. Общая сила сигнала от пятна (объекта) зависит от количества целевого образца, связывающегося с зондами, присутствующими в этом месте. Микромассивы используют относительное количественное определение, при котором интенсивность признака сравнивается с интенсивностью того же признака в различных условиях, а идентичность признака определяется по ее положению.
Использование и типы

Существует множество типов массивов, и самое широкое различие заключается в том, расположены ли они пространственно на поверхности или на кодированных шариках:
- Традиционный твердофазный массив представляет собой набор упорядоченных микроскопических «пятен», называемых элементами, каждое из которых содержит тысячи идентичных и специфических зондов, прикрепленных к твердой поверхности, например стекло, пластик или же кремний биочип (широко известный как геномный чип, ДНК-чип или же массив генов). Тысячи этих элементов могут быть размещены в известных местах на одном микрочипе ДНК.
- Альтернативный набор шариков представляет собой набор микроскопических шариков из полистирола, каждый из которых имеет определенный зонд и соотношение двух или более красителей, которые не мешают флуоресцентным красителям, используемым в целевой последовательности.
ДНК-микрочипы могут использоваться для обнаружения ДНК (как в сравнительная геномная гибридизация ) или детектировать РНК (чаще всего как кДНК после обратная транскрипция ), которые могут или не могут быть переведены в белки. Процесс измерения экспрессии генов с помощью кДНК называется анализ экспрессии или же профилирование выражений.
Приложения включают:
| Применение или технология | Синопсис |
|---|---|
| Профилирование экспрессии генов | В мРНК или же профилирование экспрессии генов экспериментировать с выражение уровни тысяч генов одновременно отслеживаются для изучения эффектов определенных методов лечения, болезни и стадии развития экспрессии генов. Например, профилирование экспрессии генов на основе микрочипов можно использовать для идентификации генов, экспрессия которых изменяется в ответ на патогены или других организмов, сравнивая экспрессию генов в инфицированных клетках или тканях с таковой в неинфицированных клетках или тканях.[2] |
| Сравнительная геномная гибридизация | Оценка содержания генома в различных клетках или близкородственных организмах, как первоначально описано Патрик Браун, Джонатан Поллак, Аш Ализаде и коллеги в Стэнфорд.[3][4] |
| GeneID | Небольшие микрочипы для проверки идентификаторов организмов в пище и кормах (например, ГМО [1] ), микоплазмы в культуре клеток, или патогены для выявления болезней, в основном комбинируя ПЦР и технология микрочипов. |
| Иммунопреципитация хроматина на чипе | Последовательности ДНК, связанные с конкретным белком, можно выделить с помощью иммунопреципитирующий этот белок (ЧИП ), эти фрагменты можно затем гибридизировать с микрочипом (например, мозаичный массив ), позволяя определять занятость сайтов связывания белков по всему геному. Пример белка для иммунопреципитат являются модификациями гистонов (H3K27me3, H3K4me2, H3K9me3 и т. Д.), Белок группы поликомб (PRC2: Suz12, PRC1: YY1) и белок группы триторакс (Ash1) для изучения эпигенетический ландшафт или же РНК-полимераза II изучить транскрипционный ландшафт. |
| DamID | Аналогично ЧИП области генома, связанные с интересующим белком, можно выделить и использовать для зондирования микроматрицы для определения занятости сайта связывания. В отличие от ChIP, DamID не требует антител, но использует метилирование аденина рядом с сайтами связывания белка для селективной амплификации этих областей, введенных путем экспрессии незначительных количеств интересующего белка, слитого с бактериальными. ДНК-аденин-метилтрансфераза. |
| Обнаружение SNP | Идентификация однонуклеотидный полиморфизм среди аллели внутри или между популяциями.[5] Некоторые приложения микрочипов используют обнаружение SNP, в том числе генотипирование, судебно-медицинский анализ, измерение предрасположенность болезни, выявление кандидатов в лекарства, оценка зародышевый мутации у людей или соматический мутации при раке, оценка потеря гетерозиготности, или же генетическая связь анализ. |
| Альтернативная сварка обнаружение | An массив экзонов в конструкции используются зонды, специфичные для ожидаемых или потенциальных участков соединения прогнозируемых экзоны для гена. Он имеет промежуточную плотность или покрытие для типичного массива экспрессии генов (с 1–3 зондами на ген) и массива геномных листов (с сотнями или тысячами зондов на ген). Он используется для анализа экспрессии альтернативных форм сплайсинга гена. Массивы экзонов имеют различную конструкцию, в которых используются зонды, предназначенные для обнаружения каждого отдельного экзона известных или предсказанных генов, и могут использоваться для обнаружения различных изоформ сплайсинга. |
| Гены слияния микрочип | Микроматрица гена слияния может обнаруживать транскрипты слияния, например из образцов рака. В основе этого лежит принцип альтернативное сращивание микрочипы. Стратегия дизайна олигонуклеотидов позволяет комбинировать измерения соединений химерных транскриптов с экзонными измерениями индивидуальных партнеров слияния. |
| Тайлинг-массив | Массивы листов генома состоят из перекрывающихся зондов, предназначенных для плотного представления интересующей области генома, иногда размером с целую хромосому человека. Цель состоит в том, чтобы эмпирически обнаружить выражение стенограммы или же альтернативно соединенные формы которые, возможно, не были ранее известны или предсказаны. |
| Двухцепочечные микрочипы B-ДНК | Правосторонние двухцепочечные микроматрицы B-ДНК можно использовать для характеристики новых лекарств и биологических препаратов, которые могут использоваться для связывания определенных областей иммобилизованной, интактной двухцепочечной ДНК. Этот подход можно использовать для подавления экспрессии генов.[6][7] Они также позволяют охарактеризовать их структуру в различных условиях окружающей среды. |
| Двухцепочечные микрочипы Z-ДНК | Левосторонние двухцепочечные микромассивы Z-ДНК можно использовать для идентификации коротких последовательностей альтернативной структуры Z-ДНК, расположенных в более длинных участках правосторонних генов B-ДНК (например, усиление транскрипции, рекомбинация, редактирование РНК).[6][7] Микроматрицы также позволяют охарактеризовать их структуру в различных условиях окружающей среды. |
| Многонитевые микроматрицы ДНК (микроматрицы триплексной ДНК и микроматрицы квадруплексной ДНК) | Микромассивы многоцепочечной ДНК и РНК можно использовать для идентификации новых лекарств, которые связываются с этими многонитевыми последовательностями нуклеиновых кислот. Этот подход может быть использован для открытия новых лекарств и биологических препаратов, способных подавлять экспрессию генов.[6][7][8][9] Эти микроматрицы также позволяют охарактеризовать их структуру в различных условиях окружающей среды. |
Изготовление
Микроматрицы могут быть изготовлены разными способами, в зависимости от количества исследуемых зондов, стоимости, требований к настройке и типа задаваемого научного вопроса. Массивы от коммерческих поставщиков могут содержать от 10 датчиков до 5 миллионов или более микрометровых датчиков.
Пятнистый vs. на месте синтезированные массивы
Микроматрицы могут быть изготовлены с использованием различных технологий, включая печать остроконечными булавками на предметных стеклах, фотолитография использование готовых масок, фотолитография с использованием устройств динамического микрозеркала, струйная печать,[10][11] или же электрохимия на решетках микроэлектродов.
В пятнистые микрочипы, зонды олигонуклеотиды, кДНК или небольшие фрагменты ПЦР продукты, соответствующие мРНК. Зонды синтезированный перед нанесением на поверхность массива, а затем «наносятся» на стекло. Обычный подход использует набор тонких булавок или игл, которыми управляет роботизированная рука, которая погружается в лунки, содержащие ДНК-зонды, и затем помещает каждый зонд в обозначенные места на поверхности матрицы. Результирующая «сетка» зондов представляет профили нуклеиновых кислот приготовленных зондов и готова для приема дополнительных кДНК или «мишеней» кРНК, полученных из экспериментальных или клинических образцов. Этот метод используется учеными-исследователями во всем мире для получения «in- house »распечатали микрочипы из собственных лабораторий. Эти массивы могут быть легко настроены для каждого эксперимента, потому что исследователи могут выбирать зонды и места для печати на массивах, синтезировать зонды в своей собственной лаборатории (или на объекте-сотрудничестве) и определять массивы. Затем они могут создать свои собственные меченые образцы для гибридизации, гибридизировать образцы с массивом и, наконец, сканировать массивы с помощью своего собственного оборудования. Это обеспечивает относительно недорогой микрочип, который можно настраивать для каждого исследования, и позволяет избежать затрат на покупку часто более дорогих коммерческих массивов, которые могут представлять огромное количество генов, не представляющих интереса для исследователя. Существуют публикации, указывающие на собственные точечные микроматрицы могут не обеспечивать такой же уровень чувствительности по сравнению с коммерческими массивами олигонуклеотидов,[12] возможно, из-за небольших размеров партии и меньшей эффективности печати по сравнению с промышленным производством олигомассивов.
В олигонуклеотидные микрочипы, зонды представляют собой короткие последовательности, предназначенные для сопоставления частей последовательности известных или предсказанных открытые рамки для чтения. Хотя олигонуклеотидные зонды часто используются в «пятнистых» микроматрицах, термин «олигонуклеотидный массив» чаще всего относится к конкретной методике производства. Массивы олигонуклеотидов получают путем печати коротких олигонуклеотидных последовательностей, предназначенных для представления одного гена или семейства вариантов сплайсинга генов с помощью синтезирующий эта последовательность непосредственно на поверхность массива вместо нанесения неповрежденных последовательностей. Последовательности могут быть длиннее (60-мерные зонды, такие как Agilent конструкции) или короче (25-мерные зонды производства Affymetrix ) в зависимости от желаемой цели; более длинные зонды более специфичны для отдельных генов-мишеней, более короткие зонды могут быть обнаружены с большей плотностью по всему массиву и дешевле в производстве. Один метод, используемый для получения массивов олигонуклеотидов, включает фотолитографический синтез (Affymetrix) на подложке из диоксида кремния, где свет и светочувствительные маскирующие агенты используются для «построения» последовательности по одному нуклеотиду за раз по всему массиву.[13] Каждый применимый зонд выборочно «демаскируется» перед погружением массива в раствор одного нуклеотида, затем происходит реакция маскирования, и следующий набор зондов демаскируется при подготовке к воздействию другого нуклеотида. После многих повторений последовательности каждого зонда становятся полностью построенными. Совсем недавно технология синтеза массивов без маски от NimbleGen Systems объединила гибкость с большим количеством датчиков.[14]
Двухканальное и одноканальное обнаружение

Двухцветные микрочипы или же двухканальные микрочипы обычно гибридизированный с кДНК, полученной из двух сравниваемых образцов (например, больная ткань по сравнению со здоровой тканью), и которые помечены двумя разными флуорофоры.[15] Флуоресцентный красители, обычно используемые для мечения кДНК, включают Сай 3, который имеет длину волны флуоресцентного излучения 570 нм (соответствует зеленой части светового спектра), и Сай 5 с длиной волны флуоресцентного излучения 670 нм (соответствует красной части светового спектра). Два образца кДНК, меченных Су, смешивают и гибридизируют в один микрочип, который затем сканируют в сканере микрочипов для визуализации флуоресценции двух флуорофоров после возбуждение с лазер луч определенной длины волны. Относительные интенсивности каждого флуорофора затем можно использовать в анализе на основе соотношений для идентификации генов с повышенной и пониженной регуляцией.[16]
Олигонуклеотидные микроматрицы часто содержат контрольные зонды, предназначенные для гибридизации с Всплески РНК. Степень гибридизации между шипами и контрольными зондами используется для нормализовать измерения гибридизации для целевых зондов. Хотя в редких случаях абсолютные уровни экспрессии генов могут быть определены в двухцветном массиве, относительные различия в экспрессии между разными точками в образце и между образцами являются предпочтительным методом анализ данных для двухцветной системы. Примеры поставщиков таких микрочипов включают: Agilent с их платформой Dual-Mode, Eppendorf с их платформой DualChip для колориметрических Silverquant маркировка, а TeleChem International с Arrayit.
В одноканальные микрочипы или же одноцветные микрочипымассивы предоставляют данные об интенсивности для каждого зонда или набора зондов, указывающие на относительный уровень гибридизации с меченой мишенью. Однако они не указывают на истинные уровни изобилия гена, а скорее указывают относительное изобилие по сравнению с другими образцами или условиями при обработке в том же эксперименте. Каждая молекула РНК сталкивается с протоколом и смещением, зависящим от партии, на этапах амплификации, мечения и гибридизации в эксперименте, что делает сравнение генов одного и того же микрочипа неинформативным. Сравнение двух условий для одного и того же гена требует двух отдельных гибридизаций с одним красителем. Несколько популярных одноканальных систем - это Affymetrix «Gene Chip», Illumina «Bead Chip», одноканальные массивы Agilent, массивы Applied Microarrays «CodeLink» и Eppendorf «DualChip & Silverquant». Одно из преимуществ системы с одним красителем заключается в том, что отклоняющийся образец не может повлиять на необработанные данные, полученные из других образцов, потому что каждый чип матрицы подвергается воздействию только одного образца (в отличие от двухцветной системы, в которой один низкий -качественная выборка может существенно повлиять на общую точность данных, даже если другая выборка была высокого качества). Еще одно преимущество заключается в том, что данные легче сравнивать с массивами из различных экспериментов, если учитывать пакетные эффекты.
Одноканальная микроматрица может быть единственным выбором в некоторых ситуациях. Предполагать образцы необходимо сравнить: тогда количество экспериментов, требуемых с использованием двух массивов каналов, быстро становится невозможным, если образец не используется в качестве эталона.
| количество образцов | одноканальный микрочип | двухканальный микрочип | двухканальный микрочип (со ссылкой) |
|---|---|---|---|
| 1 | 1 | 1 | 1 |
| 2 | 2 | 1 | 1 |
| 3 | 3 | 3 | 2 |
| 4 | 4 | 6 | 3 |
Типичный протокол

Это пример ДНК-микрочип эксперимент который включает детали для конкретного случая, чтобы лучше объяснить эксперименты с ДНК-микрочипами, а также перечисляет модификации для РНК или другие альтернативные эксперименты.
- Два образца для сравнения (попарное сравнение) выращиваются / собираются. В этом примере обработанный образец (дело ) и необработанный образец (контроль ).
- В нуклеиновая кислота интереса очищен: это может быть РНК за профилирование выражений, ДНК за сравнительная гибридизация, или ДНК / РНК, связанные с определенным белок который иммунопреципитированный (Чип-на-чипе ) за эпигенетический или нормативные исследования. В этом примере выделена общая РНК (как ядерная, так и цитоплазматический ) к Экстракция тиоцианат-фенол-хлороформ гуанидиния (например. Тризол ), который изолирует большую часть РНК (тогда как колоночные методы имеют отсечение 200 нуклеотидов) и, если все сделано правильно, имеет лучшую чистоту.
- Очищенная РНК анализируется на качество (по капиллярный электрофорез ) и количество (например, используя NanoDrop или нанофотометр спектрометр ). Если материал приемлемого качества и присутствует в достаточном количестве (например,> 1мкг (хотя необходимое количество зависит от платформы микрочипа), эксперимент можно продолжить.
- Маркированный продукт создается через обратная транскрипция и сопровождаемый необязательным ПЦР усиление. РНК подвергается обратной транскрипции с помощью любого из праймеров polyT (которые амплифицируют только мРНК ) или случайные праймеры (которые амплифицируют всю РНК, большинство из которых рРНК ). miRNA микрочипы связывают олигонуклеотид с очищенной малой РНК (выделенной с помощью фракционирующего устройства), которая затем подвергается обратной транскрипции и амплификации.
- Метка добавляется либо на этапе обратной транскрипции, либо после амплификации, если она выполняется. В смысл маркировка зависит от микрочипа; например если этикетка добавлена смесью RT, кДНК является антисмысловым, а зонд микроматрицы является смысловым, за исключением отрицательных контролей.
- Этикетка обычно флуоресцентный; только одна машина использует радиоактивные метки.
- Маркировка может быть прямой (не используется) или косвенной (требуется этап связывания). Для двухканальных решеток стадия связи происходит перед гибридизацией, используя аминоаллил уридин трифосфат (аминоаллил-UTP или aaUTP) и NHS аминореактивные красители (такие как цианиновые красители ); для одноканальных решеток стадия связи происходит после гибридизации с использованием биотин и помечены стрептавидин. Модифицированные нуклеотиды (обычно в соотношении 1 аа УТФ: 4 ТТФ (тимидинтрифосфат )) добавляются ферментативно в низком соотношении к нормальным нуклеотидам, как правило, 1 на 60 оснований. Затем aaDNA очищают с помощью столбец (используя фосфатный буферный раствор, как Трис содержит аминогруппы). Аминоаллильная группа представляет собой аминогруппу на длинном линкере, присоединенном к азотистому основанию, который реагирует с реактивным красителем.
- Форма реплики, известная как переворот красителя, может использоваться для контроля красителя. артефакты в двухканальных экспериментах; для переворота красителя используется второй слайд с замененными метками (образец, который был помечен Cy3 на первом слайде, помечен Cy5, и наоборот). В этом примере аминоаллил -UTP присутствует в смеси с обратной транскрипцией.
- Помеченные образцы затем смешиваются с запатентованным гибридизация решение, которое может состоять из SDS, SSC, сульфат декстрана, блокирующий агент (например, Кот-1 ДНК, ДНК спермы лосося, ДНК тимуса теленка, ПолиА, или PolyT), Решение Денхардта, или же формамин.
- Смесь денатурируют и добавляют к микрочипам. Отверстия закрывают, и микроматрица гибридизируется либо в гибридной печи, где микроматрица перемешивают вращением, либо в смесителе, где микроматрица перемешивается путем переменного давления на микроматрицы.
- После ночной гибридизации все неспецифическое связывание смывается (SDS и SSC).
- Микроматрица сушится и сканируется с помощью устройства, которое использует лазер для возбуждения красителя и измеряет уровни излучения с помощью детектора.
- Изображение разбито на сетку с шаблоном, и интенсивность каждой функции (состоящей из нескольких пикселей) определяется количественно.
- Необработанные данные нормализованы; Самый простой метод нормализации состоит в том, чтобы вычесть интенсивность фона и масштабировать таким образом, чтобы общие интенсивности признаков двух каналов были равны, или использовать интенсивность эталонного гена для расчета t-значение для всех интенсивностей. Более сложные методы включают z-отношение, регрессия лёсса и лёсса и RMA (надежный многокристальный анализ) для чипов Affymetrix (одноканальный, кремниевый чип, на месте синтезированы короткие олигонуклеотиды).
Микромассивы и биоинформатика

Появление недорогих экспериментов с микрочипами создало несколько конкретных проблем биоинформатики:[нужна цитата ] множественные уровни репликации в экспериментальном дизайне (Экспериментальная конструкция ); количество платформ и независимых групп и формат данных (Стандартизация ); статистическая обработка данных (Анализ данных ); сопоставление каждого зонда с мРНК стенограмма, которую он измеряет (Аннотации ); огромный объем данных и возможность поделиться ими (Хранилище данных ).
Экспериментальная конструкция
Из-за биологической сложности экспрессии генов соображения экспериментального плана, которые обсуждаются в профилирование выражений статьи имеют решающее значение, если на основании полученных данных должны быть сделаны статистически и биологически обоснованные выводы.
При разработке эксперимента с микрочипами необходимо учитывать три основных элемента. Во-первых, для того, чтобы сделать выводы из эксперимента, необходимо воспроизведение биологических образцов. Во-вторых, технические повторы (два образца РНК, полученные от каждой экспериментальной единицы) помогают обеспечить точность и позволяют тестировать различия в группах лечения. Биологические реплики включают независимые экстракции РНК, а технические реплики могут быть двух аликвоты того же экстракта. В-третьих, пятна каждого клона кДНК или олигонуклеотида присутствуют в виде реплик (по крайней мере, дубликатов) на предметном стекле микроматрицы, чтобы обеспечить меру технической точности при каждой гибридизации. Очень важно обсудить информацию о подготовке и обращении с образцом, чтобы помочь идентифицировать независимые единицы в эксперименте и избежать завышенных оценок Статистическая значимость.[18]
Стандартизация
Обмен данными с микрочипов затруднен из-за отсутствия стандартизации в изготовлении платформ, протоколах анализа и методах анализа. Это представляет собой совместимость проблема в биоинформатика. Разные низовые Открытый исходный код проекты пытаются упростить обмен и анализ данных, произведенных с помощью непатентованных чипов:
Например, «Минимум информации об эксперименте с микрочипом» (MIAME ) контрольный список помогает определить уровень детализации, который должен существовать, и принимается многими журналы как требование для подачи документов с результатами микрочипов. Но MIAME не описывает формат информации, поэтому, хотя многие форматы могут поддерживать требования MIAME, по состоянию на 2007 год[Обновить] отсутствие формата позволяет проверить полное семантическое соответствие. Проект «Контроль качества MicroArray (MAQC)» проводится в США. Управление по контролю за продуктами и лекарствами (FDA) для разработки стандартов и показателей контроля качества, которые в конечном итоге позволят использовать данные MicroArray при открытии лекарств, клинической практике и принятии регулирующих решений.[19] В Общество МГЕД разработал стандарты для представления результатов экспериментов по экспрессии генов и соответствующих аннотаций.
Анализ данных

Наборы данных микрочипов обычно очень большие, и на точность анализа влияет ряд переменных. Статистический проблемы включают в себя учет эффектов фонового шума и соответствующие нормализация данных. Методы нормализации могут подходить для определенных платформ, а в случае коммерческих платформ анализ может быть частным.[20] Алгоритмы, влияющие на статистический анализ, включают:
- Анализ изображения: сетка, точечное распознавание отсканированного изображения (алгоритм сегментации), удаление или маркировка некачественных и малоинтенсивных объектов (называемых отметка).
- Обработка данных: вычитание фона (на основе глобального или локального фона), определение интенсивности пятен и соотношений интенсивностей, визуализация данных (например, см. Сюжет MA ), а также логарифмическое преобразование отношений, глобальных или местный нормализация отношений интенсивности и сегментация на регионы с различным количеством копий с использованием обнаружение шагов алгоритмы.[21]
- Анализ обнаружения классов: этот аналитический подход, иногда называемый классификацией без учителя или обнаружением знаний, пытается определить, объединяются ли микромассивы (объекты, пациенты, мыши и т. Д.) Или гены в группы. Выявление естественно существующих групп объектов (микрочипов или генов), которые объединяются в кластеры, может позволить обнаруживать новые группы, о существовании которых раньше не было известно. Во время анализа открытия знаний можно использовать различные методы неконтролируемой классификации с данными микрочипов ДНК для идентификации новых кластеров (классов) массивов.[22] Этот тип подхода не основан на гипотезах, а основан на итеративном распознавании образов или методах статистического обучения для нахождения «оптимального» количества кластеров в данных. Примеры методов неконтролируемого анализа включают самоорганизующиеся карты, нейронный газ, кластерный анализ k-средних,[23] иерархический кластерный анализ, кластеризация на основе геномной обработки сигналов[24] и кластерный анализ на основе моделей. Для некоторых из этих методов пользователь также должен определить меру расстояния между парами объектов. Хотя обычно используется коэффициент корреляции Пирсона, в литературе было предложено и оценено несколько других показателей.[25] Входные данные, используемые в анализе обнаружения классов, обычно основаны на списках генов, имеющих высокую информативность (низкий уровень шума) на основе низких значений коэффициента вариации или высоких значений энтропии Шеннона и т. Д. Определение наиболее вероятного или оптимального числа генов. кластеры, полученные в результате неконтролируемого анализа, называются достоверностью кластеров. Некоторые часто используемые метрики валидности кластера - это индекс силуэта, индекс Дэвиса-Болдина,[26] Индекс Данна или Губерта статистика.
- Анализ предсказания класса: этот подход, называемый контролируемой классификацией, устанавливает основу для разработки модели предсказания, в которую могут быть введены будущие неизвестные тестовые объекты, чтобы предсказать наиболее вероятную принадлежность тестовых объектов к классу. Контролируемый анализ[22] для прогнозирования классов используются такие методы, как линейная регрессия, k-ближайший сосед, квантование вектора обучения, анализ дерева решений, случайные леса, наивный байесовский метод, логистическая регрессия, регрессия ядра, искусственные нейронные сети, вспомогательные векторные машины, смесь экспертов, и контролируемый нервный газ. Кроме того, используются различные метаэвристические методы, такие как генетические алгоритмы, самоадаптация ковариационной матрицы, оптимизация роя частиц, и оптимизация колонии муравьев. Входные данные для предсказания класса обычно основаны на отфильтрованных списках генов, которые предсказывают класс, определенных с помощью классических тестов гипотез (следующий раздел), индекса разнообразия Джини или увеличения информации (энтропия).
- Статистический анализ, основанный на гипотезах: идентификация статистически значимых изменений в экспрессии генов обычно определяется с помощью t-тест, ANOVA, Байесовский метод[27]Тест Манна – Уитни методы, адаптированные к наборам данных микрочипов, которые учитывают множественные сравнения[28] или же кластерный анализ.[29] Эти методы оценивают статистическую мощность на основе вариаций, присутствующих в данных, и количества экспериментальных повторов, и могут помочь минимизировать Ошибки типа I и типа II в анализах.[30]
- Уменьшение размерности: аналитики часто сокращают количество измерений (генов) перед анализом данных.[22] Это может включать линейные подходы, такие как анализ главных компонентов (PCA) или нелинейное обучение многообразию (дистанционное метрическое обучение) с использованием ядра PCA, диффузионных карт, лапласовских собственных карт, локального линейного вложения, локально сохраняющихся проекций и отображения Сэммона.
- Сетевые методы: статистические методы, которые учитывают основную структуру генных сетей, представляя ассоциативные или причинные взаимодействия или зависимости между генными продуктами.[31] Сетевой анализ взвешенной коэкспрессии генов широко используется для идентификации модулей коэкспрессии и внутримодульных узловых генов. Модули могут соответствовать типам клеток или путям. Высокосвязные внутримодульные концентраторы лучше всего представляют соответствующие модули.
Данные микрочипа могут потребовать дополнительной обработки, направленной на уменьшение размерности данных, чтобы облегчить понимание и более сфокусированный анализ.[32] Другие методы позволяют анализировать данные, состоящие из небольшого количества биологических или технических копирует; например, пулы тестов Local Pooled Error (LPE) Стандартное отклонение генов с аналогичными уровнями экспрессии, чтобы компенсировать недостаточную репликацию.[33]
Аннотации
Связь между зондом и мРНК то, что он, как ожидается, обнаружит, нетривиально.[34] Некоторые мРНК могут перекрестно гибридизовать зонды в массиве, которые должны обнаруживать другую мРНК. Кроме того, мРНК могут испытывать систематическую ошибку амплификации, которая зависит от последовательности или молекулы. В-третьих, зонды, предназначенные для обнаружения мРНК определенного гена, могут полагаться на геномные данные. стандартное восточное время информация, которая неправильно связана с этим геном.
Хранилище данных
Было обнаружено, что данные микромассивов более полезны по сравнению с другими подобными наборами данных. Огромный объем данных, специализированные форматы (такие как MIAME ), а усилия по курированию, связанные с наборами данных, требуют специализированных баз данных для хранения данных. Ряд решений для хранилищ данных с открытым исходным кодом, таких как InterMine и БиоМарт, были созданы для конкретной цели интеграции различных наборов биологических данных, а также для поддержки анализа.
Альтернативные технологии
Достижения в области массового параллельного секвенирования привели к развитию РНК-Seq технология, которая позволяет использовать полный транскриптомный подход для характеристики и количественной оценки экспрессии генов.[35][36] В отличие от микрочипов, которые требуют наличия эталонного генома и транскриптома до того, как сам микрочип может быть сконструирован, RNA-Seq также может использоваться для новых модельных организмов, геном которых еще не секвенирован.[36]
Глоссарий
- An множество или же горка это собрание Особенности пространственно расположенные в двумерной сетке, расположенные в столбцы и строки.
- Блокировать или же подмассив: группа пятен, обычно сделанных за один раунд печати; несколько подмассивов / блоков образуют массив.
- Случай / контроль: парадигма экспериментального дизайна, особенно подходящая для системы двухцветной матрицы, в которой состояние, выбранное в качестве контроля (например, здоровая ткань или состояние), сравнивается с измененным состоянием (например, пораженной тканью или состоянием).
- Канал: the флуоресценция вывод, записанный в сканере на человека флуорофор и даже может быть ультрафиолетовым.
- Краситель флип или же замена красителя или же флюор разворот: взаимное мечение ДНК-мишеней двумя красителями для учета смещения красителя в экспериментах.
- Сканер: прибор, используемый для обнаружения и количественной оценки интенсивности флуоресценции пятен на предметном стекле микроматрицы путем выборочного возбуждения флуорофоров с помощью лазер и измеряя флуоресценцию с помощью фильтр (оптика) фотоумножитель система.
- Место или же особенность: небольшая область на матричном слайде, содержащая пикомоли определенных образцов ДНК.
- Другие соответствующие термины см .:
Смотрите также
- Технологии транскриптомики
- МАГИЯ
- Методы анализа микрочипов
- Базы данных микрочипов
- Цианин красители, такие как Cy3 и Cy5, обычно используются флуорофоры с микрочипами
- Анализ генного чипа
- Анализ значимости микрочипов
- Микромассив олигонуклеотидов, специфичных для метилирования
- Микрофлюидика или же лаборатория на кристалле
- Патогеномика
- Фенотип микрочип
- Системная биология
- Секвенирование всего генома
Рекомендации
- ^ Тауб, Флойд (1983). «Лабораторные методы: последовательные сравнительные гибридизации, проанализированные с помощью компьютерной обработки изображений, могут идентифицировать и количественно определять регулируемые РНК». ДНК. 2 (4): 309–327. Дои:10.1089 / dna.1983.2.309. PMID 6198132.
- ^ Адомас А; Heller G; Олсон А; Осборн Дж; Karlsson M; Нахалкова Ж; Van Zyl L; Sederoff R; Стенлид J; Finlay R; Asiegbu FO (2008). «Сравнительный анализ обилия транскриптов у Pinus sylvestris после заражения сапротрофным, патогенным или мутуалистическим грибком». Tree Physiol. 28 (6): 885–897. Дои:10.1093 / treephys / 28.6.885. PMID 18381269.
- ^ Поллак-младший; Perou CM; Ализаде А.А.; Эйзен МБ; Пергаменщиков А; Уильямс CF; Джеффри СС; Botstein D; Браун ПО (1999). «Полногеномный анализ изменений числа копий ДНК с использованием микрочипов кДНК». Нат Жене. 23 (1): 41–46. Дои:10.1038/12640. PMID 10471496. S2CID 997032.
- ^ Moran G; Стокса C; Thewes S; Hube B; Коулман, округ Колумбия; Салливан Д. (2004). «Сравнительная геномика с использованием микромассивов ДНК Candida albicans выявила отсутствие и расхождение генов, связанных с вирулентностью, у Candida dubliniensis». Микробиология. 150 (Pt 10): 3363–3382. Дои:10.1099 / мик.0.27221-0. PMID 15470115.
- ^ Hacia JG; Fan JB; Райдер О; Джин Л; Edgemon K; Ghandour G; Майер Р.А.; Вс Б; Hsie L; Роббинс СМ; Brody LC; Ван Д; Lander ES; Lipshutz R; Fodor SP; Коллинз Ф.С. (1999). «Определение предковых аллелей однонуклеотидных полиморфизмов человека с использованием массивов олигонуклеотидов высокой плотности». Нат Жене. 22 (2): 164–167. Дои:10.1038/9674. PMID 10369258. S2CID 41718227.
- ^ а б c Gagna, Claude E .; Ламберт, В. Кларк (1 мая 2009 г.). «Новые многоцепочечные, альтернативные, плазмидные и спиральные переходные ДНК и микромассивы РНК: значение для терапии». Фармакогеномика. 10 (5): 895–914. Дои:10.2217 / стр.09.27. ISSN 1744-8042. PMID 19450135.
- ^ а б c Gagna, Claude E .; Кларк Ламберт, W. (1 марта 2007 г.). «Клеточная биология, хемогеномика и хемопротеомика - приложение к открытию лекарств». Мнение эксперта об открытии лекарств. 2 (3): 381–401. Дои:10.1517/17460441.2.3.381. ISSN 1746-0441. PMID 23484648. S2CID 41959328.
- ^ Мукерджи, Анирбан; Васкес, Карен М. (1 августа 2011 г.). «Технология триплекс в исследованиях повреждений ДНК, репарации ДНК и мутагенеза». Биохимия. 93 (8): 1197–1208. Дои:10.1016 / j.biochi.2011.04.001. ISSN 1638-6183. ЧВК 3545518. PMID 21501652.
- ^ Родос, Даниэла; Липпс, Ханс Дж. (15 октября 2015 г.). «G-квадруплексы и их регуляторные роли в биологии». Исследования нуклеиновых кислот. 43 (18): 8627–8637. Дои:10.1093 / нар / gkv862. ISSN 1362-4962. ЧВК 4605312. PMID 26350216.
- ^ J Biochem Biophys Methods. 2000 16 марта; 42 (3): 105-10. ДНК-печать: использование стандартного струйного принтера для переноса нуклеиновых кислот на твердые носители. Goldmann T, Gonzalez JS.
- ^ Lausted C; и другие. (2004). «POSaM: быстрый, гибкий струйный синтезатор олигонуклеотидов и микроматрица с открытым исходным кодом». Геномная биология. 5 (8): R58. Дои:10.1186 / gb-2004-5-8-r58. ЧВК 507883. PMID 15287980.
- ^ Баммлер Т., Бейер Р.П .; Консорциум, члены Toxicogenomics Research; Керр, X; Цзин, LX; Лапидус, S; Ласарев Д.А.; Paules, RS; Li, JL; Филлипс, СО (2005). «Стандартизация глобального анализа экспрессии генов между лабораториями и на разных платформах». Нат методы. 2 (5): 351–356. Дои:10.1038 / nmeth754. PMID 15846362. S2CID 195368323.
- ^ Pease AC; Solas D; Салливан EJ; Cronin MT; Холмс С.П.; Фодор С.П. (1994). «Световые олигонуклеотидные матрицы для быстрого анализа последовательности ДНК». PNAS. 91 (11): 5022–5026. Bibcode:1994PNAS ... 91.5022P. Дои:10.1073 / пнас.91.11.5022. ЧВК 43922. PMID 8197176.
- ^ Nuwaysir EF; Хуанг В; Альберт TJ; Сингх Дж; Nuwaysir K; Pitas A; Ричмонд Т; Горский Т; Berg JP; Ballin J; McCormick M; Norton J; Pollock T; Sumwalt T; Мясник L; Портер D; Molla M; Зал C; Блаттнер Ф; Sussman MR; Уоллес Р.Л .; Cerrina F; Зеленый РД (2002). «Анализ экспрессии генов с использованием массивов олигонуклеотидов, полученных с помощью безмасковой фотолитографии». Genome Res. 12 (11): 1749–1755. Дои:10.1101 / гр.362402. ЧВК 187555. PMID 12421762.
- ^ Шалон Д; Smith SJ; Браун ПО (1996). «Система ДНК-микрочипов для анализа сложных образцов ДНК с использованием гибридизации двухцветных флуоресцентных зондов». Genome Res. 6 (7): 639–645. Дои:10.1101 / гр.6.7.639. PMID 8796352.
- ^ Тан Т; François N; Glatigny A; Agier N; Mucchielli MH; Aggerbeck L; Делакруа H (2007). «Оценка коэффициента экспрессии в экспериментах с двухцветным микрочипом значительно улучшена за счет исправления несовпадения изображений». Биоинформатика. 23 (20): 2686–2691. Дои:10.1093 / биоинформатика / btm399. PMID 17698492.
- ^ Шафи, Томас; Лоу, Рохан (2017). «Структура эукариотических и прокариотических генов». WikiJournal of Медицина. 4 (1). Дои:10.15347 / wjm / 2017.002. ISSN 2002-4436.
- ^ Черчилль, Джорджия (2002). «Основы экспериментального дизайна для микрочипов кДНК» (PDF). Природа Генетика. добавка. 32: 490–5. Дои:10,1038 / ng1031. PMID 12454643. S2CID 15412245. Архивировано из оригинал (– Академический поиск) 8 мая 2005 г.. Получено 12 декабря 2013.
- ^ Центр токсикоинформатики NCTR - Проект MAQC
- ^ "Просигна | Алгоритм Просигна". prosigna.com. Получено 22 июн 2017.
- ^ Литтл, M.A .; Джонс, Н. (2011). "Обобщенные методы и решатели для кусочно-постоянных сигналов: Часть I" (PDF). Труды Королевского общества А. 467 (2135): 3088–3114. Дои:10.1098 / rspa.2010.0671. ЧВК 3191861. PMID 22003312.
- ^ а б c Петерсон, Лейф Э. (2013). Классификационный анализ ДНК-микрочипов. Джон Уайли и сыновья. ISBN 978-0-470-17081-6.
- ^ De Souto M et al. (2008) Кластеризация данных экспрессии гена рака: сравнительное исследование, BMC Bioinformatics, 9 (497).
- ^ Istepanian R, Sungoor A, Nebel J-C (2011) Сравнительный анализ обработки геномных сигналов для кластеризации данных микрочипов, IEEE Transactions on NanoBioscience, 10 (4): 225-238.
- ^ Ясковяк, Пабло А; Кампелло, Рикардо Дж.Б. Коста, Иван Г (2014). «О выборе подходящих расстояний для кластеризации данных по экспрессии генов». BMC Bioinformatics. 15 (Приложение 2): S2. Дои:10.1186 / 1471-2105-15-S2-S2. ЧВК 4072854. PMID 24564555.
- ^ Большакова Н., Азуайе Ф. (2003) Методы кластерной проверки данных экспрессии генома, Обработка сигналов, Том. 83. С. 825–833.
- ^ Бен Гал, I .; Шани, А .; Gohr, A .; Grau, J .; Арвив, С .; Шмилович, А .; Пощ, С .; Гроссе, И. (2005). «Идентификация сайтов связывания факторов транскрипции с байесовскими сетями переменного порядка». Биоинформатика. 21 (11): 2657–2666. Дои:10.1093 / биоинформатика / bti410. ISSN 1367-4803. PMID 15797905.
- ^ Юк Фай Леунг и Дуччио Кавальери, Основы анализа данных микрочипов кДНК. Тенденции в генетике, том 19, № 11, ноябрь 2003 г.
- ^ Priness I .; Маймон О .; Бен-Гал И. (2007). «Оценка кластеризации экспрессии генов с помощью меры расстояния взаимной информации». BMC Bioinformatics. 8 (1): 111. Дои:10.1186/1471-2105-8-111. ЧВК 1858704. PMID 17397530.
- ^ Wei C; Ли Дж; Бумгарнер RE (2004). «Размер выборки для обнаружения дифференциально экспрессируемых генов в экспериментах с микрочипами». BMC Genomics. 5: 87. Дои:10.1186/1471-2164-5-87. ЧВК 533874. PMID 15533245.
- ^ Эммерт-Штрейб, Ф. и Демер, М. (2008). Анализ данных микрочипов Сетевой подход. Wiley-VCH. ISBN 978-3-527-31822-3.
- ^ Wouters L; Gõhlmann HW; Bijnens L; Касс СУ; Molenberghs G; Леви П.Дж. (2003). «Графическое исследование данных экспрессии генов: сравнительное исследование трех многомерных методов». Биометрия. 59 (4): 1131–1139. CiteSeerX 10.1.1.730.3670. Дои:10.1111 / j.0006-341X.2003.00130.x. PMID 14969494.
- ^ Jain N; Thatte J; Braciale T; Ley K; О'Коннелл М; Ли Дж. К. (2003). «Тест с локальной объединенной ошибкой для идентификации дифференциально экспрессируемых генов с небольшим количеством реплицированных микрочипов». Биоинформатика. 19 (15): 1945–1951. Дои:10.1093 / биоинформатика / btg264. PMID 14555628.
- ^ Barbosa-Morais, N.L .; Даннинг, М. Дж .; Samarajiwa, S.A .; Darot, J. F. J .; Ritchie, M.E .; Lynch, A. G .; Таваре, С. (18 ноября 2009 г.). «Конвейер повторного аннотирования для Illumina BeadArrays: улучшение интерпретации данных экспрессии генов». Исследования нуклеиновых кислот. 38 (3): e17. Дои:10.1093 / nar / gkp942. ЧВК 2817484. PMID 19923232.
- ^ Мортазави, Али; Брайан А. Уильямс; Кеннет МакКью; Лориан Шеффер; Барбара Уолд (июль 2008 г.). «Картирование и количественная оценка транскриптомов млекопитающих с помощью RNA-Seq». Нат методы. 5 (7): 621–628. Дои:10.1038 / nmeth.1226. ISSN 1548-7091. PMID 18516045. S2CID 205418589.
- ^ а б Ван, Чжун; Марк Герштейн; Майкл Снайдер (январь 2009 г.). «RNA-Seq: революционный инструмент для транскриптомики». Нат Рев Жене. 10 (1): 57–63. Дои:10.1038 / nrg2484. ISSN 1471-0056. ЧВК 2949280. PMID 19015660.
внешняя ссылка
| Библиотечные ресурсы о ДНК-микрочипы |
- Экспрессия гена в Керли
- Микромасштабные продукты и услуги для биохимии и молекулярной биологии в Керли
- Продукты и услуги для экспрессии генов в Керли
- Онлайн-сервисы для анализа экспрессии генов в Керли
- Микромассив Анимация 1Lec.com
- PLoS Biology Primer: анализ микроматриц
- Завершение технологии микрочипов
- ArrayMining.net - бесплатный веб-сервер для онлайн-анализа микрочипов
- Microarray - как это работает?
- Комментарий PNAS: открытие принципов природы на основе математического моделирования данных микрочипов ДНК
- Виртуальный эксперимент с ДНК-микрочипом