Интелектин - Википедия - Intelectin
| Эмбриональный эпидермальный лектин Xenopus | |||||||
|---|---|---|---|---|---|---|---|
 Мономерная структура XEEL-CRD со связанным D-глицерин-1-фосфатом. Белок окрашивается с помощью сине-красного градиента от N- к C-концу. Ионы кальция показаны зелеными сферами, а скоординированные молекулы воды показаны красными сферами. | |||||||
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | itln1 | ||||||
| Entrez | 398574 | ||||||
| HomoloGene | 111044 | ||||||
| PDB | 4WN0 | ||||||
| RefSeq (мРНК) | NM_001089101.1 | ||||||
| RefSeq (Prot) | NP_001082570.1 | ||||||
| UniProt | Q800K0 | ||||||
| |||||||
| Интелектин-1 человека | |||||||
|---|---|---|---|---|---|---|---|
 Мономерная структура человеческого интелектина со связанной аллил-бета-D-галактофуранозой. Белок окрашивается с помощью сине-красного градиента от N- к C-концу. Ионы кальция показаны зелеными сферами, а скоординированные молекулы воды показаны красными сферами. | |||||||
| Идентификаторы | |||||||
| Символ | ITLN1 | ||||||
| Альт. символы | hIntL-1 | ||||||
| Ген NCBI | 55600 | ||||||
| HGNC | 18259 | ||||||
| OMIM | 609873 | ||||||
| PDB | 4WMY | ||||||
| RefSeq | NP_060095 | ||||||
| UniProt | Q8WWA0 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 1 q21.3 | ||||||
| |||||||
Интелектины находятся лектины (углеводсвязывающие белки), экспрессируемые в организме человека и других хордовые. Люди экспрессируют два типа интелектинов, кодируемых ITLN1 и ITLN2 гены соответственно.[1][2] Некоторые интелектины связывают специфичные для микробов углеводные остатки. Таким образом, предполагается, что интелектины действуют как иммунные лектины.[3][4] Несмотря на то, что интелектины содержат фибриноген-подобный домен, обнаруженный в фиколины В семействе иммунных лектинов наблюдается значительное структурное расхождение.[5] Таким образом, интелектины могут не функционировать по тому же пути лектин-комплемент. Большинство интелектинов все еще плохо охарактеризовано, и они могут выполнять различные биологические роли. Также было показано, что человеческий интелектин-1 (hIntL-1) связывает лактоферрин,[6] но функциональные последствия еще предстоит выяснить. Кроме того, hIntL-1 является основным компонентом астматической слизи.[7] и может также участвовать в физиологии инсулина.[8]
Разнообразие
Первый интелектин был открыт в Xenopus laevis ооцит и называется XL35 или XCGL-1.[9][10][11] X. laevis ооцит также содержит близкородственный XCGL-2.[12] Кроме того, X. laevis Эмбрионы выделяют лектин эпидермиса эмбриона Xenopus в окружающую воду, предположительно для связывания микробов.[13][14] XSL-1 и XSL-2 также выражаются в X. laevis сыворотка при стимуляции липополисахаридом.[15] Два дополнительных кишечных интеллектина обнаружены в X. laevis[16]
У человека есть два интеллектина: hIntL-1 (оментин) и hIntL-2.[17] Мышь также имеет два интеллектина: mIntL-1 и mIntL-2.[18]
Иммунная система
Несколько линий доказательств предполагают, что интелектины распознают микробы и могут функционировать как защитный белок врожденного иммунитета. Оболочечный интелектин - это опсонин для фагоцитоза гемоцитами.[19] Было показано, что интелектин амфиоксуса агглютинирует бактерии.[20][21] У рыбок данио и радужной форели экспрессия интелектина стимулируется при воздействии микробов.[22][23][24] Млекопитающие, такие как овцы и мыши, также повышают экспрессию интелектина при паразитарной инфекции.[25][26] Увеличение экспрессии интелектина при воздействии микробов подтверждает гипотезу о том, что интелектины играют роль в иммунной системе.
Структура
Хотя для функционирования интелектинам требуется ион кальция, последовательности не имеют ничего общего с Лектины С-типа.[3] Кроме того, всего около 50 аминокислот (фиброноген-подобный домен) выравниваются с любым известным белком, в частности с белком. фиколин семья.[2] Первые структурные детали интелектина проистекают из кристаллической структуры селенометионин -меченый домен распознавания углеводов XEEL (Se-Met XEEL-CRD), решаемый с помощью Se-ГРУСТНЫЙ.[5] XEEL-CRD был экспрессирован и мечен Se-Met в Дай пять клеток насекомых с использованием рекомбинантного бакуловирус. Фибриноген-подобная складка сохраняется, несмотря на дивергенцию аминокислотной последовательности. Однако в интелектине присутствуют обширные вставки по сравнению с фиколинами, что делает интелектин отдельным структурным классом лектинов.[5] Структура Se-Met XEEL-CRD затем позволяет структурное решение путем молекулярная замена XEEL-CRD, связанного с D-глицерин-1-фосфатом (GroP),[5] апо-человеческий интелектин-1 (hIntL-1),[4] и hIntL-1, связанный с галактофуранозой.[4]
Каждая полипептидная цепь XEEL и hIntL-1 содержит три связанных иона кальция: два в структурном сайте кальция и один в сайте связывания лиганда.[4][5] Аминокислотные остатки в структурном сайте кальция законсервированы среди интелектинов, таким образом, вероятно, что большинство, если не все, интелектины имеют два структурных иона кальция.[5]
В сайте связывания лиганда XEEL и hIntL-1 экзоциклический вицинальный диол углеводного лиганда непосредственно координируется с ионом кальция.[4][5] Существуют большие вариации в остатках сайта связывания лиганда среди гомологов интелектина, что позволяет предположить, что семейство интелектинов может иметь широкую лигандную специфичность и биологические функции.[5] Поскольку не существует соглашений о нумерации интелектина в различных организмах, не следует предполагать функциональную гомологию на основе числа интелектина. Например, hIntL-1 имеет остатки глутаминовой кислоты в сайте связывания лиганда для координации иона кальция, в то время как интелектин-1 рыбок данио лишен этих кислотных остатков.[5] Остатки сайта связывания лиганда интектина-2 рыбок данио аналогичны остаткам, присутствующим в hIntL-1.
- Лигандный способ связывания интелектинов

Xenopus сайт связывания лиганда эмбрионального эпидермального лектина (XEEL) со связанным D-глицерин-1-фосфатом. Ион кальция показан зеленой сферой, а упорядоченные молекулы воды показаны красными сферами.[5]

Сайт связывания лиганда человеческого интелектина-1 (hIntL-1) со связанной аллил-бета-D-галактофуранозой. Ион кальция показан зеленой сферой, а упорядоченные молекулы воды показаны красными сферами.[4]
Олигомерное состояние
hIntL-1 представляет собой тример с дисульфидной связью, как показано невосстанавливающим SDS-PAGE[3] и рентгеновская кристаллография.[4] Несмотря на отсутствие межмолекулярных дисульфидных связей, XEEL-CRD является тримерным в растворе.[5] N-концевой пептид полноразмерного XEEL отвечает за димеризацию тримерного XEEL-CRD в гексамерный полноразмерный XEEL с дисульфидной связью.[5] Следовательно, N-концы интелектинов часто ответственны за образование олигомеров, связанных дисульфидной связью. В гомологах интелектина, где N-концевые цистеины отсутствуют, сам CRD может все еще быть способен образовывать нековалентный олигомер в растворе.
- Тримерные структуры интелектинов

Тримерный человеческий интелектин-1 с дисульфидной связью.[4]
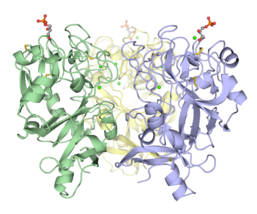
Тримерный домен распознавания углеводов эпидермального лектина эмбриона Xenopus (XEEL-CRD). Обширные биофизические исследования убедительно показывают, что XEEL-CRD является тримером в растворе, несмотря на отсутствие межмолекулярных дисульфидных связей, обнаруженных в hIntL-1.[5]
Рекомендации
- ^ Ли Дж. К., Баум Л. Г., Мормен К., Пирс М. (август 2004 г.). «Х-лектины: новое семейство, гомологичное лектину XL-35 ооцитов Xenopus laevis». Журнал гликоконъюгатов. 21 (8–9): 443–50. CiteSeerX 10.1.1.537.3931. Дои:10.1007 / s10719-004-5534-6. PMID 15750785. S2CID 41789407.
- ^ а б Янь Дж, Сюй Л., Чжан И, Чжан Ц., Чжан Ц., Чжао Ф, Фэн Л. (октябрь 2013 г.). «Сравнительный геномный и филогенетический анализ семейства генов intelectin: значение для их происхождения и эволюции». Развитие и сравнительная иммунология. 41 (2): 189–99. Дои:10.1016 / j.dci.2013.04.016. PMID 23643964.
- ^ а б c Цудзи С., Уэхори Дж., Мацумото М., Сузуки Ю., Мацухиса А., Тоошима К., Сея Т. (июнь 2001 г.). «Интелектин человека - это новый растворимый лектин, который распознает галактофуранозу в углеводных цепях клеточной стенки бактерий». Журнал биологической химии. 276 (26): 23456–63. Дои:10.1074 / jbc.M103162200. PMID 11313366.
- ^ а б c d е ж грамм час Wesener DA, Wangkanont K, McBride R, Song X, Kraft MB, Hodges HL, Zarling LC, Splain RA, Smith DF, Cummings RD, Paulson JC, Forest KT, Kiessling LL (август 2015 г.). «Распознавание микробных гликанов человеческим интелектином-1». Структурная и молекулярная биология природы. 22 (8): 603–10. Дои:10.1038 / nsmb.3053. ЧВК 4526365. PMID 26148048.
- ^ а б c d е ж грамм час я j k л м Вангканонт К., Везенер Д.А., Видани Дж. А., Кисслинг Л.Л., Forest KT (январь 2016 г.). «Структуры эмбрионального эпидермального лектина Xenopus раскрывают консервативный механизм распознавания микробных гликанов». Журнал биологической химии. 291 (11): 5596–610. Дои:10.1074 / jbc.M115.709212. ЧВК 4786701. PMID 26755729.
- ^ Сузуки Я., Шин К., Лённердал Б. (декабрь 2001 г.). «Молекулярное клонирование и функциональная экспрессия рецептора лактоферрина кишечника человека». Биохимия. 40 (51): 15771–9. Дои:10.1021 / bi0155899. PMID 11747454.
- ^ Kerr SC, Carrington SD, Oscarson S, Gallagher ME, Solon M, Yuan S, Ahn JN, Dougherty RH, Finkbeiner WE, Peters MC, Fahy JV (апрель 2014 г.). «Интелектин-1 является важным белковым компонентом патологической слизи, связанной с эозинофильным воспалением дыхательных путей при астме». Американский журнал респираторной медицины и реанимации. 189 (8): 1005–7. Дои:10.1164 / rccm.201312-2220LE. ЧВК 4098098. PMID 24735037.
- ^ Ян Р.З., Ли М.Дж., Ху Х., Молись Дж., Ву Х.Б., Хансен Б.К., Шульдинер А.Р., Фрид С.К., МакЛенитан Дж.С., Гонг Д.В. (июнь 2006 г.). «Идентификация оментина как нового депо-специфического адипокина в жировой ткани человека: возможная роль в модулировании действия инсулина». Американский журнал физиологии. Эндокринология и метаболизм. 290 (6): E1253–61. Дои:10.1152 / ajpendo.00572.2004. PMID 16531507.
- ^ Роберсон М.М., Баронды С.Х. (июль 1982 г.). «Лектин эмбрионов и ооцитов Xenopus laevis. Очистка и свойства». Журнал биологической химии. 257 (13): 7520–4. PMID 7085636.
- ^ Нишихара Т., Вайрик Р. Э., Рабочий П. К., Чен Ю. Х., Хедрик Д. Л. (октябрь 1986 г.). «Выделение и характеристика лектина из кортикальных гранул яиц Xenopus laevis». Биохимия. 25 (20): 6013–20. Дои:10.1021 / bi00368a027. PMID 3098282.
- ^ Ли Дж. К., Бакхаултс П., Уилкс С., Тейльет М., Кинг М. Л., Мормен К. В., Пирс М. (апрель 1997 г.). «Клонирование и экспрессия лектина ооцитов Xenopus laevis и характеристика уровней его мРНК на раннем этапе развития». Гликобиология. 7 (3): 367–72. Дои:10.1093 / гликоб / 7.3.367. PMID 9147045.
- ^ Сёдзи Х, Икенака К., Накакита С., Хаяма К., Хирабаяси Дж., Арата Й, Касаи К., Ниси Н., Накамура Т. (июль 2005 г.). «Xenopus galectin-VIIa связывает N-гликаны членов семейства лектинов кортикальных гранул (xCGL и xCGL2)». Гликобиология. 15 (7): 709–20. Дои:10.1093 / glycob / cwi051. PMID 15761024.
- ^ Нагата С., Наканиси М., Нанба Р., Фудзита Н. (июль 2003 г.). "Экспрессия развития XEEL, новой молекулы семейства лектинов кортикальных гранул ооцитов Xenopus". Гены развития и эволюция. 213 (7): 368–70. Дои:10.1007 / s00427-003-0341-9. PMID 12802587. S2CID 41996445.
- ^ Nagata S (март 2005 г.). «Выделение, характеристика и экстраэмбриональная секреция эмбрионального эпидермального лектина Xenopus laevis, XEEL». Гликобиология. 15 (3): 281–90. Дои:10.1093 / glycob / cwi010. PMID 15537792.
- ^ Нагата С., Нишияма С., Икадзаки Ю. (июнь 2013 г.). «Бактериальные липополисахариды стимулируют выработку XCL1, кальций-зависимого липополисахаридсвязывающего лектина в сыворотке крови у Xenopus laevis». Развитие и сравнительная иммунология. 40 (2): 94–102. Дои:10.1016 / j.dci.2013.02.008. PMID 23454582.
- ^ Nagata S (февраль 2016 г.). «Идентификация и характеристика нового интелектина в пищеварительном тракте Xenopus laevis». Развитие и сравнительная иммунология. 59: 229–239. Дои:10.1016 / j.dci.2016.02.006. PMID 26855011.
- ^ Ли Дж. К., Шни Дж., Панг М., Вольферт М., Баум Л. Г., Мормен К. В., Пирс М. (январь 2001 г.). "Человеческие гомологи лектина XL35 кортикальных гранул ооцитов Xenopus". Гликобиология. 11 (1): 65–73. Дои:10.1093 / гликоб / 11.1.65. PMID 11181563.
- ^ Лу Чж, ди Доменико А., Райт С.Х., Найт ПА, Уайтлоу С.Б., Пембертон А.Д. (2011). «Штамм-специфические вариации числа копий в локусе интелектина на 129 хромосоме 1 мыши». BMC Genomics. 12 (1): 110. Дои:10.1186/1471-2164-12-110. ЧВК 3048546. PMID 21324158.
- ^ Абе Й, Токуда М., Ишимото Р., Азуми К., Йокосава Х. (апрель 1999 г.). «Уникальная первичная структура, клонирование кДНК и функция галактозоспецифичного лектина из асцидиевой плазмы». Европейский журнал биохимии / FEBS. 261 (1): 33–9. Дои:10.1046 / j.1432-1327.1999.00238.x. PMID 10103030.
- ^ Ян Дж, Ван Дж, Чжао И, Чжан Дж, Бай Ц, Чжан Ц, Чжан Ц, Ли К., Чжан Х, Ду Х, Фэн Л. (июль 2012 г.). «Идентификация гомолога интелектина amphioxus, который предпочтительно агглютинирует грамположительные, а не грамотрицательные бактерии, вероятно, из-за разной способности связывания с LPS и PGN». Иммунология рыб и моллюсков. 33 (1): 11–20. Дои:10.1016 / j.fsi.2012.03.023. PMID 22475783.
- ^ Ян Дж., Чжан С., Чжан И, Ли К., Сюй Л., Го Л., Конг И., Фэн Л. (май 2013 г.). «Характеристика и сравнительный анализ двух интелектинов амфиоксуса, участвующих в врожденном иммунном ответе». Иммунология рыб и моллюсков. 34 (5): 1139–46. Дои:10.1016 / j.fsi.2013.01.017. PMID 23428515.
- ^ Линь Б., Цао З., Су П, Чжан Х, Ли М, Линь И, Чжао Д., Шэнь И, Цзин С., Чен С., Сюй А. (март 2009 г.). «Характеристика и сравнительный анализ интелектинов рыбок данио: высококонсервативные последовательности, разнообразные структуры и функции». Иммунология рыб и моллюсков. 26 (3): 396–405. Дои:10.1016 / j.fsi.2008.11.019. PMID 19100836.
- ^ Рассел С., Янг К.М., Смит М., Хейс М.А., Ламсден Дж. С. (июль 2008 г.). «Идентификация, клонирование и локализация в тканях интеллектуального белка радужной форели (Oncorhynchus mykiss), который связывает бактерии и хитин». Иммунология рыб и моллюсков. 25 (1–2): 91–105. Дои:10.1016 / j.fsi.2008.02.018. PMID 18502147.
- ^ Рассел С., Хейс М.А., Ламсден Дж. С. (январь 2009 г.). «Иммуногистохимическая локализация лестдерлектина и интелектина радужной форели в здоровой и инфицированной радужной форели (Oncorhynchus mykiss)». Иммунология рыб и моллюсков. 26 (1): 154–63. Дои:10.1016 / j.fsi.2008.03.001. PMID 19046637.
- ^ Datta R, deSchoolmeester ML, Hedeler C, Paton NW, Brass AM, Else KJ (июль 2005 г.). «Идентификация новых генов в кишечной ткани, которые регулируются после заражения кишечными нематодами-паразитами». Инфекция и иммунитет. 73 (7): 4025–33. Дои:10.1128 / IAI.73.7.4025-4033.2005. ЧВК 1168561. PMID 15972490.
- ^ French AT, Knight PA, Smith WD, Brown JK, Craig NM, Pate JA, Miller HR, Pemberton AD (март 2008 г.). «Повышение регуляции интелектина у овец после заражения Teladorsagia circincta». Международный журнал паразитологии. 38 (3–4): 467–75. Дои:10.1016 / j.ijpara.2007.08.015. PMID 17983620.
дальнейшее чтение
- Wesener DA, Wangkanont K, McBride R, Song X, Kraft MB, Hodges HL, Zarling LC, Splain RA, Smith DF, Cummings RD, Paulson JC, Forest KT, Kiessling LL (август 2015 г.). «Распознавание микробных гликанов человеческим интелектином-1». Структурная и молекулярная биология природы. 22 (8): 603–10. Дои:10.1038 / nsmb.3053. ЧВК 4526365. PMID 26148048. для исчерпывающего анализа связывания лиганда человеческого интелектина-1 (hIntL-1). В статье также показано, как hIntL-1 может различать микробные клетки и клетки млекопитающих.
- Вангканонт К., Везенер Д.А., Видани Дж. А., Кисслинг Л.Л., Forest KT (январь 2016 г.). «Структуры эмбрионального эпидермального лектина Xenopus обнаруживают консервативный механизм распознавания микробных гликанов». Журнал биологической химии. 291 (11): 5596–610. Дои:10.1074 / jbc.M115.709212. ЧВК 4786701. PMID 26755729. для обсуждения того, как была решена первая структура интелектина (XEEL-CRD). Глубокий биофизический и эволюционный анализ семейства интелектинов в свете доступных трехмерных структур также дает существенное понимание этого семейства белков, которое ранее не оценивалось. Статья представляет собой самый последний обзор биохимии семейства интелектинов.
- Ян Дж, Сюй Л., Чжан И, Чжан Ц., Чжан Ц., Чжао Ф., Фэн Л. (октябрь 2013 г.). «Сравнительный геномный и филогенетический анализ семейства генов интелектина: значение для их происхождения и эволюции». Развитие и сравнительная иммунология. 41 (2): 189–99. Дои:10.1016 / j.dci.2013.04.016. PMID 23643964. для комплексного геномного анализа интелектинов различных организмов.




