Метаний - Википедия - Methanium
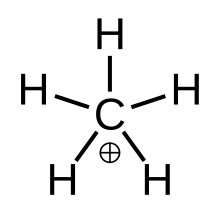 «Истинный» метан, метастабильное переходное состояние. CH+ 5 | |
 Метан, CH 3(ЧАС 2)+ | |
| Имена | |
|---|---|
| Другие имена карбоний (не рекомендуется из-за нескольких определений)[1] | |
| Идентификаторы | |
3D модель (JSmol ) |
|
| |
| |
| Характеристики | |
| CH5+ | |
| Молярная масса | 17.050 г · моль−1 |
| Основание конъюгата | Метан |
| Структура | |
| тригонально-бипирамидный | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
В химия, метаний это сложный положительный ион с формулой [CH
3(ЧАС
2)]+, а именно молекулу с одним углерод атом связанный до трех водород атомы и одну молекулу водорода, несущую +1 электрический заряд. Это суперкислотный и один из ионы ония действительно самый простой ион карбония.
Метан может производиться в лаборатории в виде разреженного газа или в виде разбавленных сверхкислот. Впервые он был подготовлен в 1950 г. и опубликован в 1952 г. Виктор Талроуз и его помощница Анна Константиновна Любимова.[2][3] Это происходит как промежуточные виды в химических реакциях.
Ион метания назван в честь метан (CH
4) по аналогии с выводом ион аммония (NH+
4) из аммиак (NH
3).
Структура
Метаний можно представить как CH+
3 ион карбения с молекула водорода взаимодействует с пустой орбиталью в 3-центр-2-электронная связь. Связующая электронная пара в H2 Молекула разделяется между двумя атомами водорода и одним атомом углерода, образующими связь 3-центр-2-электрон.[4]
Два атома водорода в H2 молекула может постоянно обмениваться положениями с тремя атомами водорода в CH+
3 ион (изменение конформации, называемое псевдовращение в частности Ягодный механизм ). Поэтому ион метания считается флюсионная молекула. Энергетический барьер для обмена довольно низок и возникает даже при очень низких температурах.[5][6]
ИК-спектроскопия был использован для получения информации о различных конформациях иона метания.[7][8][9] В ИК-спектре простого метана есть две полосы C-H от симметричного и асимметричного растяжения примерно на 3000 см.−1 и две полосы около 1400 см−1 от симметричных и несимметричных изгибных колебаний. В спектре CH+
5 три асимметричных валентных колебания присутствуют в районе 2800–3000 см.−1, качательная вибрация на 1300 см−1, а изгибная вибрация на 1100 1300 см−1.
Подготовка
Метаний можно получить из метана под действием очень сильных кислот, таких как фторантимоновая кислота (пентафторид сурьмы SbF
5 в фтороводород ВЧ).[10]
Приблизительно 270 Па давления и температуры окружающей среды, ион метана CH+
4 будет реагировать с нейтральным метаном с образованием метания и метильный радикал:[11]
- CH+
4 + CH
4 → CH+
5 + CH•
3
Стабильность и реакции
Катионы, полученные реакцией метана с SbF
5 + HF стабилизируются за счет взаимодействия с молекулами HF.
При низком давлении (около 1 мм рт. Ст.) И температуре окружающей среды метан не реагирует с нейтральным метаном.[11]
Рекомендации
- ^ Химия, Международный союз теоретических и прикладных наук (2009). ион карбония. Сборник химической терминологии ИЮПАК. ИЮПАК. Дои:10.1351 / goldbook.C00839. ISBN 978-0-9678550-9-7. Получено 27 ноября 2018.
- ^ Талроуз В. Л., Любимова А. К. // Докл. Акад. АН СССР, 86, 909-912 (1952) (на русском языке: Тальрозе, В. Л., А. К. Любимова. "Вторичные процессы в ионном источнике масс-спектрометра". ДАН СССР 86 (1952): 909-912)
- ^ Николаев, Евгений (1998). «Виктор Талроуз: признательность». Журнал масс-спектрометрии. 33 (6): 499–501. Bibcode:1998JMSp ... 33..499N. Дои:10.1002 / (SICI) 1096-9888 (199806) 33: 6 <499 :: AID-JMS684> 3.0.CO; 2-C. ISSN 1076-5174.
- ^ Расул, Голам; Пракаш, Г. Сурья; Олах, Джордж А. (2011). «Сравнительное исследование гиперкоординированных ионов карбония и их борных аналогов: задача для спектроскопистов». Письма по химической физике. 517 (1–3): 1–8. Bibcode:2011CPL ... 517 .... 1R. Дои:10.1016 / j.cplett.2011.10.020.
- ^ Шрайнер, Питер Р .; Ким, Сын Джун; Шефер, Генри Ф .; фон Раге Шлейер, Пол (1993). "CH+
5: Бесконечная история или последнее слово? ». Журнал химической физики. 99 (5): 3716–3720. Дои:10.1063/1.466147. - ^ Мюллер, Хендрик; Куцельнигг, Вернер; Нога, Йозеф; Клоппер, Вим (1997). «CH5 +: история продолжается. Явно коррелированное исследование связанных кластеров». Журнал химической физики. 106 (5): 1863. Дои:10.1063/1.473340.
- ^ Белый, Эдмунд Т .; Тан, Цзянь; Ока, Такеши (1999). "CH+
5: Наблюдаемый инфракрасный спектр ". Наука. 284 (5411): 135. Bibcode:1999Наука ... 284..135Вт. Дои:10.1126 / science.284.5411.135. PMID 10102811. - ^ Оскар Асвани, Падма Кумар П.; Редлих, Бритта; Гегеманн, Илка; Шлеммер, Стефан; Маркс, Доминик (2005). "Понимание инфракрасного спектра голого CH+
5". Наука. 309 (5738): 1219–1222. Bibcode:2005Научный ... 309.1219A. Дои:10.1126 / science.1113729. PMID 15994376. S2CID 28745636. - ^ Хуан, Синьчуань; Маккой, Энн Б.; Боуман, Джоэл М.; Джонсон, Линдси М .; Сэвидж, Чандра; Донг, Фэн; Несбитт, Дэвид Дж. (2006). «Квантовая деконструкция инфракрасного спектра CH+
5". Наука. 311 (5757): 60–63. Bibcode:2006Научный ... 311 ... 60H. Дои:10.1126 / science.1121166. PMID 16400143. S2CID 26158108. - ^ Sommer, J .; Йост, Р. (2000). «Ионы карбения и карбония в активации малых алканов, катализируемой жидкой и твердой суперкислотами» (PDF). Чистая и прикладная химия. 72 (12): 2309–2318. Дои:10.1351 / pac200072122309. S2CID 46627813.
- ^ а б Филд, F. H .; Мансон, М. С. Б. (1965). «Реакции газообразных ионов. XIV. Масс-спектрометрические исследования метана при давлениях до 2 Торр». Журнал Американского химического общества. 87 (15): 3289–3294. Дои:10.1021 / ja01093a001.
