Нитрон-олефин (3 + 2) циклоприсоединение - Nitrone-olefin (3+2) cycloaddition
В нитрон-олефин (3 + 2) циклоприсоединение реакция - это комбинация нитрон с алкен или же алкин создать изоксазолин или же изоксазолидин через [3 + 2] циклоприсоединение процесс.[1] Эта реакция 1,3-диполярное циклоприсоединение, в котором нитрон действует как 1,3-диполь и алкен или алкин в качестве диполярофила.
Механизм и стереохимия
Когда нитроны объединяются либо с алкенами, либо с алкинами, [3 + 2] циклоприсоединение приводит к образованию новой связи C – C и новой связи C – O. Циклоприсоединение стереоспецифично по отношению к конфигурации алкена; однако диастереоселективность в реакциях C-замещенных нитронов часто бывает низкой.[2] Региоселективность контролируется доминирующими граничными орбиталями, взаимодействующими во время реакции, и субстраты с электронно различными заместителями имеют тенденцию реагировать с высокой региоселективностью. Внутримолекулярные варианты реакции были использованы для синтеза сложных поликлических углеродных каркасов. Восстановление связи N – O приводит к 1,3-аминоспиртам.

Само по себе [3 + 2] циклоприсоединение представляет собой согласованный перициклический процесс, региохимия которого контролируется граничными молекулярными орбиталями на нитроне (диполе) и диполярофиле.[3]Когда R 'представляет собой электронодонорную группу, алкил или арил, доминирующими FMO являются ВЗМО диполярофила и НСМО нитрона. Таким образом, соединяя атомы с наибольшими коэффициентами на этих орбиталях, предполагается, что 5-замещенный изоксазолидин будет преобладать. . С другой стороны, когда диполярофил беден электронами, HOMOнитрон-ЛЮМОдиполярофилвзаимодействие является наиболее важным, и предпочтение отдается 4-замещенному продукту.

Объем и ограничения
Алкильные и арильные концевые алкены реагируют с высокой региоселективностью с образованием 5-замещенных изоксазолидинов. Этот результат согласуется с пограничным молекулярным орбитальным (кинетическим) контролем распределения изомеров: кислород нитрона, который обладает наибольшим орбитальным коэффициентом в HOMO нитрона, образует связь с внутренним углеродом алкена, который обладает наибольшим значением орбитальный коэффициент в НСМО алкена.[4]

Конфигурация 1,2-дизамещенных алкенов сохраняется в продуктах циклоприсоединения. В соответствии с FMO-контролем реакции, более электроноакцепторный заместитель на этих субстратах оказывается в 4-м положении продукта. Другими словами, углерод с наибольшим коэффициентом НСМО в диполярофиле (удаленном от электроноакцепторной группы) образует связь с нитронным кислородом, который обладает наибольшим коэффициентом ВЗМО в нитроне.[5]

Алкины также могут служить диполярофилами в этой реакции. Правила прогнозирования продуктов циклоприсоединения алкена, основанные на соответствующих FMO, также применимы к замещенным алкинам - бедные электронами алкины имеют тенденцию давать 4-замещенные продукты, в то время как богатые электронами, алкильные и арилалкины дают 5-замещенные продукты.[6]

Внутримолекулярные варианты реакции очень полезны для синтеза сложных полициклических каркасов. Эти реакции обычно протекают при гораздо более низких температурах, чем межмолекулярные циклоприсоединения. Региохимию внутримолекулярных реакций предсказать сложнее: в результате могут образоваться мостиковые или конденсированные продукты, и оба СНГ- и транс-плавленые кольца возможны.[7]

Существующий стереоцентр в связке между алкеном и нитроном часто приводит к образованию единственного диастереомера продукта. В этом примере более объемный фенильный заместитель заканчивается на экзо грань бициклической кольцевой системы.[8]

Синтетические приложения
Синтез (±) -лупинина
2,3,4,5-Тетрагидропиридин-1-оксид может быть использован для построения конденсированных гетероциклов в алкалоидах и других природных продуктах. Синтез (±) -люпинин использует расширяющееся кольцо мезилат, обеспечивая быстрый доступ к цели.[9]

Синтез гидроксикотинина
Структура гидроксикотинина, человеческого метаболита никотина, была подтверждена путем независимого синтеза с использованием циклоприсоединения нитрон-олефина.[10]

Синтез (+) - порантеридина
Перегруппировка [3 + 2] циклоаддукта дает (+) - порантеридин.[11] Циклоаддукт подвергают гидрированию, кислотному гидролизу, окислению, основному гидролизу и циклизации с получением мишени.

Кинугаса реакция с образованием β-лактамов
в Кинугаса реакция, нитрон и медь ацетилид реагировать, чтобы в конечном итоге сформировать β-лактам.[12][13] На первой стадии этой реакции ацетилид металла образуется в результате реакции концевого алкина с солью меди. 1,3-диполярное циклоприсоединение нитрона к ацетилиду металла дает 5-членное кольцо, которое перестраивается с образованием β-лактама.
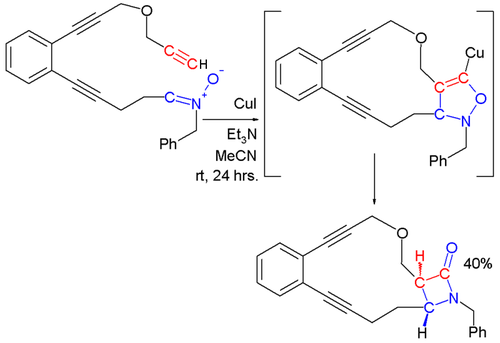
Другие реакции
Другой пример [3 + 2] циклоприсоединения - это то, в котором a Аддукт Бейлиса-Хиллмана это диполярофил. Он реагирует с C-фенил-N-метилнитроном с образованием изоксазолидин.[14]
Рекомендации
- ^ Confalone, P. N .; Хуэ, Э. М. Орг. Реагировать. 1988, 36, 1. Дои:10.1002 / 0471264180.or036.01
- ^ Туфариелло, Дж. Дж .; Али, С. А .; Клингеле. Х. О. J. Org. Chem. 1979, 44, 4213.
- ^ Хоук, К. Варенье. Chem. Soc. 1972, 94, 8953.
- ^ Huisgen, R .; Hauck, H .; Grashey, R .; Зайдль, Х. Chem. Бер. 1968, 101, 2568.
- ^ Жукла, М. Тетраэдр 1973, 29, 2315.
- ^ Winterfeldt, E .; Krohn, W .; Штракке, Х. Chem. Бер. 1969, 102, 2346.
- ^ LeBel, N.A .; Пост, M. E .; Уанг, Дж. Дж. Варенье. Chem. Soc. 1964, 86, 3759–3767. Дои:10.1021 / ja01072a031
- ^ Vinick, F.J .; Fengler, I.E .; Гшвенд, Х. В. J. Org. Chem. 1977, 42, 2936.
- ^ Туфариелло, Дж. Дж .; Тегелер, Дж. Дж. Tetrahedron Lett., 1976, 4037–4040. Дои:10.1016 / S0040-4039 (00) 92569-3
- ^ Dagne, E .; Кастаньоли-младший, Н. J. Med. Chem. 1972, 15, 356–360. Дои:10.1021 / jm00274a005
- ^ Госсингер, Э. Tetrahedron Lett. 1980, 21, 2229.
- ^ Реакции фенилацетилида меди (I) с нитронами Manabu Kinugasa и Shizunobu Hashimoto J. Chem. Soc., Chem. Commun., 1972, 466 - 467, Дои:10.1039 / C39720000466
- ^ Новый синтез конденсированных с β-лактамом циклических ендиинов с помощью внутримолекулярной реакции Кинугаса Руна Пал и Амит Башак Chem. Commun., 2006, 2992 - 2994, Дои:10.1039 / b605743h
- ^ Диастереоселективность 1,3-диполярного циклоприсоединения нитрона к аддуктам Бейлиса-Хиллмана Бранислав Дугович, Любор Фишера, Кристиан Хаметнер и Нада Пронайовац. Аркивок 2004 BS-834A Статья
