Перфторэфир - Perfluoroether
Перфторэфиры являются классом фторорганическое соединение содержащий один или несколько эфир функциональная группа. В целом эти соединения структурно аналогичны родственным углеводородным эфирам, но также обладают отличительными свойствами фторуглероды.
Введение простой эфирной функции в перфторполимерную цепь также придает полимеру термопластические свойства и делает возможным его термическое формирование. Это большое технологическое преимущество для производства большого разнообразия форм (например, стаканов, воронок, колб для лабораторного использования и т. Д.) И выдавливать шланги с высокой химической стойкостью. Это также придает полимеру полупрозрачный вид.[1]
Низкомолекулярные фторированные эфиры

Ациклический перфторэфиры известны, например O (C2F5)2, аналог диэтиловый эфир. Более интересными и полезными являются циклические эфиры, особенно эпоксиды. Таким образом, оксид тетрафторэтиена и гексафторпропиленоксид представляют собой два самых простых циклических перфторэфира. Это предшественник перфтор (метилвиниловый эфир) (CF2= CFOCF3) и перфтор (пропилвиниловый эфир) используются в качестве сомономеры с тетрафторэтиленом.
Полимерные перфторэфиры
Перфторалкоксиалканы (PFA) являются фторполимеры со свойствами, подобными политетрафторэтилен (ПТФЭ). Метилфторалкокси (MFA) представляет собой перфторметилвиниловый эфир политетрафторэтилена, полученный с другим соотношением мономеров PTFE и MVE, чем для PFA. В этих материалах эфирные группы отходят от основной цепи полимера.
Krytox Смазка, образованная в результате полимеризации оксида гексафторпропилена. Их химическая формула равно F− (CF (CF3) −CF2-O)п−CF2CF3. Эфирные группы являются неотъемлемой частью полимерной цепи.[2]
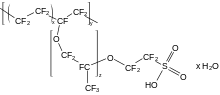
Нафион перфторированный полиэфир с подвеской сульфоновая кислота группы (RSO3ЧАС).
Меры предосторожности
При высоких температурах или в огне перфторэфиры разлагаются и могут выделяться. фтороводород. С любыми остатками необходимо обращаться с использованием защитных средств.
Рекомендации
- ^ Гюнтер Зигемунд, Вернер Швертфегер, Эндрю Фейринг, Брюс Смарт, Фред Бер, Хервард Фогель, Блейн МакКузик (2002). «Соединения фтора, органические». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a11_349. ISBN 3527306730.CS1 maint: использует параметр авторов (связь)
- ^ Майкл Г. Костелло, Ричард М. Флинн, Джон Г. Оуэнс (2001). «Фторэфиры и фторамины». Энциклопедия химической технологии Кирка-Отмера. Вайнштейн: Wiley-VCH. Дои:10.1002 / 0471238961.0612211506122514.a01.pub2. ISBN 0471238961.CS1 maint: использует параметр авторов (связь)
