СКФ комплекс - SCF complex
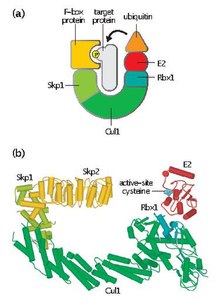
Skp, Cullin, F-бокс, содержащий комплекс (или СКФ комплекс) представляет собой мультибелковый E3 убиквитинлигаза комплекс, который катализирует убиквитинирование белков, предназначенных для 26S протеасомный деградация.[1] Вместе с комплекс, способствующий анафазе,[2] Совкомфлот играет важную роль в убиквитинирование белков, участвующих в клеточном цикле. Комплекс SCF также маркирует различные другие клеточные белки для разрушения.[3]
Основные компоненты
SCF содержит вариабельный белок F-бокса и три основные субъединицы:
- F-бокс протеин (FBP) - FBP способствует субстратной специфичности комплекса SCF, сначала агрегируя с целевыми белками независимо от комплекса. Каждый FBP (например, Skp2) может распознавать несколько разных субстратов способом, который зависит от посттрансляционных модификаций, таких как фосфорилирование или гликозилирование. Затем FBP связывается с Skp1 комплекса SCF с использованием мотива F-бокса, сближая целевой белок с функциональным ферментом, конъюгированным с убиквитином E2. FBP также важен для регуляции активности SCF в ходе клеточного цикла. Считается, что уровни SCF остаются постоянными на протяжении клеточного цикла. Вместо этого сродство FBP к белковым субстратам регулируется посредством циклин-CDK-опосредованного фосфорилирования целевых белков.[4]
- Skp1 - Skp1 - это адаптерный белок, который необходим для распознавания и связывания белков F-бокса.
- Каллин (CUL1 ) - Cullin образует основной структурный каркас комплекса SCF и связывает домен skp1 с доменом Rbx1. Различные комбинации Cullin и FBP могут генерировать порядка сотни типов E3 ubiquitin ligases, которые нацелены на разные субстраты.[5]
- RBX1 - Rbx1 содержит небольшой пальчиковый домен, связывающий цинк, действительно интересный новый ген (RING), с которым связывается фермент, конъюгированный с убиквитином E2. Это событие связывания позволяет переносить убиквитин от E2 к остатку лизина на целевом белке.
Открытие
Первый намек, который привел к открытию комплекса SCF, был получен в результате генетического скрининга Saccharomyces cerevisiae, также известный как почкующиеся дрожжи. Чувствительные к температуре мутанты цикла деления клеток (Cdc), такие как Cdc4, Cdc34 и Cdc53[6]- арестован в G1 с нереплицированной ДНК и множественными удлиненными зачатками.[7] Фенотип приписывали неспособности расщепить Sic1, ингибитор комплексов S-циклин-CDK.[6] Эти находки показали, что протеолиз важен для перехода G1 / S.
Затем биохимические исследования показали, что Cdc34 представляет собой фермент E2, который физически взаимодействует с комплексом убиквитин-лигазы E3, содержащим Skp1, Cdc4 и несколько других белков.[6] Известные партнеры связывания Skp1 - в частности, Skp2, Cyclin F и Cdc4 - имеют общий мотив из примерно 40 остатков, который был придуман как мотив F-бокса. Гипотеза F-бокса[8] которые последовали за этими открытиями, предположили, что белки F-box рекрутируют субстраты, нацеленные на деградацию, и что Skp1 связывает белок F-box с основным комплексом убиквитинирования.
Последующие генетические исследования в Caenorhabditis elegans позже способствовал выяснению других компонентов комплекса SCF.[8]
Регуляция клеточного цикла
Эукариотический клеточный цикл[9] регулируется посредством синтеза, деградации, связывающих взаимодействий, посттрансляционных модификаций регуляторных белков. Из этих регуляторных белков две убиквитинлигазы имеют решающее значение для прохождения через контрольные точки клеточного цикла. Комплекс, способствующий анафазе (APC), контролирует переход метафаза-анафаза, в то время как комплекс SCF контролирует переходы G1 / S и G2 / M. В частности, SCF, как было установлено, регулирует расщепление центриолей от поздней телофазы до перехода G1 / S.[1]
Активность SCF в значительной степени регулируется посттрансляционными модификациями. Например, опосредованная убиквитином автокаталитическая деградация FBP является механизмом снижения активности SCF.
Хорошо изученные субстраты клеточного цикла SCF-комплексов включают:
- белки семейства циклинов: Cyclin D, Cyclin E[2]
- регуляторы транскрипции: Myc, E2f1, p130[2]
- ингибиторы циклин-зависимых киназ (CKI): p27Кип1, стр21, Wee1[2]
- центриольные белки: Cep250, Ninein[1]
Существует около семидесяти человеческих FBP, некоторые из которых участвуют в контроле клеточного цикла как компонент комплексов SCF.[10]
Skp2 - это FBP, который связывает CKI, такие как p27Кип1 и стр.21.[11] Skp2 связывает p27Кип1 только при соблюдении двух условий: p27Кип1 фосфорилируется E / A / CKD2 и связывается с Cks1. Как следствие связывания Skp2, p27Кип1 убиквитинирован и нацелен на деградацию в поздних G1 и ранних S.[4] SCF-Skp2 также нацелен на p130 для деградации зависимым от фосфорилирования образом.
Белок, содержащий повторы бета-трансдуцина (βTRCP), представляет собой FBP, который нацелен на emi1 - ингибитор APC / C-Cdh1 - и wee1 для деградации во время раннего митоза.[2] βTRCP распознает эти субстраты после того, как они фосфорилируются Polo-подобной киназой 1 или циклином B-CDK1.
Fbw7, который является человеческим гомологом cdc4 в дрожжах, представляет собой FBP, который нацелен на деградацию Cyclin E, Myc, Notch и c-Jun.[4] Fbw7 стабилен на протяжении клеточного цикла[12] и локализуется в ядре из-за наличия последовательности ядерной локализации (NLS).[13] SCF-Fbw7 нацелен на Sic1 - когда по крайней мере шесть из девяти возможных сайтов фосфорилированы - и Swi5 для деградации.[14] Поскольку Sic1 обычно предотвращает преждевременный переход в S-фазу путем ингибирования Cyclin B-CDK1, нацеливание Sic1 на деградацию способствует переходу в S-фазу. Известно, что Fbw7 является гапло-недостаточным геном-супрессором опухоли, участвующим в нескольких спорадических карциномах, для которых достаточно одного мутантного аллеля, чтобы нарушить фенотип дикого типа.[15]
Fbxo4 - это еще один опухолевый супрессор FBP, который вовлечен в карциномы человека. SCF-fbxo4 играет роль в контроле клеточного цикла, направляя циклин D1 на деградацию.[4]
Циклин F представляет собой FBP, который связан с боковым амиотрофическим склерозом (БАС) и лобно-височной деменцией (ЛТД).[16][17] Мутации, предотвращающие фосфорилирование циклина F, изменяют активность SCF-циклин F, что, вероятно, влияет на последующие процессы, относящиеся к дегенерации нейронов при ALS и FTD.[17] Обычно Cyclin F нацелен на разложение E2f1.
Рак
В последнее время комплексы SCF стали привлекательной противораковой мишенью из-за их позитивной регуляции при некоторых раковых заболеваниях человека и их биохимически различных активных сайтов.[18] Хотя многие из вышеупомянутых FBP вовлечены в рак, цитотоксичность была ограничивающим фактором при разработке лекарств.[19]
Нацеленные на skp2 антисмысловые олигонуклеотиды и миРНК находятся в стадии разработки лекарств. Предварительные исследования показали, что подавление Skp2 может подавлять рост меланом, клеток рака легких, клеток рака полости рта и клеток глиобластомы.[19]
Было показано, что миРНК, нацеленные на βTRCP, повышают чувствительность клеток рака груди и клеток рака шейки матки к существующим химиотерапевтическим средствам.[19]
Сигнализация гормонов растений
Растительный гормон ауксин связывает Tir1 (Ответ ингибитора транспорта 1). Tir1 - это белок F-бокса, передающий сигнал ауксина (AFB), который действует как рецептор ауксина. Tir1, связанный с ауксином, стимулирует связывание SCF-Tir1 с репрессором AUX / IAA. Последующая деградация репрессора приводит к активации генов AUX / IAA (т.е. ауксин-чувствительных).[20]
Растительный гормон жасмонат связывает Coi1, FBP. Затем SCF-Coi1 связывает фактор транскрипции JAZ и направляет его на деградацию. Деградация фактора транскрипции JAZ позволяет транскрипцию чувствительных к жасмонату генов.[21]
использованная литература
- ^ а б c Оу, Янг; Раттнер, Дж. Б. (2004), "Центросома в высших организмах: структура, состав и дублирование", Международный обзор цитологии, Эльзевьер, 238: 119–182, Дои:10.1016 / s0074-7696 (04) 38003-4, ISBN 978-0-12-364642-2, PMID 15364198
- ^ а б c d е Фишер, Мартин; Dang, Chi V .; ДеКаприо, Джеймс А. (2018), «Контроль деления клеток», Гематология, Elsevier, стр. 176–185, Дои:10.1016 / b978-0-323-35762-3.00017-2, ISBN 978-0-323-35762-3
- ^ Морган, Дэвид "Деградация белка в контроле клеточного цикла", Клеточный цикл; Принципы управления 2007
- ^ а б c d Молекулярная основа рака. Эльзевир. 2008 г. Дои:10.1016 / b978-1-4160-3703-3.x5001-7. ISBN 978-1-4160-3703-3.
- ^ Хегде, Ашок Н. (2010), «Убиквитин-зависимая деградация белка», Комплексные натуральные продукты II, Elsevier, стр. 699–752, Дои:10.1016 / b978-008045382-8.00697-3, ISBN 978-0-08-045382-8, получено 2019-12-01
- ^ а б c Паттон, Э (1 июня 1998 г.). «Комбинаторный контроль убиквитин-зависимого протеолиза: не пренебрегайте гипотезой F-бокса». Тенденции в генетике. 14 (6): 236–243. Дои:10.1016 / s0168-9525 (98) 01473-5. ISSN 0168-9525. PMID 9635407.
- ^ Швоб, Э (1994-10-21). «Ингибитор циклинкиназы B-типа p40SIC1 контролирует переход G1 в S у S. cerevisiae». Ячейка. 79 (2): 233–244. Дои:10.1016/0092-8674(94)90193-7. ISSN 0092-8674. PMID 7954792.
- ^ а б Виллемс, Эндрю Р .; Шваб, Майкл; Тайерс, Майк (ноябрь 2004 г.). "Автостопом по лигазам убиквитина cullin: SCF и его родственники". Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1695 (1–3): 133–170. Дои:10.1016 / j.bbamcr.2004.09.027. ISSN 0167-4889. PMID 15571813.
- ^ Водермайер, Хартмут К. (сентябрь 2004 г.). «APC / C и SCF: управление друг другом и циклом ячейки». Текущая биология. 14 (18): R787 – R796. Дои:10.1016 / j.cub.2004.09.020. ISSN 0960-9822. PMID 15380093.
- ^ Lambrus, Bramwell G .; Мойер, Тайлер С .; Голландия, Эндрю Дж. (31.08.2017). «Применение системы индуцируемой ауксином деградации (AID) для быстрого истощения белка в клетках млекопитающих». Дои:10.1101/182840. Цитировать журнал требует
| журнал =(Помогите) - ^ Фрескас, Дэвид; Пагано, Микеле (июнь 2008 г.). «Дерегулированный протеолиз с помощью белков F-бокса SKP2 и β-TrCP: склонность к раку». Обзоры природы Рак. 8 (6): 438–449. Дои:10.1038 / nrc2396. ISSN 1474–175X. ЧВК 2711846. PMID 18500245.
- ^ Матиас, Нил; Стюсси, К. Ник; Гёбл, Марк Г. (13 февраля 1998 г.). «Важный домен в Cdc34p необходим для связывания с комплексом, содержащим Cdc4p и Cdc53p, в Saccharomyces cerevisiae». Журнал биологической химии. 273 (7): 4040–4045. Дои:10.1074 / jbc.273.7.4040. ISSN 0021-9258. PMID 9461595.
- ^ Блондель, М. (2000-11-15). «Ядерно-специфическая деградация Far1 контролируется локализацией белка F-бокса Cdc4». Журнал EMBO. 19 (22): 6085–6097. Дои:10.1093 / emboj / 19.22.6085. ISSN 1460-2075. ЧВК 305831. PMID 11080155.
- ^ Киши, Т .; Икеда, А .; Koyama, N .; Fukada, J .; Нагао, Р. (11 сентября 2008 г.). «Усовершенствованная двухгибридная система показывает, что SCFCdc4-зависимая деградация Swi5 способствует регулятивному механизму входа в S-фазу». Труды Национальной академии наук. 105 (38): 14497–14502. Bibcode:2008PNAS..10514497K. Дои:10.1073 / pnas.0806253105. ISSN 0027-8424. ЧВК 2567208. PMID 18787112.
- ^ Calhoun, Eric S .; Джонс, Джесса Б .; Ашфак, Рахила; Адсай, Волкан; Бейкер, Сюзанна Дж .; Валентин, Вирджиния; Hempen, Paula M .; Хильгерс, Вернер; Йео, Чарльз Дж .; Hruban, Ralph H .; Керн, Скотт Э. (октябрь 2003 г.). «Мутации BRAF и FBXW7 (CDC4, FBW7, AGO, SEL10) в различных подгруппах рака поджелудочной железы». Американский журнал патологии. 163 (4): 1255–1260. Дои:10.1016 / с0002-9440 (10) 63485-2. ISSN 0002-9440. ЧВК 1868306. PMID 14507635.
- ^ Ю, Юйцзяо; Накагава, Тадаши; Морохоши, Аканэ; Накагава, Макико; Исида, Норико; Судзуки, Наоки; Аоки, Масаси; Накаяма, Кейко (30.09.2019). «Патогенные мутации в гене БАС CCNF вызывают неправильную локализацию цитоплазмы циклина F и повышенную активность АТФазы VCP». Молекулярная генетика человека. 28 (20): 3486–3497. Дои:10.1093 / hmg / ddz119. ISSN 0964-6906. PMID 31577344.
- ^ а б Ли, Альберт; Райнер, Стефани Л .; Де Лука, Алана; Gwee, Serene S.L .; Морш, Марко; Сундарамурти, Винод; Шаххейдари, Хамида; Раганьен, Одри; Ши, Биньян; Ян, Шу; Уильямс, Келли Л. (октябрь 2017 г.). «Фосфорилирование казеинкиназой II циклина F по серину 621 регулирует активность Lys48-убиквитилирования E3-лигазы комплекса SCF (циклин F)». Открытая биология. 7 (10): 170058. Дои:10.1098 / rsob.170058. ISSN 2046-2441. ЧВК 5666078. PMID 29021214.
- ^ Скаар, Джеффри Р .; Пэган, Юлия К .; Пагано, Микеле (декабрь 2014 г.). "Терапия, направленная на убиквитинлигазу SCF". Обзоры природы Drug Discovery. 13 (12): 889–903. Дои:10.1038 / nrd4432. ISSN 1474-1776. ЧВК 4410837. PMID 25394868.
- ^ а б c Сунь, Л. Цзя и Ю. (28 февраля 2011 г.). "Убиквитинлигазы E3 SCF как противораковые мишени". Текущие мишени противораковых препаратов. 11 (3): 347–356. Дои:10.2174/156800911794519734. ЧВК 3323109. PMID 21247385.
- ^ Дхармасири, Нихал; Дхармасири, Сунетра; Эстель, Марк (май 2005 г.). «Белок F-бокса TIR1 является рецептором ауксина». Природа. 435 (7041): 441–445. Bibcode:2005Натура.435..441Д. Дои:10.1038 / природа03543. ISSN 0028-0836. PMID 15917797.
- ^ Devoto, Алессандра; Ньето-Ростро, Мануэла; Се, Даосинь; Эллис, Кристина; Хармстон, Ребекка; Патрик, Элейн; Дэвис, Джеки; Шерратт, Ли; Коулман, Марк; Тернер, Джон Г. (ноябрь 2002 г.). «COI1 связывает передачу сигналов жасмоната и фертильность с комплексом SCF убиквитин-лигаза у арабидопсиса». Журнал растений. 32 (4): 457–466. Дои:10.1046 / j.1365-313x.2002.01432.x. ISSN 0960-7412. PMID 12445118.

Морган, Дэвид «Деградация белка в контроле клеточного цикла», «Клеточный цикл»; Принципы контроля 2007

Хартмут С. Водермайер (2004). «APC / C и SCF: управление друг другом и клеточным циклом», Current Biology, 14 (787)


