Димер алкилкетена - Alkyl ketene dimer
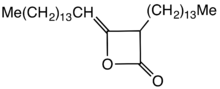
Димеры алкилкетена (AKD) - это семья органические соединения на основе 4-членной кольцевой системы оксетан-2-он, который также является центральным структурным элементом пропиолактон и дикетен. К оксетановому кольцу технически значимых димеров алкилкетена присоединен C12 - С16 алкильная группа в позиции 3 и C13 - С17 алкилиденовая группа в 4-м положении.
Основное применение димеров алкилированного кетена - калибровка из бумага и картон, а также при гидрофобизации целлюлозные волокна. Модифицированные таким образом продукты отличаются более высокой механической прочностью и меньшим проникновением воды, чернила или печатные краски.[1]
Особенность AKD гидрофобный алкильные группы, идущие от бета-пропиолактон звенеть. Конкретный пример получен из димеризации кетена стеариновая кислота. Этот кетен образуется при пиролизе стеароилхлорида.[2] AKD реагируют с гидроксильными группами целлюлозы через этерификация реакция. Этерификация конкурирует с гидролизом AKD. До разработки AKD гидрофобность придавалась путем включения канифоль в бумагу.[3]
К AKD относится ангидрид алкенилянтарной кислоты (ASA). Что касается AKD, ASA реагирует с гидроксигруппами целлюлозы с образованием сложного эфира, закрепляющего гидрофобную группу на поверхности. ASA подготовлен ее реакция непредельных углеводородов с малеиновый ангидрид.[4]
История
Еще в 1901 г. Эдгар Ведекинд опубликовали синтез димеров алкилкетена по реакции хлориды карбоновых кислот с третичные амины,[5] продукты реакции для полимеров.[6]
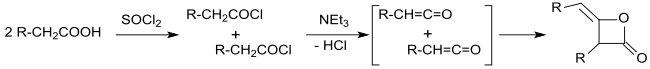
Молекулярный вес, определенный ранними исследователями, действительно указывает на кратность группы R1р2СН = С = О. Поэтому так называемый пиронон (структура дикетона с циклобутановое кольцо ) был предложен[7] в качестве продукта реакции, например. г. от реакции изобутирилхлорид и триэтиламин.[8]

Продукты первичной реакции карбоновой хлорангидриды с атомами водорода в α-положение и третичные амины были идентифицированы Герман Штаудингер[9][10] и Норман Томас Мортимер Уилсмор[11] как высоко реактивный кетены (этеноны), которые образуют 2-оксетаноны с алкилиденовой группой при димеризации в [2 + 2] фотоциклоприсоединения. Это постепенно внесло ясность в состав димеров алкилированного кетена.
Уточнение конституция осложняется различными продуктами димеризации кетенов. Например, простой кетен (H2C = C = O) димеризуется в дикетен (4-метилен-оксетан-2-он), в то время как замещенные кетены, такие как диметилкетен (Me2C = C = O, образованный из изобутирилхлорида с триэтиламином) димеризуется при добавлении «голова к хвосту» к 2,2,4,4-тетраметилциклобутандион.[7][12]
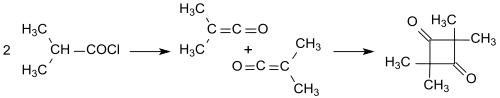
2,2,4,4,4-Тетраметилциклобутандион можно легко изомеризовать в димер диметилкетена (4-изопропилиден-3,3-диметилоксетан-2-он).[13]

Синтез и характеристика димера гексадецилкетена, ключевого вещества для алкилированных димеров кетена, используемых в бумажной промышленности, были впервые описаны в патенте.[14] в 1945 г. и в публикации[15] в 1947 г.
Квантово-химическое исследование отвергло образование циклобутандиона при димеризации п-алкилкетен R-CH = C = O в пользу образования термодинамически более стабильной структуры оксетан-2-она.[16]
Подготовка
Промышленный синтез алкилированных кетенедимеров (в то время еще называвшихся кетоэтенонами) был запатентован в 1945 году из хлоридов длинноцепочечных карбоновых кислот в инертных растворителях (таких как диэтиловый эфир или бензол ) с триэтиламином в качестве третичного амина в безводных условиях. После фильтрации нерастворимого гидрохлорида триэтиламина и выпаривания растворителя получают димеры с длинной цепью алкила с выходами более 90%.[14]
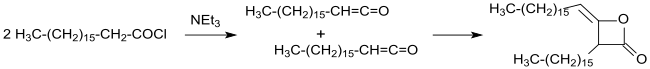
Использование других растворителей, таких как сложные эфиры карбоновых кислот или кетоны для более легкого разделения гидрохлоридов триалкиламина или других аминов, таких как N, N, N ', N'-тетраметил-гексан-1,6-диамин[17] не дает никаких существенных преимуществ.
Также описаны способы без использования растворителя, в которых образующийся гидрохлорид амина либо отфильтровывают, либо экстрагируют разбавленными водными кислотами.[18]
Непрерывный процесс, в котором хлорид длинноцепочечной карбоновой кислоты и третичный амин (например, диметилизопропиламин, диметилциклогексиламин или триэтиламин) подают отдельно без растворителей в трубчатый реактор, месильную машину или предпочтительно двухшнековый экструдер или планетарно-роликовый экструдер и реагирует при температурах от 90 до 110 ° C, обеспечивая содержание лактона более 90% за короткое время реакции. Обработка осуществляется путем фазового разделения или кислотной экстракции.[19]
Использовать
Алкилированные димеры кетена в качестве проклеивающих агентов для бумаги
Проблемы с кислотной (опосредованной сульфатом алюминия) массовой проклейкой бумаги щелочной колониевая смола введенный с начала 19 века привел к использованию щелочных флокулянтов (таких как мел или карбонат кальция в качестве резерва щелочи) к поиску альтернативных материалов для проклейки в нейтральной или щелочной среде. В дополнение к значительно более реактивным алкенилянтарные ангидриды (которые также быстро гидролизуются в присутствии воды) алкилированные димеры кетена стали более предпочтительными в бумажной промышленности с 1960-х годов и начиная с 1950-х годов.[20]

Промышленно применяемые AKD получают из жирных кислот с длиной цепи от C14 (миристиновая кислота ) до C22 (бегеновая кислота ); Предпочтительно используют пальмитил (C16) дикетен и стеарил (C18) кетен и их смеси, а также смеси жирных кислот, полученные в результате гидролиза животных и растительных жиров. Из-за длины цепи исходных жирных кислот AKD представляют собой воскообразные твердые вещества с температурой плавления от 42 до примерно 70 ° C. Смеси димеров алкилированного кетена и воды являются дисперсии при температуре ниже 40 ° C или эмульсии при температуре выше 45 ° C. Жидкие АКД широко не используются, они основаны на ненасыщенных жирных кислотах, таких как олеиновая кислота или разветвленные жирные кислоты, такие как изостеариновая кислота.
Водные дисперсии алкилдикетенов обычно содержат 10-20 мас.% АКД, а также активные защитные коллоиды (особенно поликатионы такие как катионный крахмал, сополимеры N-винилпирролидон и кватернизованный N-винилимидазол, ацилированные полиэтиленимины или катионные высокомолекулярные полиакриламиды со средней молярной массой до 7 миллионов г / моль) и другие стабилизаторы (обычно анионные поверхностно-активные вещества, например лигнинсульфонаты или продукты конденсации натриевой соли нафталинсульфоновой кислоты и формальдегид ).[21] Такие стабилизированные дисперсии AKD активны и стабильны при комнатной температуре до трех месяцев, а также допускают добавление различных наполнителей для бумаги или картона (например, каолин, мел, тальк, оксид титана, сульфат кальция, оксид алюминия и др.) от 5 до 25%. Количество димеров алкилкетена, используемых для проклейки бумаги и бумажных изделий, предпочтительно находится в диапазоне от 0,15 до 0,8 мас.%, Иногда от 0,05 до 0,2 мас.%,[19] на основе сухой бумажной массы.
Проклейка бумаги с алкилированными димерами кетена
Для определения размера бумаги с помощью AKD был предложен трехэтапный процесс, который, несмотря на противоречивые дискуссии в 1990-х годах, кажется, лучше всего описывает процессы, которые происходят, и объясняет достигнутые результаты.[22] Решающими критериями качества гидрофобности бумаги являются:
- удержание частиц AKD на влажной бумажной массе на бумажном экране
- растекание частиц АКД по поверхности и проникновение в бумажную массу
- химическая реакция гидроксильные группы целлюлозы (этерификация ) с димерами алкилированного кетена с образованием сложных эфиров бета-кетокарбоновых кислот.

Молекулярная структура (т.е. молярная масса и степень сшивки), молярная плотность заряда катионных групп, точная дозировка катионного полимера в качестве стабилизатора дисперсии и удерживающего средства, а также соблюдение других параметров процесса, таких как температура, pH и время пребывания имеет решающее значение.
После удаления избытка воды - также во избежание гидролиза AKD до бета-кетокислоты и последующего декарбоксилирование к кетону -

следует за растрескиванием стабилизированных частиц AKD на бумажной массе основы, плавлением твердого воска AKD (примерно при 90 ° C), растеканием жидкого воска AKD посредством поверхностная диффузия на волокна целлюлозы и образование замкнутых гидрофобных слоев. Толщина гидрофобных слоев зависит от концентрации АКД в дисперсии.[23]
Ad 3. Гидрофобизация целлюлозных волокон алкилированными димерами кетена наиболее эффективно протекает в нейтральной или предпочтительно слабощелочной среде (pH 7,5-9,0). Температура реакции обычно составляет 90-110 ° C, при этом примерно 40% используемого AKD реагирует с целлюлозой.[22] После реакции углы контакта > 100 °, что указывает на гидрофобный характер модельных поверхностей, модифицированных AKD. Этерификация гидроксильных групп целлюлозных волокон также была продемонстрирована путем сравнения реакций с 14С маркировкой C AKD.[22]
Проклейка с AKD подходит для постоянной гидрофобизации газет, бумаги для печати и письма и картона, используемых в качестве контейнеров для жидкостей (включая пищевые продукты, такие как молоко), а также для улучшения стабильности формы и текучести.
Литература
- Робертс, Дж. К. (1996), Дж. К. Робертс (редактор), Бумажная химия, 2-е издание, Лондон: Chapman & Hall, ISBN 978-0-7514-0236-0
- Джонсон, Д. (2009), И. Торн, C.O. Au (ред.), Приложения химии мокрой бумаги, 2-е издание, Springer, Нидерланды, стр. 73–112, ISBN 978-1-4020-6037-3
Рекомендации
- ^ «АКД, Алкилкетен Димер».
- ^ Раймунд Миллер, Клаудио Абаечерли, Адель Саид, Барри Джексон «Кетены» в Энциклопедии промышленной химии Ульманна, 2001, Wiley-VCH, Weinheim. Дои: 10.1002 / 14356007.a15_063
- ^ Вернер Дж. Аухорн «Бумага и картон, 3. Химические добавки» в Энциклопедии промышленной химии Ульманна Wiley-VCH, Weinheim. 2012 г. Дои:10.1002 / 14356007.o18_o11
- ^ Гесс, Джером; Ренд, Доминик (2005). «Алкенилянтарный ангидрид (ASA)». Журнал ТАППИ. 4: 25–30.
- ^ Ведекинд, Эдгар (май 1901 г.). "Ueber die Gewinnung von Säureanhydriden mit Hülfe von tertiären Aminen" [О подкислении ангидридов кислот с использованием третичных аминов]. Berichte der Deutschen Chemischen Gesellschaft (на немецком). 34 (2): 2070–2077. Дои:10.1002 / cber.190103402122.
- ^ Ведекинд, Эдгар (1902). "Ueber das Verhalten einiger Säurechloride bei der Chlorwasserstoffentziehung" [О поведении некоторых хлорангидридов при отщеплении хлористого водорода]. Annalen der Chemie Юстуса Либиха (на немецком). 323 (2): 246–257. Дои:10.1002 / jlac.19023230206.
- ^ а б Wedeking, E .; Weisswange, W. (март 1906 г.). "Ueber die Synthese eines Diketons der Cyclobutanreihe" [О синтезе дикетона циклобутанового ряда]. Berichte der Deutschen Chemischen Gesellschaft (на немецком). 39 (2): 1631–1646. Дои:10.1002 / cber.19060390287.
- ^ Wedekind, E .; Häussermann, J .; Weisswange, W .; Миллер, М. (1911). "Pyrononsynthesen mit Hilfe der Tertiärbasenreaktion II" [Синтезы пиронона с использованием реакции третичного красителя II]. Annalen der Chemie Юстуса Либиха (на немецком). 378 (3): 261–292. Дои:10.1002 / jlac.19113780302.
- ^ Штаудингер, Герман (март 1905 г.). "Ketene, eine neue Körperklasse" [Кетене, новый класс тела]. Berichte der Deutschen Chemischen Gesellschaft (на немецком). 38 (2): 1735–1739. Дои:10.1002 / cber.19050380283.
- ^ Staudinger, H .; Клевер, Х. У. (январь 1907 г.). "Über Ketene. 5. Mitteilung. Reaktionen des Dimethylketens" [Насчет кетенов. 5. Общение. Реакции диметилкетена. Berichte der Deutschen Chemischen Gesellschaft (на немецком). 40 (1): 1149–1153. Дои:10.1002 / cber.190704001170.
- ^ Wilsomore, N. T. M .; Стюарт, А. В. (январь 1908 г.). "Keten. Bemerkungen zu der Abhandlung der HHrn. Staudinger und Klever" [Кетене. Замечания к трактату HHrn. Штаудингер и Клевер] (PDF). Berichte der Deutschen Chemischen Gesellschaft (на немецком). 41 (1): 1025–1027. Дои:10.1002 / cber.190804101202.
- ^ Huisgen, Rolf; Отто, Питер (сентябрь 1968 г.). «Механизм димеризации диметилкетена». Журнал Американского химического общества. 90 (19): 5342–5343. Дои:10.1021 / ja01021a090.
- ^ «ДИМЕТИЛКЕТЕН-β-ЛАКТОННЫЙ ДИМЕР». Органический синтез. Дои:10.15227 / orgsyn.048.0072.
- ^ а б США 2369919, J.C. Sauer, "Кетоэтеноны и способы их получения"
- ^ Зауэр, Дж. К. (октябрь 1947 г.). «Димеры кетена из галогенидов кислот». Журнал Американского химического общества. 69 (10): 2444–2448. Дои:10.1021 / ja01202a058.
- ^ Чжан, Чжиго; Ли, Гуонэн; Ху, Гуйлинь; Сунь, Яоюй (2013). «Теоретические исследования механизма реакций димеризации алкилкетена».. Журнал химии. 2013: 1–5. Дои:10.1155/2013/481586.
- ^ США 7960497, Д.А. Герстенхабер, "Получение димеров алкилкетена"
- ^ США 5344943, Н. Бролунд, "Длинноцепочечные димеры кетена"
- ^ а б WO 03045936, Р. Эттль, М. Винтер, Т. Фройнд, Т. Кесслер, Г. Гримм, "Способ получения димеров алкилкетена"
- ^ США 2627477, W.F. Дауни, "Эмульсия димера высшего алкилкетена"
- ^ WO 2007141197, К. Хамерс, А. Брокмайер, М. Шмид, К. Лоренц, У. Рибелинг, "Водные дисперсии димеров алкилкетена"
- ^ а б c Lindström, T .; Ларссон, Т. (2005), STFI-Packfors (ред.), Заметка о калибровке AKD: исследование реальных и очевидных противоречий в литературе относительно распространения / распространения AKD на целлюлозе, Отчет № 81 год (PDF)
- ^ Lindfors, J .; Sahmi, J .; Laine, J .; Стениус, П. (2007), «Поверхности моделей AKD и ASA: подготовка и характеристика» (PDF), Биоресурсы, 2 (4), стр. 652–670.
