Диол - Diol

А диол это химическое соединение содержащий два гидроксильные группы (-ОН группы).[1] An алифатический диол также называют гликоль.[2] Это сочетание функциональных групп широко распространено, и было идентифицировано множество подкатегорий.
Наиболее распространенным промышленным диолом является этиленгликоль. Примеры диолов, в которых гидроксильные функциональные группы разделены более широко, включают 1,4-бутандиол HO- (CH2)4−OH и пропилен-1,3-диол, или бета-пропиленгликоль, HO-CH2-CH2-CH2-ОН.
Синтез классов диолов
Геминальные диолы
А геминальный диол имеет две гидроксильные группы, связанные с одним и тем же атомом. Эти виды возникают в результате гидратации карбонильных соединений. Гидратация обычно неблагоприятна, но заметным исключением является формальдегид который в воде находится в равновесии с метандиол ЧАС2С (ОН)2. Другой пример: (F3C)2С (ОН)2, гидратированная форма гексафторацетон. Многие гем-диолы подвергаются дальнейшей конденсации с образованием димерных и олигомерных производных. Эта реакция касается глиоксаля и родственных ему альдегидов.
Вицинальные диолы
В вицинальном диоле две гидроксильные группы занимают вицинальный позиции, то есть они прикреплены к соседним атомам. Эти соединения называются гликолями. Примеры включают 1,2-этандиол или этиленгликоль HO- (CH2)2-OH, общий ингредиент антифриз товары. Другой пример пропан-1,2-диол, или альфа-пропиленгликоль, HO-CH2-СН (ОН) -СН3, используемый в пищевой и медицинской промышленности, а также в качестве относительно неядовитого антифриза.
В промышленных масштабах основным путем получения вицинальных диолов является гидролиз эпоксиды. Эпоксиды получают эпоксидированием алкена. Пример синтеза трансциклогександиола[3] или по микрореактор:[4]
Для академических исследований и фармацевтики вицинальные диолы часто производятся из окисление из алкены, обычно с разбавленным кислый перманганат калия. Использование щелочного манганата калия (VII) приводит к изменению цвета от прозрачного темно-фиолетового до прозрачного зеленого; кислый манганат калия (VII) становится бесцветным. Четырехокись осмия аналогичным образом может быть использован для окисления алкенов до вицинальных диолов. Химическая реакция называется Асимметричное дигидроксилирование по Шарплесу можно использовать для производства хиральный диолы из алкенов с использованием осмата реагент и хиральный катализатор. Другой метод - это Цис-гидроксилирование по Вудворду (цис-диол) и родственные Прево реакция (антидиол), изображенный ниже, оба из которых используют йод и серебряную соль карбоновой кислоты.
Другими путями получения викдиолов являются гидрирование ацилоины[5] и пинаколь муфта реакция.
1,3-диолы
1,3-Диолы часто получают промышленным способом альдольная конденсация кетонов с формальдегид. Образовавшийся карбонил восстанавливают с помощью Канниццаро реакция или каталитическим гидрирование:
- RC (O) CH3 + CH2O → RC (O) CH2CH2ОЙ
- RC (O) CH2CH2ОН + Н2 → RCH (OH) CH2CH2ОЙ
Таким способом получают 2,2-дизамещенные пропан-1,3-диолы. Примеры включают 2-метил-2-пропил-1,3-пропандиол и неопентилгликоль.
1,3-Диолы можно получить гидратацией α, β-ненасыщенных кетонов и альдегидов. Полученный кето-спирт гидрируют. Другой путь включает гидроформилирование эпоксидов с последующим гидрированием альдегида. Этот метод был использован для 1,3-пропандиола из окись этилена.
Более специализированные пути к 1,3-диолам включают реакцию между алкен и формальдегид, то Реакция принса. 1,3-диолы могут быть получены диастереоселективно из соответствующего β-гидрокси кетоны с использованием Эванс-Саксена, Нарасака-Прасад или же Эванс – Тищенко протоколы редукции.
1,3-Диолы описаны как син или же анти в зависимости от относительной стереохимии атомов углерода, несущих гидроксильные функциональные группы. Цинкофорин это натуральный продукт который содержит оба син и анти 1,3-диолы.

1,4-, 1,5- и более длинные диолы
Диолы, в которых гидроксильные группы разделены несколькими углеродными центрами, обычно получают гидрированием диэфиров соответствующих дикарбоновые кислоты:
- (CH2)п(CO2Р)2 + 4 часа2 → (CH2)п(CH2ОЙ)2 + 2 часа2O + 2 ROH
1,4-бутандиол, 1,5-пентандиол, 1,6-гександиол, 1,10-декандиол являются важными предшественниками полиуретаны.[6]
Реакции
С промышленной точки зрения, доминирующая реакция диолов заключается в производстве полиуретаны и алкидные смолы.[6]
Общие диолы
Диолы реагируют как спирты, к этерификация и эфир формирование.
Диолы, такие как этиленгликоль используются как совместныемономеры в полимеризация формирование реакций полимеры включая некоторые полиэфиры и полиуретаны. Другой мономер с двумя идентичными функциональными группами, такой как диоил дихлорид или диовая кислота требуется для продолжения процесса полимеризации посредством повторяющихся процессов этерификации.
Диол можно превратить в циклический эфир с помощью кислотного катализатора, это циклизация диола. Во-первых, это протонирование гидроксильной группы. Затем, после внутримолекулярного нуклеофильного замещения, вторая гидроксильная группа атакует электронодефицитный углерод. При условии, что атомов углерода достаточно, чтобы угловая деформация не была слишком большой, циклический эфир может быть сформирован.

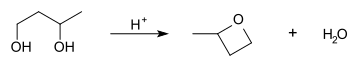
Диолы также могут быть преобразованы в лактоны используя Фетизон окисление реакция.
Вицинальные диолы
В расщепление гликоля, связь C − C в вицинальный диол расщепляется с образованием кетоновых или альдегидных функциональных групп. Видеть Окисление диола.
Геминальные диолы
В общем, органические геминальные диолы легко обезвоживать сформировать карбонильная группа. Например, угольная кислота ((HO)2C = O) нестабильно и имеет тенденцию преобразовываться в углекислый газ (CO2) и вода (H2О). Тем не менее, в редких случаях химическое равновесие в пользу геминального диола. Например, когда формальдегид (ЧАС2C = O) растворяется в воды, геминальный диол (H2С (ОН)2, метандиол ) предпочтение. Другими примерами являются циклические геминальные диолы. декагидроксициклопентан (C5(ОЙ)10) и додекагидроксициклогексан (C6(ОЙ)12), которые устойчивы, а соответствующие оксоуглероды (C5О5 и C6О6) вроде бы нет.
Смотрите также
- Спирты, химические соединения хотя бы с одним гидроксил группа
- Triols, химические соединения с тремя гидроксильными группами
- Полиолы, химические соединения с несколькими гидроксильными группами
- Этиленгликоль
- Гликолевая нуклеиновая кислота (GNA)
Рекомендации
- ^ Марш, Джерри (1985), Продвинутая органическая химия: реакции, механизмы и структура (3-е изд.), Нью-Йорк: Wiley, ISBN 0-471-85472-7.
- ^ ИЮПАК, Сборник химической терминологии, 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) "диолы ". Дои:10.1351 / goldbook.D01748.
- ^ транс-циклогександиол Органический синтез, Сб. Vol. 3, стр. 217 (1955); Vol. 28, стр.35 (1948) http://www.orgsynth.org/orgsyn/pdfs/CV3P0217.pdf.
- ^ Преимущества синтеза транс-1,2-циклогександиола в непрерывном проточном микрореакторе по сравнению со стандартным стеклянным аппаратом Андреас Хартунг, Марк А. Кин и Арно Крафт J. Org. Chem. 2007, 72, 10235–10238 Дои:10.1021 / jo701758p.
- ^ Бломквист, А. Т .; Гольдштейн, Альберт (1956). «1,2-Циклодекандиол». Органический синтез. 36: 12. Дои:10.15227 / orgsyn.036.0012.
- ^ а б Питер Верле, Маркус Моравец, Стефан Лундмарк, Кент Соренсен, Эско Карвинен и Юха Лехтонен (2008). «Спирты многоатомные». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a01_305.pub2.CS1 maint: несколько имен: список авторов (связь)


