Группа флавинов - Flavin group
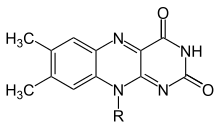

Флавин (от латинского Flavus, "желтый") - общее название группы органические соединения на основе птеридин, образованный трициклическим гетероцикл изоаллоксазин. Биохимический источник - витамин рибофлавин. Флавин часть часто прилагается аденозиндифосфат формировать флавинаденин динуклеотид (FAD), а в других случаях находится как флавинмононуклеотид (или же FMN), а фосфорилированный форма рибофлавин. Именно в той или иной из этих форм флавин присутствует в виде протезная группа в флавопротеины.
Группа флавинов способна подвергаться окислительно-восстановительные реакции, и может принять любой электрон в двухэтапном процессе или сразу два электрона. Уменьшение производится добавлением водород атомы к конкретным азот атомы на изоаллоксазиновая кольцевая система:

В водный раствор, флавины окрашиваются в желтый цвет при окислении, приобретая красный цвет в полувосстановленном анионном состоянии или синий в нейтральном (семихинон ) состояние и бесцветный при полном восстановлении.[1] Окисленная и восстановленная формы быстро равновесие с семихиноном (радикальный ) форма, сдвинутая против образования радикала:[2]
- Flбык + FlкрасныйЧАС2 ⇌ FlH•
где Flбык окисленный флавин, FlкрасныйЧАС2 восстановленный флавин (при добавлении двух атомов водорода) и FlH• семихиноновая форма (присоединение одного атома водорода).
В форме FADH2, это один из кофакторов, которые могут переносить электроны в цепь переноса электронов.
Фоторедукция
Как свободные, так и связанные с белками флавины являются фоторедуцируемый, то есть может быть уменьшена на свет, в механизме, опосредованном несколькими органическими соединениями, такими как некоторые аминокислоты, карбоновые кислоты и амины.[2] Это свойство флавинов используется различными светочувствительными белками. Например, домен LOV, обнаруженный у многих видов растений, грибов и бактерий, претерпевает обратимое, зависимое от света структурное изменение, которое включает образование связи между остатком цистеина в его пептидной последовательности и связанным FMN.[3]
FAD

Флавин аденин динуклеотид группа, связанная со многими ферментами, включая ферредоксин-НАДФ + редуктаза, моноаминоксидаза, Оксидаза D-аминокислот, глюкозооксидаза, ксантиноксидаза, и ацил-КоА-дегидрогеназа.
FADH / FADH2
FADH и FADH2 находятся уменьшенный формы ФАД. FADH2 выпускается как протезная группа в сукцинатдегидрогеназа, фермент, участвующий в цикл лимонной кислоты. В окислительного фосфорилирования, две молекулы FADH2 обычно дают 1,5 АТФ каждый, или три АТФ вместе взятых.
FMN
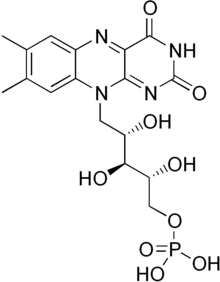
Флавин мононуклеотид это протезная группа содержится, среди других белков, НАДН-дегидрогеназа, Кишечная палочка нитроредуктаза и старый желтый фермент.
Смотрите также
- Птеридин
- Птерин
- Деазафлавин (5-деазафлавин)
Рекомендации
- ^ Михаэлис Л., Шуберт МП, Смайт CV (1936). «Потенциометрическое исследование флавинов». Журнал биологической химии. 116 (2): 587–607.
- ^ а б Мэсси В., Станкович М., Хеммерих П. (январь 1978 г.). «Опосредованное светом восстановление флавопротеинов с флавинами в качестве катализаторов». Биохимия. 17 (1): 1–8. Дои:10.1021 / bi00594a001. PMID 618535.
- ^ Александр М.Т., Домрачева Т., Бонетти С., ван Вильдерен Л.Дж., ван Гронделл Р., Грут М.Л., Хеллингверф К.Дж., Кеннис Д.Т. (июль 2009 г.). «Первичные реакции домена LOV2 фототропина изучены с помощью сверхбыстрой спектроскопии в среднем инфракрасном диапазоне и квантовой химии». Биофизический журнал. 97 (1): 227–37. Дои:10.1016 / j.bpj.2009.01.066. ЧВК 2711383. PMID 19580760.
дальнейшее чтение
- Воет Д., Воет Дж. Г. (2004). Биохимия (3-е изд.). Джон Вили и сыновья. ISBN 0-471-39223-5.
