GNMT - GNMT
Глицин N-метилтрансфераза является фермент что у людей кодируется GNMT ген.[5][6][7]
Открытие
Фермент был впервые описан Blumenstein и Williams (1960) в печени морской свинки.[8] Однако этот фермент не был очищен Керром до 1972 года в печени кролика.[9] В 1984 году Кук и Вагнер продемонстрировали, что белок, связывающий цитозольный фолат в печени, идентичен GNMT.[10] Ген GMNT человека был клонирован в 2000 году Ченом и соавторами.[6]
Распределение тканей
GNMT - это фермент, который содержится в цитозоле печени и состоит из 0,9–3% растворимого белка, присутствующего в печени.[11] Помимо печени, активность GNMT была обнаружена в ряде других тканей, включая поджелудочную железу и почки.[9] GNMT наиболее распространен в перипортальной области печени и экзокринной ткани поджелудочной железы.[11] Белки GNMT расположены в тканях, которые активно секретируются, таких как проксимальные канальцы почек, подчелюстные железы и слизистая оболочка кишечника.[11] GNMT также экспрессируется в различных нейронах, представленных в коре головного мозга, гиппокампе, черной субстанции и мозжечке.[12] Присутствие GNMT в этих клетках предполагает, что этот фермент может играть роль в секреции.
Структура
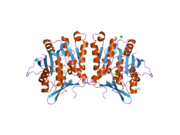
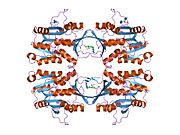
Свойства белка GNMT кроликов, крыс и людей, либо очищенного из печени / поджелудочной железы, либо экспрессированного в Escherichia coli, хорошо изучены. Все GNMT имеют очень похожие молекулярные и кинетические свойства.[11][13][14][15][16] Сравнение последовательностей кДНК и белков GNMT человека, кролика, свиньи и крысы показывает сходство более 84% на уровне нуклеотидов и около 90% на уровне аминокислот. Все GNMT представляют собой тетрамеры 130 кДа, состоящие из четырех идентичных субъединиц, каждая из которых имеет Mr 32 кДа.[15] Структура рекомбинантных GNMT крысы, мыши и человека была решена.[17][18] Четыре почти сферических субъединицы расположены так, что образуют плоский квадратный тетрамер с большим отверстием в центре. Активные сайты расположены в ближнем центре каждой субъединицы.
Функция
Глицин N-метилтрансфераза катализирует синтез N-метилглицина (саркозин ) из глицина с использованием S-аденозилметионина (SAM) (AdoMet) в качестве метил донор. GNMT действует как фермент, регулирующий соотношение S-аденозилметионина (SAM) и S-аденозилгомоцистеина (SAH) (AdoHcy)[19] и участвует в пути детоксикации в клетках печени.[7] GNMT конкурирует с тРНК-метилтрансферазами за SAM, и продукт, S-аденозилгомоцистеин (SAH), является мощным ингибитором метилтрансфераз тРНК и относительно слабым ингибитором GNMT.[9] GNMT регулирует относительные уровни SAM и SAH. Поскольку SAM является донором метила практически для всех реакций метилирования клеток.[19] Следовательно, GNMT, вероятно, регулирует способность метилирования клеток.[19][20] Эндогенный лиганд GNMT, 5-метилтетрагидроптероилпентаглутамат (5-CH3-H4PteGIu5), является мощным ингибитором этого фермента.[21] Таким образом, GNMT было предложено связать синтез метильных групп de novo с соотношением SAM и SAH, что, в свою очередь, служит мостом между метионином и одноуглеродным метаболизмом.[19][21]
Помимо активности метилтрансферазы, 4S полициклический ароматический углеводород (PAH) -связывающий белок и GNMT - это один и тот же белок.[22] Каталитический сайт напоминает молекулярную корзину, в отличие от большинства других SAM-зависимых метилтрансфераз,[17] что, следовательно, предполагает, что GNMT может улавливать неидентифицированные химические вещества в рамках процесса детоксикации. Таким образом, GNMT был предложен как белок с разнообразной функциональностью.[23]
Клиническое значение
Было показано, что GNMT выводит токсины из некоторых канцерогенов окружающей среды, таких как полиароматические углеводороды и афлатоксин.[24]
Появляется все больше доказательств, подтверждающих участие дефицита GNMT в канцерогенезе печени.[25]
Индуктор
В гликозид натуральный продукт 1,2,3,4,6-пента-O-галлоил-β-d-глюкопиранозид (PGG), выделенный из Пион молочноцветковая, азиатское цветочное растение, индуцирует GNMT мРНК и экспрессия белка в Ха7 клетки гепатомы человека.[26]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000124713 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000002769 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Чен Ю.М., Шиу Дж.Й., Ценг С.Дж., Ши Л.С., Чен Ю.Дж., Луи В.Й., Чен PH (март 1998 г.). «Характеристика экспрессии гена глицин-N-метилтрансферазы в гепатоцеллюлярной карциноме человека». Международный журнал рака. 75 (5): 787–93. Дои:10.1002 / (SICI) 1097-0215 (19980302) 75: 5 <787 :: AID-IJC20> 3.0.CO; 2-2. PMID 9495250.
- ^ а б Чен Ю.М., Чен Л.Й., Вонг Ф.Х., Ли СМ, Чанг Т.Дж., Ян-Фэн Т.Л. (май 2000 г.). «Геномная структура, экспрессия и хромосомная локализация гена глицин N-метилтрансферазы человека». Геномика. 66 (1): 43–7. Дои:10.1006 / geno.2000.6188. PMID 10843803.
- ^ а б «Энтрез Ген: GNMT глицин N-метилтрансфераза».
- ^ Блюменштейн Дж, Уильямс Г.Р. (сентябрь 1960). «Ферментативное N-метилирование глицина». Сообщения о биохимических и биофизических исследованиях. 3 (3): 259–263. Дои:10.1016 / 0006-291X (60) 90235-7.
- ^ а б c Керр SJ, Борек Э. (1972). «Метилтрансферазы тРНК». Достижения в энзимологии и смежных областях молекулярной биологии. Достижения в энзимологии и смежных областях молекулярной биологии. 36. С. 1–27. Дои:10.1002 / 9780470122815.ch1. ISBN 9780470122815. PMID 4563428.
- ^ Кук Р.Дж., Вагнер С. (1984). «Глицин N-метилтрансфераза представляет собой фолат-связывающий белок цитозоля печени крысы». Труды Национальной академии наук Соединенных Штатов Америки. 81 (12): 3631–4. Bibcode:1984PNAS ... 81.3631C. Дои:10.1073 / pnas.81.12.3631. ЧВК 345272. PMID 6587377.
- ^ а б c d Йео Э.Дж., Вагнер С. (1994). «Тканевое распределение глицин N-метилтрансферазы, основного фолат-связывающего белка печени». Труды Национальной академии наук Соединенных Штатов Америки. 91 (1): 210–4. Bibcode:1994PNAS ... 91..210Y. Дои:10.1073 / пнас.91.1.210. ЧВК 42916. PMID 8278367.
- ^ Ян CP, Ван Ха, Цай TH, Фан А, Сюй CL, Чен СиДжей, Хун СиДжей, Чен ЮМ (август 2012). «Характеристика нейропсихологического фенотипа глицин N-метилтрансферазы - / - мышей и оценка его ответов на лечение клозапином и саркозином». Европейская нейропсихофармакология. 22 (8): 596–606. Дои:10.1016 / j.euroneuro.2011.12.007. PMID 22264868. S2CID 11604802.
- ^ Heady JE, Керр SJ (1973). «Очистка и характеристика глицин N-метилтрансферазы». Журнал биологической химии. 248 (1): 69–72. PMID 4692843.
- ^ Огава Х., Фудзиока М (1982). «Очистка и свойства глицин N-метилтрансферазы из печени крысы». Журнал биологической химии. 257 (7): 3447–52. PMID 6801046.
- ^ а б Огава Х., Гоми Т, Фудзиока М (1993). «Глицин N-метилтрансферазы млекопитающих. Сравнительные кинетические и структурные свойства ферментов из печени человека, крысы, кролика и свиньи». Сравнительная биохимия и физиология. B, Сравнительная биохимия. 106 (3): 601–11. Дои:10.1016 / 0305-0491 (93) 90137-т. PMID 8281755.
- ^ Йео Э.Дж., Вагнер С. (1992). «Очистка и свойства панкреатической глицин N-метилтрансферазы». Журнал биологической химии. 267 (34): 24669–74. PMID 1332963.
- ^ а б Фу З, Ху Й, Кониси К., Таката И, Огава Х, Гоми Т., Фудзиока М., Такусагава Ф. (1996). «Кристаллическая структура глицин N-метилтрансферазы из печени крысы». Биохимия. 35 (37): 11985–93. Дои:10.1021 / bi961068n. PMID 8810903.
- ^ Пахомова С., Лука З., Громанн С., Вагнер С., Новичок М. Е. (2004). «Глицин N-метилтрансферазы: сравнение кристаллических структур и кинетических свойств рекомбинантных ферментов человека, мыши и крысы». Белки. 57 (2): 331–7. Дои:10.1002 / prot.20209. PMID 15340920. S2CID 26065465.
- ^ а б c d Лука З., Мадд Ш., Вагнер С. (2009). «Глицин N-метилтрансфераза и регуляция уровня S-аденозилметионина». Журнал биологической химии. 284 (34): 22507–11. Дои:10.1074 / jbc.R109.019273. ЧВК 2755656. PMID 19483083.
- ^ МакКейб, округ Колумбия, Кодилл Массачусетс (2005). «Метилирование ДНК, геномное молчание и связь с питанием и раком». Отзывы о питании. 63 (6, п. 1): 183–95. Дои:10.1111 / j.1753-4887.2005.tb00136.x. PMID 16028562.
- ^ а б Вагнер С., Бриггс В. Т., Кук Р. Дж. (1985). «Ингибирование активности глицин N-метилтрансферазы производными фолиевой кислоты: последствия для регуляции метаболизма метильных групп». Сообщения о биохимических и биофизических исследованиях. 127 (3): 746–52. Дои:10.1016 / с0006-291х (85) 80006-1. PMID 3838667.
- ^ Раха А., Вагнер С., Макдональд Р.Г., Бресник Е. (1994). «Цитозольный 4S полициклический ароматический углеводород-связывающий белок печени крысы представляет собой глицин-N-метилтрансферазу». Журнал биологической химии. 269 (8): 5750–6. PMID 8119914.
- ^ Бхат Р., Бресник Э. (август 1997 г.). «Глицин N-метилтрансфераза представляет собой пример функционального разнообразия. Роль полициклического рецептора, связывающего ароматические углеводороды». Журнал биологической химии. 272 (34): 21221–6. Дои:10.1074 / jbc.272.34.21221. PMID 9261130.
- ^ Йен Ч., Лин Ю. Т., Чен Х. Л., Чен С. Ю., Чен Ю. М. (январь 2013 г.). «Многофункциональные роли GNMT в токсикологии и раке». Токсикология и прикладная фармакология. 266 (1): 67–75. Дои:10.1016 / j.taap.2012.11.003. PMID 23147572.
- ^ Барич I (2009). «Унаследованные нарушения превращения метионина в гомоцистеин». Журнал наследственных метаболических заболеваний. 32 (4): 459–71. Дои:10.1007 / s10545-009-1146-4. PMID 19585268. S2CID 8659319.
- ^ Kant R, Yen CH, Lu CK, Lin YC, Li JH, Chen YM (май 2016 г.). «Идентификация 1,2,3,4,6-пента-O-галлоил-β-d-глюкопиранозида в качестве усилителя глицин-N-метилтрансферазы путем высокопроизводительного скрининга натуральных продуктов, подавляющего гепатоцеллюлярную карциному». Международный журнал молекулярных наук. 17 (5): 669. Дои:10.3390 / ijms17050669. ЧВК 4881495. PMID 27153064.
дальнейшее чтение
- Чен М., Хуан Ю.Л., Хуанг Ю.К., Шуй И.М., Джованнуччи Э., Чен Ю.С., Чен Ю.М. (май 2014 г.). «Генетический полиморфизм глицин-N-метилтрансферазы и риск рака простаты в последующем исследовании, проведенном специалистами в области здравоохранения». PLOS ONE. 9 (5): e94683. Bibcode:2014PLoSO ... 994683C. Дои:10.1371 / journal.pone.0094683. ЧВК 4011739. PMID 24800880.
- Чжоу В.Й., Чжао Дж.Ф., Чен Ю.М., Ли К.И., Су К.Х., Шюе С.К., Ли Т.С. (март 2014 г.). «Роль глицин N-метилтрансферазы в экспериментальном язвенном колите». Журнал гастроэнтерологии и гепатологии. 29 (3): 494–501. Дои:10.1111 / jgh.12434. PMID 24219143. S2CID 22074228.
- Ван Ю.С., Линь В.Л., Линь Ю.Дж., Тан Ф.Й., Чен Ю.М., Чианг Е.П. (февраль 2014 г.). «Новая роль супрессора опухолей GNMT в клеточной защите от повреждений ДНК». Международный журнал рака. 134 (4): 799–810. Дои:10.1002 / ijc.28420. PMID 23922098. S2CID 24507645.
- Чен Ю.М., Ляо Ю.Дж. (июль 2013 г.). «Фосфорилированные формы GNMT в печени мышей». Журнал протеомики. 87: 132–3. Дои:10.1016 / j.jprot.2013.01.007. PMID 23340451.
- Chen CY, Ching LC, Liao YJ, Yu YB, Tsou CY, Shyue SK, Chen YM, Lee TS (июль 2012 г.). «Дефицит глицин N-метилтрансферазы усугубляет атеросклероз у мышей с нулевым уровнем аполипопротеина E». Молекулярная медицина. 18 (5): 744–52. Дои:10.2119 / молмед.2011.00396. ЧВК 3409278. PMID 22415010.
- Ляо Ю.Дж., Чен Т.Л., Ли Т.С., Ван Ха, Ван СК, Ляо Л.Й., Лю Р.С., Хуан С.Ф., Чен Ю.М. (май 2012 г.). «Дефицит глицин-N-метилтрансферазы влияет на стабильность белка С2 типа Ниманна-Пика и регулирует гомеостаз холестерина в печени». Молекулярная медицина. 18 (3): 412–22. Дои:10.2119 / молмед.2011.00258. ЧВК 3356423. PMID 22183894.
- Chen M, Ho CW, Huang YC, Wu KY, Wu MT, Jeng HA, Chen CJ, Shih TS, Lai CH, Pan CH, Chen YM (июль 2011 г.). «Глицин N-метилтрансфераза влияет на уровни 1-гидроксипирена и 8-гидрокси-2'-дезоксигуанозина в моче после воздействия ПАУ». Журнал профессиональной и экологической медицины. 53 (7): 812–9. Дои:10.1097 / JOM.0b013e318222b79a. PMID 21691217. S2CID 205722774.
- Ван Ю.К., Тан Ф.Й., Чен С.Ю., Чен Ю.М., Чианг Е.П. (май 2011 г.). «Экспрессия глицин-N-метилтрансферазы в клетках HepG2 участвует в гомеостазе метильных групп, регулируя кинетику трансметилирования и метилирование ДНК». Журнал питания. 141 (5): 777–82. Дои:10.3945 / jn.110.135954. PMID 21411609.
- Ван Ю.К., Чен Ю.М., Лин Ю.Дж., Лю С.П., Чианг Е.П. (май – июнь 2011 г.). «Экспрессия GNMT увеличивает содержание фолиевой кислоты в печени и опосредованное фолат-синтазой гомоцистеин реметилирование». Молекулярная медицина. 17 (5–6): 486–94. Дои:10.2119 / молмед.2010.00243. ЧВК 3105148. PMID 21210071.
- Ляо Ю.Дж., Чен К.Х., Хуанг С.Ф., Чен Т.Л., Ван С.К., Цзянь С.Х., Цай Т.Ф., Лю С.П., Чен Ю.М. (апрель 2010 г.). «Дефицит глицин N-метилтрансферазы приводит к ухудшению клеточной защиты печени мышей от стресса». Протеомика: клиническое применение. 4 (4): 394–406. Дои:10.1002 / prca.200900074. PMID 21137059. S2CID 8638838.
- Tsai MJ, Chen YM, Weng CF, Liou DY, Yang HC, Chen CH, Liao RI, Kuo FS, Chiu CW, Kuo HS, Huang MC, Lin YL, Lee MJ, Kuo WC, Huang WC, Cheng H (июнь 2010 г. ). «Повышенная экспрессия глицин-N-метилтрансферазы посредством аденовирусного переноса гена в культуре ЦНС является нейрозащитным». Летопись Нью-Йоркской академии наук. 1199 (1): 194–203. Bibcode:2010НЯСА1199..194Т. Дои:10.1111 / j.1749-6632.2009.05169.x. PMID 20633125. S2CID 20120622.
- Чен Ю.М., Ляо Ю.Дж., Лю С.П., Цай Т.Ф. (июнь 2009 г.). «Фенотипические различия между двумя моделями Gnmt - / - мышей для гепатоцеллюлярной карциномы». Гепатология. 49 (6): 2130–1, ответ автора 2131. Дои:10.1002 / hep.22984. PMID 19475685. S2CID 205869970.
- Ли СМ, Ши Ю.П., Ву СН, Чен Ю.М. (август 2009 г.). «Характеристика 5'-регуляторной области гена глицин-N-метилтрансферазы человека». Ген. 443 (1–2): 151–7. Дои:10.1016 / j.gene.2009.05.001. PMID 19439180.
- Хуанг Ю.К., Чен М., Шир Ю.М., Су СН, Чен С.К., Ли А.Ф., Хо Д.М., Чен Ю.М. (сентябрь 2008 г.). «Глицин-N-метилтрансфераза является благоприятным прогностическим маркером холангиокарциномы человека». Журнал гастроэнтерологии и гепатологии. 23 (9): 1384–9. Дои:10.1111 / j.1440-1746.2008.05488.x. PMID 18624901. S2CID 24227544.
- Хуанг Ю.К., Ли СМ, Чен М., Чанг М.И., Чан Ю.Х., Хуанг В.Дж., Хо Д.М., Пан С.С., Ву Т.Т., Ян С., Линь М.В., Се Дж.Т., Чен Ю.М. (март 2007 г.). «Гаплотипы, потеря гетерозиготности и уровни экспрессии глицин-N-метилтрансферазы при раке простаты». Клинические исследования рака. 13 (5): 1412–20. Дои:10.1158 / 1078-0432.CCR-06-1551. PMID 17332283.
- Ли СМ, Чен С.И., Ли Ю.К., Хуанг С.Й., Чен Ю.М. (июль 2006 г.). «Взаимодействия бензо [a] пирена и N-метилтрансферзы глицина: профили экспрессии генов пути детоксикации печени». Токсикология и прикладная фармакология. 214 (2): 126–35. Дои:10.1016 / j.taap.2005.12.020. PMID 16545412.
- Chen SY, Lin JR, Darbha R, Lin P, Liu TY, Chen YM (май 2004 г.). «Ген восприимчивости опухоли к глицин-N-метилтрансферазе в пути детоксикации бензо (а) пирена». Исследования рака. 64 (10): 3617–23. Дои:10.1158 / 0008-5472.CAN-03-3726. PMID 15150120.
- Лю Х. Х., Чен К. Х., Ши Ю. П., Луи В. Ю., Вонг Ф. Х., Чен Ю. М. (январь – февраль 2003 г.). «Характеристика сниженной экспрессии глицин N-метилтрансферазы в раковых тканях печени с использованием двух недавно разработанных моноклональных антител». Журнал биомедицинских наук. 10 (1): 87–97. Дои:10.1007 / BF02256001. PMID 12566990.
- Ценг Т.Л., Ши Ю.П., Хуанг Ю.К., Ван С.К., Чен PH, Чанг Дж.Г., Йе К.Т., Чен Ю.М., Буетоу К.Х. (февраль 2003 г.). «Генотипическая и фенотипическая характеристика гена предполагаемой предрасположенности к опухоли, GNMT, при раке печени». Исследования рака. 63 (3): 647–54. PMID 12566309.
- Ли CM, Yen CH, Tzeng TY, Huang YZ, Chou KH, Chang TJ, Arthur Chen YM (сентябрь 2013 г.). «Андрогенный ответный элемент гена глицин-N-метилтрансферазы расположен в кодирующей области его первого экзона». Отчеты по бионауке. 33 (5): 761–769. Дои:10.1042 / BSR20130030. ЧВК 3775523. PMID 23883094.
- Ли Ч., Линь М. Х., Чу Ш., Ту ПХ, Фанг CC, Йен Ч., Лян Пи, Хуан Дж. К., Су Ю. К., Сытву Х. К., Чен Ю. М. (март 2015 г.). «Роль глицин N-метилтрансферазы в регуляции Т-клеточных ответов при экспериментальном аутоиммунном энцефаломиелите». Молекулярная медицина. 20: 684–96. Дои:10.2119 / молмед.2014.00133. ЧВК 4398670. PMID 25535034.
- Йен Ч., Хунг Дж. Х., Уэн Ю. Ф., Лю С. П., Чен С. Ю., Лю Х. Х., Чжоу Т. Ю., Цай Т. Ф., Дарбха Р., Се Л. Л., Чен Ю. М. (март 2009 г.). «Глицин N-метилтрансфераза влияет на метаболизм афлатоксина B1 и блокирует его канцерогенное действие». Токсикология и прикладная фармакология. 235 (3): 296–304. Дои:10.1016 / j.taap.2008.12.013. PMID 19146867.
- Чен Ю.М., Шиу Дж.Й., Ценг С.Дж., Ши Л.С., Чен Ю.Дж., Луи В.Й., Чен PH (март 1998 г.). «Характеристика экспрессии гена глицин-N-метилтрансферазы в гепатоцеллюлярной карциноме человека». Международный журнал рака. 75 (5): 787–93. Дои:10.1002 / (sici) 1097-0215 (19980302) 75: 5 <787 :: aid-ijc20> 3.0.co; 2-2. PMID 9495250.
- Вагнер С., Деча-Умфай В., Корбин Дж. (Июнь 1989 г.). «Фосфорилирование модулирует активность глицин-N-метилтрансферазы, белка, связывающего фолат. Фосфорилирование in vitro ингибируется естественным фолатным лигандом». Журнал биологической химии. 264 (16): 9638–42. PMID 2722853.
- Вагнер С., Деча-Умфай В., Корбин Дж. (Июнь 1989 г.). «Фосфорилирование модулирует активность глицин-N-метилтрансферазы, белка, связывающего фолат. Фосфорилирование in vitro ингибируется естественным фолатным лигандом». Журнал биологической химии. 264 (16): 9638–42. PMID 2722853.
- Мадд Ш., Эберт М. Х., Скрайвер Ч. Р. (август 1980 г.). «Лабильные балансы метильных групп в человеке: роль саркозина». Метаболизм. 29 (8): 707–20. Дои:10.1016/0026-0495(80)90192-4. PMID 6157075.
- Mudd SH, Cerone R, Schiaffino MC, Fantasia AR, Minniti G, Caruso U, Lorini R, Watkins D, Matiaszuk N, Rosenblatt DS, Schwahn B, Rozen R, LeGros L, Kotb M, Capdevila A, Luka Z, Finkelstein JD , Tangerman A, Stabler SP, Allen RH, Wagner C (август 2001 г.). «Дефицит глицин-N-метилтрансферазы: новая врожденная ошибка, вызывающая стойкую изолированную гиперметионинемию». Журнал наследственных метаболических заболеваний. 24 (4): 448–64. Дои:10.1023 / А: 1010577512912. PMID 11596649. S2CID 28155061.
- Лука З., Сероне Р., Филлипс Дж. А., Мадд Х. С., Вагнер С. (январь 2002 г.). «Мутации в глицин-N-метилтрансферазе человека дают представление о ее роли в метаболизме метионина». Генетика человека. 110 (1): 68–74. Дои:10.1007 / s00439-001-0648-4. PMID 11810299. S2CID 9819456.
- Ценг Т.Л., Ши Ю.П., Хуанг Ю.К., Ван С.К., Чен PH, Чанг Дж.Г., Йе К.Т., Чен Ю.М., Буетоу К.Х. (февраль 2003 г.). «Генотипическая и фенотипическая характеристика гена предполагаемой предрасположенности к опухоли, GNMT, при раке печени». Исследования рака. 63 (3): 647–54. PMID 12566309.
- Møller MT, Samari HR, Fengsrud M, Strømhaug PE, øStvold AC, Seglen PO (июль 2003 г.). «Индуцированное окадаовой кислотой, чувствительное к нарингину фосфорилирование глицин-N-метилтрансферазы в изолированных гепатоцитах крысы». Биохимический журнал. 373 (Pt 2): 505–13. Дои:10.1042 / BJ20030502. ЧВК 1223502. PMID 12697024.
- Лука З., Вагнер С. (декабрь 2003 г.). «Влияние встречающихся в природе мутаций в человеческой глицин N-метилтрансферазе на активность и конформацию». Сообщения о биохимических и биофизических исследованиях. 312 (4): 1067–72. Дои:10.1016 / j.bbrc.2003.11.037. PMID 14651980.
- Augoustides-Savvopoulou P, Luka Z, Karyda S, Stabler SP, Allen RH, Patsiaoura K, Wagner C, Mudd SH (2004). «Дефицит глицин N -метилтрансферазы: новый пациент с новой мутацией». Журнал наследственных метаболических заболеваний. 26 (8): 745–59. Дои:10.1023 / B: BOLI.0000009978.17777.33. PMID 14739680. S2CID 9179123.
- Бигль Б., Ян Т.Л., Хунг Дж., Коггер Е.А., Мориарти Д.Д., Кодилл Массачусетс (декабрь 2005 г.). «Вариант C-> T глицин-N-метилтрансферазы (GNMT) 1289 влияет на концентрацию общего гомоцистеина в плазме у молодых женщин после ограничения потребления фолиевой кислоты». Журнал питания. 135 (12): 2780–5. Дои:10.1093 / jn / 135.12.2780. PMID 16317120.
- Лука З., Пахомова С., Лука Ю., Новичок М. Е., Вагнер С. (сентябрь 2007 г.). «Дестабилизация глицин N-метилтрансферазы человека мутацией H176N». Белковая наука. 16 (9): 1957–64. Дои:10.1110 / пс. 072921507. ЧВК 2206963. PMID 17660255.