Перегруппировка Габриэля-Колмана - Gabriel–Colman rearrangement
В Перегруппировка Габриэля-Колмана[1] это химическая реакция из сахарин или сложный эфир фталимидо с сильным база, например алкоксид, чтобы сформировать замещенный изохинолины.[2] Эта перестановка, а расширение кольца, считается общим, если существует энолизируемый водород в группе, прикрепленной к азот,[3] так как азоту необходимо отводить водород для образования карбанион что закроет кольцо.[4] Как показано в случае общего примера ниже, X либо CO или ТАК2.

Механизм

В механизм реакции[5][6] начинается с нападения на карбонил группа сильным основанием, например метоксид ион. Затем кольцо открывается, образуя имид анион. Затем следует быстрое изомеризация имидного аниона к карбаниону. Этому способствует электроноакцепторный эффект заместитель, что позволяет в большей степени стабилизировать соседний карбанион по отношению к имидному аниону. Затем реакция завершается, когда метоксид вытесняется замкнутым кольцом, что приводит к расширению кольца. В этап определения ставки этой реакции является атака карбаниона на карбометоксигруппу.
Смещение метоксида аналогично смещению, наблюдаемому в Конденсация Дикмана, поскольку это также результат замыкания кольца.
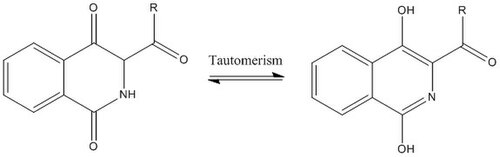
Более того, таутомеризация может встречаться в обеих карбонильных группах кольца с взаимным превращением кето форма для энол форма и амид форма для имидовая кислота форма.
Приложения
Основное применение перегруппировки Габриэля-Колмана заключается в образовании изохинолинов из-за относительно высокого выхода желаемых продуктов. Следовательно, исследования, в которых либо продукт, либо средний представляет собой изохинолин, может быть использована перегруппировка Габриэля-Колмана. Эта реакция была использована в производстве промежуточных продуктов для синтеза потенциальных противовоспалительное средство агенты.[7] Он также использовался при изучении производных фталимида и сахарина в качестве ингибиторов на основе механизма действия трех ферментов; человек лейкоцитарная эластаза, катепсин G и протеиназа 3.[8] Производные фталимида оказались неактивными, а производные сахарина - хорошими ингибиторами этих ферментов.

В исследовании[9] производных 1,1-диоксида 3-оксо-1,2-бензоизотиазолин-2-уксусной кислоты перегруппировка Габриэля-Колмана была использована для превращения Изопропил (1,1-диоксидо-3-оксо-1,2-бензотиазол-2 (3H) -ил) ацетат в 1,1-диоксид изопропил-4-гидрокси-2H-1,2-бензотиазин-3-карбоксилата, как показано над. Эта реакция показала процентный выход 85%.

В другом исследовании[10] Этиловый эфир N-фталимидоглицина использовали для синтеза 4-гидроксиизохинолина с использованием перегруппировки Габриэля-Колмана, как показано выше. Эта реакция показала процентный выход 91%. Формирование этого продукта было важным шагом в изучении синтез 4,4'-функционализированных 1,1'-биизохинолинов.
Смотрите также
использованная литература
- ^ Габриэль, S .; Колман, Дж. (1900). "Ueber eine Umlagerung der Phtalimidoketone". Berichte der Deutschen Chemischen Gesellschaft. 33 (2): 2630–2634. Дои:10.1002 / cber.190003302209.
- ^ Koelsch, C.F .; Линдквист, Р. М. (1956). «Некоторые попытки получить производные от Benz [ж] изохинолин и синтез бенз [час] изохинолин ". Журнал органической химии. 21 (6): 657–659. Дои:10.1021 / jo01112a018.
- ^ Аллен, К. Ф. Х. (1950). «Нафтиридины». Химические обзоры. 47 (2): 275–305. Дои:10.1021 / cr60147a004. PMID 24538878.
- ^ Хаузер, Чарльз Р .; Кантор, Саймон В. (1951). «Перегруппировка бензиловых эфиров в карбинолы амидом калия. Механизм изомеризации карбанионов с участием 1,2-сдвигов». Журнал Американского химического общества. 73 (4): 1437–1441. Дои:10.1021 / ja01148a011.
- ^ Хилл, Джон Х. М. (1965). «Механизм перестановки Габриэля - Колмана». Журнал органической химии. 30 (2): 620–622. Дои:10.1021 / jo01013a078.
- ^ Ли, Джи Джек (2009). «Перестановка Габриэля – Колмана». Название Реакции. п. 250. Дои:10.1007/978-3-642-01053-8_107. ISBN 978-3-642-01052-1.
- ^ Ломбардино, Джозеф Дж .; Уайзман, Эдвард Х .; МакЛамор, В. М. (1971). «Синтез и противовоспалительная активность некоторых 3-карбоксамидов 2-алкил-4-гидрокси-2H-1,2-бензотиазин 1,1-диоксида». Журнал медицинской химии. 14 (12): 1171–1175. Дои:10.1021 / jm00294a008. PMID 5116229.
- ^ Groutas, William C .; Чонг, Ли S .; Венкатараман, Радхика; Эпп, Джеффри Б.; Куанг, Ронгзе; Хаузер-Арчилд, Наден; Хойдаль, Джон Р. (1995). "Перегруппировка Габриэля-Колмана в биологических системах: Дизайн, синтез и биологическая оценка производных фталимида и сахарина как потенциальных механизированных ингибиторов эластазы лейкоцитов человека, катепсина G и протеиназы 3". Биоорганическая и медицинская химия. 3 (2): 187–193. Дои:10.1016/0968-0896(95)00013-7. PMID 7796053.
- ^ Schapira, Celia B .; Perillo, Isabel A .; Ламдан, Самуэль (1980). «1,1-диоксидные производные 3-оксо-1,2-бензоизотиазолин-2-уксусной кислоты. I. Взаимодействие сложных эфиров с алкоксидами». Журнал гетероциклической химии. 17 (6): 1281–1288. Дои:10.1002 / jhet.5570170627.
- ^ Лащат, Сабина; Капацина, Элизабет; Лордон, Мари; Баро, Анжелика (2008). «Конвергентный синтез 1,1'-биизохинолинов, связанных с каламитическими субъединицами». Синтез. 2008 (16): 2551–2560. Дои:10.1055 / с-2008-1067184.
