Гейтинг (электрофизиология) - Gating (electrophysiology)
В электрофизиология, период, термин ворота относится к открытию (активация ) или закрытие (путем деактивации или деактивации) ионные каналы.[1] Это изменение конформации является ответом на изменения трансмембранного напряжения.[2]
Когда ионные каналы находятся в «закрытом» (непроводящем) состоянии, они непроницаемый к ионам и не проводят электрический ток. Когда ионные каналы находятся в открытом состоянии, они проводят электрический ток, позволяя ионам определенного типа проходить через них и, таким образом, через плазматическая мембрана из клетка. Стробирование - это процесс перехода ионного канала между открытым и закрытым состояниями.[3]
В зависимости от ионного канала могут запускаться различные клеточные изменения, в том числе изменения напряжения на клеточной мембране (потенциалзависимые ионные каналы ), химические вещества, взаимодействующие с ионным каналом (ионные каналы, управляемые лигандами ), изменения температуры,[4] растяжение или деформация клеточной мембраны, добавление фосфат группу к ионному каналу (фосфорилирование ) и взаимодействие с другими молекулами в клетке (например, G белки ).[5] Скорость, с которой происходит любой из этих процессов стробирования в ответ на эти триггеры, известна как кинетика стробирования. Некоторые лекарства и многие токсины ионных каналов действуют как «модификаторы стробирования» потенциал-управляемых ионных каналов, изменяя кинетику стробирования.[6]
Потенциал-зависимые ионные каналы потенциал действия часто описываются как имеющие четыре процесса стробирования: активация, деактивация, инактивация и реактивация (также называемые «восстановлением после инактивации»). Активация - это процесс открытия ворот активации, который происходит в ответ на напряжение внутри клеточной мембраны ( мембранный потенциал ) становится более положительным по отношению к внешней части ячейки (деполяризация ), а «дезактивация» - это процесс, противоположный закрытию ворот активации в ответ на то, что внутренняя часть мембраны становится более негативной (реполяризация). «Инактивация» - это закрытие ворот инактивации, которое происходит в ответ на то, что напряжение внутри мембраны становится более положительным, но медленнее, чем активация. «Реактивация» противоположна инактивации и представляет собой процесс повторного открытия ворот инактивации.[7]
Эти изменения функции, зависящие от напряжения, критичны для большого количества процессов в возбудимых и невозбудимых клетках.[2]
Активация
Управляемые по напряжению ионные каналы
Управляемые по напряжению ионные каналы открываются и закрываются в ответ на электрический потенциал через клеточную мембрану. Части области канала действуют как датчики напряжения. По мере изменения мембранного потенциала это приводит к изменению электростатические силы, перемещая эти области измерения напряжения. Это изменяет конфигурацию других элементов канала в открытое или закрытое положение.[8] Когда они переходят из закрытого положения в открытое, это называется «активацией». Управляемые напряжением ионные каналы лежат в основе многих электрических характеристик клетки, включая потенциалы действия, мембранные потенциалы покоя и синаптическую передачу.[9]
Управляемые по напряжению ионные каналы часто специфичны для ионов, включая Na+, К+, Ca2+, а Cl−. Каждый из этих ионов играет важную роль в электрическом поведении клетки.[9] Ворота также обладают уникальными свойствами, имеющими важное физиологическое значение. Например, Na+ каналы открываются и закрываются быстро, а K+ ворота открываются и закрываются намного медленнее. Разница в скорости между этими каналами лежит в основе фаз деполяризации и реполяризации потенциала действия.[10]
Na+ каналы
Натрий, управляемый напряжением (Na+) каналы важны, когда дело доходит до распространения потенциалов действия в нейронах и других возбудимых клетках, в основном они используются для распространения потенциала действия в аксонах, мышечных волокнах и нервном соматодендритном компартменте.[11] Натрий (Na+) каналы являются одними из основных ионных каналов, ответственных за потенциалы действия.[9] Будучи сложными, они состоят из больших α-субъединиц, которые затем соединяются с двумя меньшими β-субъединицами.[11] Они содержат трансмембранные сегменты, известные как S1-6. Заряженные сегменты S4 являются датчиками напряжения каналов. При воздействии определенной минимальной разности потенциалов сегменты S4 перемещаются по мембране.[12] Это вызывает движение линкера S4-S5, которое заставляет линкер S5-S6 скручиваться и открывает канал.[13]
K+ каналы
Калий (K+) каналы играют большую роль в настройке мембранного потенциала покоя.[9] Когда клеточная мембрана деполяризуется, внутриклеточная часть канала становится положительно заряженной, что приводит к тому, что открытая конфигурация канала становится более стабильным состоянием, чем закрытая конфигурация. Существует несколько моделей активации калиевых каналов:
- В модель скользящей спирали утверждает, что калиевый канал открывается из-за завинчивания спирали S4.
- В весло модель утверждает, что спирали S3 и S4 канала образуют «лопасти», которые движутся через деполяризованную мембрану и оттягивают спираль S5 от отверстия канала.
- В транспортная модель утверждает, что сфокусированное электрическое поле заставляет заряженные частицы перемещаться по каналу с небольшим перемещением спирали S4.
- Модель согласованное движение спиралей утверждает, что обе спирали S4 и S5 вращаются, а линкер S4-S5 заставляет спираль S6 двигаться, открывая канал.
- В модель консенсуса представляет собой среднее из приведенных выше моделей, которое помогает согласовать их с экспериментальными данными.[14]
Ca2+ каналы
Кальций (Ca2+) каналы регулируют высвобождение нейротрансмиттеров в синапсах, контролируют форму потенциалов действия, создаваемых натриевыми каналами, а в некоторых нейронах генерируют потенциалы действия.[9] Кальциевые каналы состоят из шести трансмембранных спиралей. S4 действует как датчик напряжения, вращаясь при воздействии определенных мембранных потенциалов, тем самым открывая канал.[15]

Нейротрансмиттеры изначально хранятся и синтезируются в везикулах в синапсе нейрона. Когда в клетке возникает потенциал действия, электрический сигнал достигает пресинаптического конца, и деполяризация заставляет кальциевые каналы открываться, высвобождая кальций для перемещения вниз по его электрохимическому градиенту. Этот приток кальция впоследствии заставляет везикулы нейротрансмиттера слиться с пресинаптической мембраной.[16] Ионы кальция инициируют взаимодействие обязательных белков-кофакторов с белками SNARE с образованием комплекса SNARE.[16] Эти комплексы SNARE опосредуют слияние везикул, стягивая мембраны вместе, просачивая нейротрансмиттеры в синаптическую щель. Затем молекулы нейротрансмиттера могут передавать сигнал следующей клетке через рецепторы на постсинаптической мембране. Эти рецепторы могут действовать как ионные каналы или GPCR (рецепторы, связанные с G-белками).[17] Как правило, нейромедиатор может вызывать возбуждающую или тормозную реакцию, в зависимости от того, что происходит на рецепторе.
Cl− каналы
Хлоридные каналы - это еще одна группа потенциалозависимых ионных каналов, о которых меньше известно. Они участвуют в таких процессах, как гладкие мышцы скелета и сердца, регулирование объема клеток, клеточный цикл и апоптоз.[18] Одно из основных семейств хлоридных белков называют белками CLC - общими каналами и переносчиками основных физиологических процессов у млекопитающих. Каналы CLC действуют как каналы с медленным стробированием; ионы водорода обмениваются на приток ионов хлора, позволяя анионам перемещаться через их электрохимический градиент.[19] Зависимый от напряжения канал хлорида C1C-1 представляет собой гомологичный димер, который относится к этому семейству и обнаруживается преимущественно в волокнах скелетных мышц.[20] В этом канале правильная деполяризация и реполяризация через хлорид-ионы важны для распространения потенциала действия.[18]
Ионные каналы, управляемые лигандами
Ионные каналы, управляемые лигандами находятся на постсинаптических нейронах. По умолчанию они принимают свою закрытую форму. Когда пресинаптический нейрон высвобождает нейротрансмиттеры в конце потенциала действия, они связываются с ионными каналами, управляемыми лигандами. Это заставляет каналы принимать свою открытую форму, позволяя ионам проходить через каналы вниз по градиенту их концентрации. Ионные каналы, управляемые лигандами, отвечают за быструю синаптическую передачу в нервной системе и в нервно-мышечном соединении.[21] Каждый лиганд-управляемый ионный канал имеет широкий спектр рецепторов с различными биофизическими свойствами, а также паттернами экспрессии в нервной системе.[22]
Инактивация
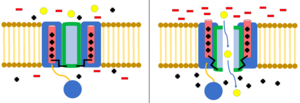
Инактивация - это когда поток ионов блокируется другим механизмом, кроме закрытия канала.[8] Канал в открытом состоянии может перестать пропускать ионы, или канал в своем закрытом состоянии может быть предварительно инактивирован для предотвращения потока ионов.[23] Инактивация обычно происходит при деполяризации клеточной мембраны и заканчивается, когда восстанавливается потенциал покоя.[8]
В натриевых каналах инактивация, по-видимому, является результатом действия спиралей III-VI, при этом III и IV действуют как своего рода откидная крышка, которая блокирует канал. Точный механизм плохо изучен, но, похоже, он полагается на частицу, которая имеет высокое сродство к экспонируемой части открытого канала.[24] Быстрая инактивация позволяет каналу останавливать поток натрия очень скоро после принятия его открытой конформации.[25]
Инактивация шара и цепи
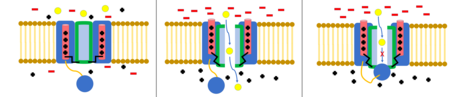
В модель шара и цепи, также известная как инактивация N-типа или инактивация с откидной крышкой, является стробирующим механизмом для некоторых потенциалзависимых ионных каналов. Управляемые по напряжению ионные каналы состоят из 4[сомнительный ] α-субъединицы, одна или несколько из которых будут иметь шаровой домен, расположенный на его цитоплазматический N-конец.[26] Область шара электростатически притягивается к области внутреннего канала. Когда ионный канал активирован, внутренняя область канала обнажается, и в течение миллисекунд цепь складывается, и шарик входит в канал, перекрывая проникновение ионов.[27] Канал возвращается в свое закрытое состояние, блокируя домен канала, и шарик выходит из поры.[28]
Деактивация

Деактивация - это возвращение ионного канала к его закрытой конформации. Для каналов с регулируемым напряжением это происходит, когда разность напряжений, которая изначально вызвала открытие канала, возвращается к своему исходному значению.[29]
В потенциал-управляемых натриевых каналах дезактивация необходима для восстановления после инактивации.[24]
Для калиевых каналов, управляемых напряжением, верно обратное, и деактивация замедляет восстановление канала после активации.[30] Закрытая конформация предполагается по умолчанию и включает частичное выпрямление спирали VI линкером IV-V. Механизмы, вызывающие открытие и закрытие, до конца не изучены. Закрытая конформация, по-видимому, имеет более высокую энергетическую конформацию, чем открытая, что также может помочь объяснить, как активируется ионный канал.[31]
Количественная оценка
Стробирующий заряд можно рассчитать, решив Уравнение Пуассона. Недавние исследования предложили основанный на моделировании молекулярной динамики метод определения стробирующего заряда путем измерения электрических конденсаторных свойств белков, встроенных в мембрану.[2] Активность ионных каналов, расположенных в плазматической мембране, можно измерить, просто прикрепив стеклянный капиллярный электрод непрерывно к мембране.[32] Другие ионные каналы, расположенные в мембранах митохондрий, лизосом и аппарата Гольджи, могут быть измерены новым методом, который включает использование искусственной двухслойной липидной мембраны, прикрепленной к 16-электродному устройству, которое измеряет электрическую активность.[32]
Смотрите также
Рекомендации
- ^ Альбертс, Брюс; Брей, Деннис; Льюис, Джулиан; Рафф, Мартин; Робертс, Кейт; Уотсон, Джеймс Д. (1994). Молекулярная биология клетки. Нью-Йорк: Гарленд. стр.523–547. ISBN 978-0-8153-1620-6.
- ^ а б c Махтенс, Ян-Филипп; Брионес, Родольфо; Аллева, Клаудиа; de Groot, Bert L .; Фальке, Кристоф (11 апреля 2017 г.). «Расчет стробирующего заряда с помощью компьютерного моделирования электрофизиологии». Биофизический журнал. 112 (7): 1396–1405. Bibcode:2017BpJ ... 112,1396M. Дои:10.1016 / j.bpj.2017.02.016. ISSN 0006-3495. ЧВК 5389965. PMID 28402882.
- ^ Гейчук Игорь; Хангги, Питер (19 марта 2002 г.). "Стробирование ионного канала: анализ времени первого прохождения типа Крамерса". Труды Национальной академии наук Соединенных Штатов Америки. 99 (6): 3552–3556. arXiv:физика / 0111187. Bibcode:2002PNAS ... 99.3552G. Дои:10.1073 / pnas.052015699. ISSN 0027-8424. ЧВК 122561. PMID 11891285.
- ^ Чезаре П., Мориондо А., Веллани В., Макнотон, Пенсильвания (июль 1999 г.). «Ионные каналы, закрытые теплом». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 96 (14): 7658–63. Bibcode:1999PNAS ... 96.7658C. Дои:10.1073 / pnas.96.14.7658. ЧВК 33597. PMID 10393876.
- ^ Хилле, Бертил (2001). Ионные каналы возбудимых мембран. Сандерленд, Массачусетс: Синауэр. ISBN 978-0-87893-321-1.
- ^ Вашкелевич, A.M; Гуния, А; Szkaradek, N; Słoczyńska, K; Крупинская, С; Марона, H (апрель 2013 г.). «Ионные каналы как мишени для лекарств при заболеваниях центральной нервной системы». Современная лекарственная химия. 20 (10): 1241–1285. Дои:10.2174/0929867311320100005. ISSN 0929-8673. ЧВК 3706965. PMID 23409712.
- ^ Ахерн, Кристофер А .; Паяндех, Цзянь; Босманс, Франк; Чанда, барон (январь 2016). "Автостопом по галактике с натриевым каналом, управляемой напряжением". Журнал общей физиологии. 147 (1): 1–24. Дои:10.1085 / jgp.201511492. ISSN 0022-1295. ЧВК 4692491. PMID 26712848.
- ^ а б c Беринг, Роберт; Коваррубиас, Мануэль (01.02.2011). «Механизмы инактивации закрытого состояния в потенциалозависимых ионных каналах». Журнал физиологии. 589 (Pt 3): 461–479. Дои:10.1113 / jphysiol.2010.191965. ISSN 0022-3751. ЧВК 3055536. PMID 21098008.
- ^ а б c d е Первес, Дейл; Августин, Джордж Дж .; Фитцпатрик, Дэвид; Кац, Лоуренс С .; Ламантия, Энтони-Самуэль; Макнамара, Джеймс О .; Уильямс, С. Марк (2001). "Ионные каналы, управляемые напряжением". Неврология. 2-е издание.
- ^ Грайдер, Майкл Х .; Глаубенскли, Кэролайн С. (2019), «Физиология, потенциал действия», StatPearls, StatPearls Publishing, PMID 30844170, получено 2019-10-29
- ^ а б Мантегацца, Массимо; Каттералл, Уильям А. (2012), Ноэбелс, Джеффри Л .; Аволи, Массимо; Rogawski, Michael A .; Олсен, Ричард В. (ред.), «Управляемые напряжением Na + каналы: структура, функция и патофизиология», Основные механизмы эпилепсии Джаспера (4-е изд.), Национальный центр биотехнологической информации (США), PMID 22787615, получено 2019-11-03
- ^ Сула, Алтын; Букер, Дженнифер; Ng, Leo C.T .; Нейлор, Клэр Э .; DeCaen, Paul G .; Уоллес, Б. А. (2017-02-16). «Полная структура активированного открытого натриевого канала». Nature Communications. 8 (1): 14205. Bibcode:2017НатКо ... 814205S. Дои:10.1038 / ncomms14205. ISSN 2041-1723. ЧВК 5316852. PMID 28205548.
- ^ Каттералл, Уильям А. (14 ноября 2013 г.). «Структура и функция потенциалзависимых натриевых каналов при атомном разрешении». Экспериментальная физиология. 99 (1): 35–51. Дои:10.1113 / expphysiol.2013.071969. ISSN 0958-0670. ЧВК 3885250. PMID 24097157.
- ^ Grizel, A. V .; Глухов, Г. С .; Соколова, О.С. (октябрь – декабрь 2014 г.). «Механизмы активации потенциалозависимых калиевых каналов». Acta Naturae. 6 (4): 10–26. Дои:10.32607/20758251-2014-6-4-10-26. ЧВК 4273088. PMID 25558391.
- ^ Каттералл, Уильям А. (август 2011 г.). "Кальциевые каналы, управляемые напряжением". Перспективы Колд-Спринг-Харбор в биологии. 3 (8): a003947. Дои:10.1101 / cshperspect.a003947. ISSN 1943-0264. ЧВК 3140680. PMID 21746798.
- ^ а б Зюдхоф, Томас К. (январь 2012 г.). «Кальциевый контроль высвобождения нейротрансмиттеров». Перспективы Колд-Спринг-Харбор в биологии. 4 (1): a011353. Дои:10.1101 / cshperspect.a011353. ISSN 1943-0264. ЧВК 3249630. PMID 22068972.
- ^ Юн, Тэ Ён; Лу, Сяобин; Дяо, Цзяцзе; Ли, Су-Мин; Ха, Тэкджип; Шин, Ён-Кюн (июнь 2008 г.). «Комплексин и Ca 2+ стимулируют слияние мембран, опосредованное SNARE». Структурная и молекулярная биология природы. 15 (7): 707–713. Дои:10.1038 / nsmb.1446. ISSN 1545-9985. ЧВК 2493294. PMID 18552825.
- ^ а б «Хлоридные каналы». Британский журнал фармакологии. 158 (Приложение 1): S130 – S134. Ноябрь 2009 г. Дои:10.1111 / j.1476-5381.2009.00503_6.x. ISSN 0007-1188. ЧВК 2884561.
- ^ Аккарди, Алессио; Пиколло, Алессандра (август 2010 г.). «Каналы и транспортеры CLC: белки с пограничными характеристиками». Biochimica et Biophysica Acta (BBA) - Биомембраны. 1798 (8): 1457–1464. Дои:10.1016 / j.bbamem.2010.02.022. ISSN 0006-3002. ЧВК 2885512. PMID 20188062.
- ^ Имбричи, Паола; Альтамура, Кончетта; Пессия, Мауро; Мантегацца, Ренато; Деафи, Жан-Франсуа; Камерино, Диана Конте (2015-04-27). «Хлоридные каналы ClC-1: новейшие исследования и будущие задачи». Границы клеточной неврологии. 9: 156. Дои:10.3389 / fncel.2015.00156. ISSN 1662-5102. ЧВК 4410605. PMID 25964741.
- ^ Александр, SPH; Мэти, А; Петерс, Дж. А. (ноябрь 2011 г.). "Ионные каналы, управляемые лигандами". Британский журнал фармакологии. 164 (Приложение 1): S115 – S135. Дои:10.1111 / j.1476-5381.2011.01649_4.x. ISSN 0007-1188. ЧВК 3315629.
- ^ Александр, SPH; Мэти, А; Петерс, Дж. А. (2011). "Ионные каналы, управляемые лигандами". Br J Pharmacol. 164 (Приложение 1): S115 – S135. Дои:10.1111 / j.1476-5381.2011.01649_4.x. ЧВК 3315629.
- ^ Армстронг, Клэй М. (21 ноября 2006 г.). «Деактивация Na канала из открытого и закрытого состояний». Труды Национальной академии наук. 103 (47): 17991–17996. Bibcode:2006PNAS..10317991A. Дои:10.1073 / pnas.0607603103. ISSN 0027-8424. ЧВК 1693860. PMID 17101981.
- ^ а б Куо, Чунг-Чин; Бин, Брюс П. (1994-04-01). «Каналы Na + должны быть отключены для восстановления после деактивации». Нейрон. 12 (4): 819–829. Дои:10.1016/0896-6273(94)90335-2. ISSN 0896-6273. PMID 8161454. S2CID 41285799.
- ^ Ю, Фрэнк Х; Каттерал, Уильям А. (2003). «Обзор семейства натриевых каналов с регулируемым напряжением». Геномная биология. 4 (3): 207. Дои:10.1186 / gb-2003-4-3-207. ISSN 1465-6906. ЧВК 153452. PMID 12620097.
- ^ «Модуляция инактивации K + канала N-типа путем сульфидратации через сероводород и полисульфиды». rdcu.be. Получено 2018-11-22.
- ^ Holmgren, M .; Jurman, M.E .; Йеллен, Г. (сентябрь 1996 г.). «Инактивация N-типа и область S4-S5 канала Shaker K +». Журнал общей физиологии. 108 (3): 195–206. Дои:10.1085 / jgp.108.3.195. ISSN 0022-1295. ЧВК 2229322. PMID 8882863.
- ^ Bénitah, J. P .; Chen, Z .; Balser, J. R .; Tomaselli, G.F .; Марбан, Э. (1999-03-01). «Молекулярная динамика поры натриевого канала зависит от стробирования: взаимодействия между движениями P-сегмента и инактивацией». Журнал неврологии. 19 (5): 1577–1585. Дои:10.1523 / JNEUROSCI.19-05-01577.1999. ISSN 0270-6474. ЧВК 6782169. PMID 10024345.
- ^ Беринг, Роберт; Коваррубиас, Мануэль (28 января 2011 г.). «Механизмы инактивации закрытого состояния в потенциалозависимых ионных каналах». Журнал физиологии. 589 (3): 461–479. Дои:10.1113 / jphysiol.2010.191965. ISSN 0022-3751. ЧВК 3055536. PMID 21098008.
- ^ Куо, Чун-Чин (1997-05-15). «Деактивация замедляет восстановление после инактивации в каналах K + шейкер». Журнал неврологии. 17 (10): 3436–3444. Дои:10.1523 / JNEUROSCI.17-10-03436.1997. ISSN 0270-6474. ЧВК 6573675. PMID 9133369.
- ^ Фаулер, Филип В .; Сансом, Марк С. П. (21 мая 2013 г.). «Пора потенциалзависимых каналов с ионами калия напряжена при закрытии». Nature Communications. 4 (1): 1872. Bibcode:2013 НатКо ... 4.1872F. Дои:10.1038 / ncomms2858. ISSN 2041-1723. ЧВК 3674235. PMID 23695666.
- ^ а б Камия, Коки; Осаки, Тошихиса; Накао, Кендзи; Кавано, Рюдзи; Фуджи, Сатоши; Мисава, Нобуо; Хаякава, Масатоши; Такеучи, Сёдзи (30.11.2018). «Электрофизиологическое измерение ионных каналов на мембранах плазмы / органелл с использованием встроенной липидной двухслойной системы». Научные отчеты. 8 (1): 17498. Bibcode:2018НатСР ... 817498K. Дои:10.1038 / s41598-018-35316-4. ISSN 2045-2322. ЧВК 6269590. PMID 30504856.
