База Хаузера - Hauser base
Базы Хаузера, также называемый основания амида магния, находятся магний соединения, используемые в органическая химия в качестве базы за реакции металлирования. Эти соединения впервые были описаны Чарльз Р. Хаузер в 1947 г.[1] По сравнению с литийорганические реагенты, соединения магния имеют более ковалентные и, следовательно, менее реактивные связи металл-лиганд. Следовательно, они демонстрируют более высокую степень толерантности функциональной группы и гораздо большую хемоселективность.[2] Обычно основания Хаузера используются при комнатной температуре, в то время как реакции с литийорганическими реагентами проводят при низких температурах, обычно при -78 ° C.
Структура
Твердотельная структура
Как все Гриньяр димеры,[3] Базы Хаузера, полученные из 2,2,6,6-тетраметилпиперидин (TMP)[4] и HMDS[5] соединены галогенидами в твердом состоянии. В отличие от реактивов Гриньяра, существуют также димерные амидные мостиковые основания Хаузера. У всех есть одно общее: они соединены менее объемными амидолигандами, такими как Et2N−,[4] Ph3P = N−[6] и яPr2N−.[7] Смещение галогенидных мостиков может быть результатом объемных групп амидного лиганда.
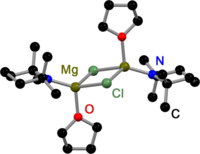 База TMP Hauser в твердом состоянии |  База HMDS Hauser в твердом состоянии | 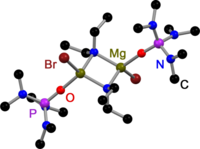 База Диэтиламидо Хаузера в твердом состоянии |
Структура решения
Хотя имеется много информации о применении этих реагентов, очень мало известно о природе оснований Хаузера в растворе. Одна из причин отсутствия информации заключается в том, что базы Хаузера демонстрируют сложное поведение в растворе. Было предложено, чтобы он мог быть похож на Равновесие Шленка из Реактивы Гриньяра в эфирном растворе, где существует более одного магнийсодержащего вещества.[8] В 2016 г. Neufeld et al. показано диффузионно-упорядоченная спектроскопия (ДОСИ)[9] что структура решения яPr2NMgCl лучше всего представлен общим равновесием Шленка:[10]
- яPr2NMgCl (А) ⇌ (яPr2N)2Mg (B) + MgCl2
Это равновесие сильно зависит от температуры с гетеролептический (А) быть основным видом при высоких температурах и гомолептик (B) при низких температурах. Димерные соединения с мостиковыми хлоридами и амидами также присутствуют в растворе ТГФ, хотя хлориды алкилмагния не димеризуются в ТГФ. При низких температурах, где избыток MgCl2 доступен MgCl2 координированные частицы также присутствуют в растворе.[10]
Использует
Базы Хаузера обычно используются как металлизация реагенты, например литийорганические соединения или же амиды металлов Прорыв в синтетических протоколах баз Хаузера достиг высшей точки в 1980-х и 1990-х годах. Eaton с коллегами показали, что яPr2NMgBr селективно магнетизирует карбоксамиды в орто-положении.[11]Позже Кондо, Сакамо и коллеги сообщили о полезности яPr2NMgX (X = Cl, Br) в качестве реагентов селективного депротонирования (исключительно в положении 2) для гетероциклического тиофена [12] и фенилсульфонил-замещенные индолы.[13]


Огромным недостатком оснований Хаузера является их плохая растворимость в ТГФ. Как следствие, скорость металлизации медленная, и требуется огромный избыток основания (в основном 10 экв.). Это обстоятельство затрудняет функционализацию металлического интермедиата электрофилом. Лучшая растворимость и реакционная способность были достигнуты за счет добавления к основанию Хаузера стехиометрических количеств LiCl. Эти так называемые Турбо-Базы Хаузера как например TMPMgCl·LiCl и яPr2NMgCl·LiCl коммерчески доступны.[14] и демонстрируют повышенную кинетическую основность, превосходную региоселективность и высокую функциональную групповую толерантность к большому количеству ароматный и гетероароматический субстраты.[15][16]
Подготовка
Основания Хаузера получают путем смешивания амина и Реактив Гриньяра.
- р2NH + R′MgX → R2NMgX + R'H X = Cl, Br, I
Часто используемые базы Хаузера
- яPr2NMgX
- TMPMgX (TMP = 2,2,6,6, тетраметилпиперидино, X = Cl, Br)
Рекомендации
- ^ Хаузер К. Р., Уокер Х (1947). «Конденсация некоторых сложных эфиров с помощью диэтиламиномагнийбромида». Варенье. Chem. Soc. 69 (2): 295. Дои:10.1021 / ja01194a040.
- ^ Li – Yuan Bao, R .; Zhao, R .; Ши, Л. (2015). «Прогресс и разработки турбо реактива Гриньяра i-PrMgCl·LiCl: путь за десять лет». Chem. Commun. 51 (32): 6884–6900. Дои:10.1039 / C4CC10194D. PMID 25714498.
- ^ например.; Семь, Ö .; Bolte, M .; Лернер, Х.-В. (2013). "Ди-μ-бромидо-бис [(диэтиловый эфир-κO) (2,4,6-триметилфенил) магний]: мезитиловый реактив Гриньяра » (PDF). Acta Crystallogr. E. 69 (7): m424. Дои:10.1107 / S1600536813017108. ЧВК 3772445. PMID 24046588.
- ^ а б García – Álvarez, P .; Graham, D. V .; Hevia, E .; Kennedy, A.R .; Klett, J .; Mulvey, R.E .; О'Хара, К. Т .; Уэзерстоун, С. (2008). «Разоблачение репрезентативных структур баз TMP-Active Hauser и Turbo-Hauser». Энгью. Chem. Int. Эд. 47 (42): 8079–8081. Дои:10.1002 / anie.200802618. PMID 18677732.
- ^ Ян, К.-С .; Chang, C.-C .; Huang, J.-Y .; Lin, C.-C .; Lee, G.-H .; Wang, Y .; Чан, М. Ю. (2002). «Синтез, характеристика и кристаллические структуры алкил-, алкинил-, алкоксо- и галогенамидов магния». J. Organomet. Chem. 648 (1–2): 176–187. Дои:10.1016 / S0022-328X (01) 01468-1.
- ^ Бацанов, А. С .; Bolton, P.D .; Copley, R.C.B .; Дэвидсон, М. Г .; Howard, J. A. K .; Lustig, C .; Прайс, Р. Д. (1998). "Металлирование имино (трифенил) фосфорана этилмагнийхлоридом: синтез, выделение и рентгеновская структура [Ph3P = NMgCl · O = P (NMe2)3]2". J. Organomet. Chem. 550 (1–2): 445–448. Дои:10.1016 / S0022-328X (97) 00550-0.
- ^ Армстронг Д. Р .; García – Álvarez, P .; Kennedy, A.R .; Mulvey, R.E .; Паркинсон, Дж. А. (2010). «Диизопропиламид и реагенты TMP Turbo-Grignard: структурное обоснование их контрастной реакционной способности». Энгью. Chem. Int. Эд. 49 (18): 3185–3188. Дои:10.1002 / anie.201000539. PMID 20352641.
- ^ Нойфельд, Р .: Определение молекулярной массы с помощью внешней калибровочной кривой DOSY как ценный метод определения реакционноспособных промежуточных продуктов в растворе. В: eDiss, Георг-Август-Университет Геттингена. 2016.
- ^ Neufeld, R .; Сталке, Д. (2015). «Точное определение молекулярной массы малых молекул с помощью DOSY-ЯМР с использованием внешних калибровочных кривых с нормализованными коэффициентами диффузии». Chem. Sci. 6 (6): 3354–3364. Дои:10.1039 / C5SC00670H. ЧВК 5656982. PMID 29142693.

- ^ а б Neufeld, R .; Teuteberg, T. L .; Herbst-Irmer, R .; Mata, R.A .; Сталке, Д. (2016). "Структуры решений базы Хаузер яPr2NMgCl и база Turbo-Hauser яPr2NMgCl·LiCl в THF и влияние LiCl на равновесие Шленка ». Варенье. Chem. Soc. 138 (14): 4796–4806. Дои:10.1021 / jacs.6b00345. PMID 27011251.
- ^ Eaton, P.E .; Lee, C.H .; Xiong, Y. (1989). «Основания амида магния и амидо-Гриньяры. 1. Ортомагнезирование». Варенье. Chem. Soc. 138 (20): 8016–8018. Дои:10.1021 / ja00202a054.
- ^ Shilai, M .; Кондо, Й .; Сакамото, Т. (2001). «Селективное металлирование тиофеновых и тиазольных колец с помощью амидного основания магния». J. Chem. Soc. Perkin Trans. 1 (4): 442–444. Дои:10.1039 / B007376H.
- ^ Кондо, Й .; Yoshida, A .; Сакамото, Т. (1996). «Магнирование индолов амидными основаниями магния». J. Chem. Soc. Perkin Trans. 1 (19): 2331–2332. Дои:10.1039 / P19960002331.
- ^ http://www.sigmaaldrich.com/chemistry/chemical-synthesis/technology-spotlights/chemetall.html
- ^ Тилли, Д .; Chevallier, F .; Mongin, F .; Грос, П. С. (1996). «Биметаллические комбинации для дегалогенирования металлов с участием органических соединений». Chem. Ред. 114 (2): 1207–1257. Дои:10.1021 / cr400367p.
- ^ Клатт, Т .; Markiewicz, J. T .; Sämann, C .; Кнохель, П. (2014). «Стратегии приготовления и использования функционализированных металлоорганических реагентов». J. Org. Chem. 79 (10): 4253–4269. Дои:10.1021 / jo500297r.
