История молекулярной теории - Википедия - History of molecular theory

В химия, то история молекулярной теории прослеживает истоки концепции или идеи существования сильные химические связи между двумя или более атомы.
Современная концепция молекул восходит к донаучным и греческим философам, таким как Левкипп и Демокрит кто утверждал, что вся вселенная состоит из атомы и пустоты. Около 450 г. до н.э. Эмпедокл воображаемый основные элементы (Огонь (![]() ), земной шар (
), земной шар (![]() ), воздуха (
), воздуха (![]() ), и воды (
), и воды (![]() )) и «силы» притяжения и отталкивания, позволяющие элементам взаимодействовать. Перед этим, Гераклит утверждал, что огонь или изменение были основополагающими для нашего существования, создаваемыми комбинацией противоположных свойств.[1] в Тимей, Платон, следующий Пифагор, рассматривал математические объекты, такие как число, точка, линия и треугольник, как фундаментальные строительные блоки или элементы этого эфемерного мира, и рассматривал четыре элемента огня, воздуха, воды и земли как состояния веществ, через которые истинные математические принципы или элементы пройдет.[2] Пятый элемент, неподкупная квинтэссенция эфир, считался основным строительным блоком небесных тел. Точка зрения Левкиппа и Эмпедокла, наряду с эфиром, была принята Аристотель и перешла в средневековую и ренессансную Европу. Современная концептуализация молекул начала развиваться в 19 веке вместе с экспериментальными доказательствами чистоты химические элементы и как отдельные атомы различных химических веществ, таких как водород и кислород, могут объединяться с образованием химически стабильных молекул, таких как молекулы воды.
)) и «силы» притяжения и отталкивания, позволяющие элементам взаимодействовать. Перед этим, Гераклит утверждал, что огонь или изменение были основополагающими для нашего существования, создаваемыми комбинацией противоположных свойств.[1] в Тимей, Платон, следующий Пифагор, рассматривал математические объекты, такие как число, точка, линия и треугольник, как фундаментальные строительные блоки или элементы этого эфемерного мира, и рассматривал четыре элемента огня, воздуха, воды и земли как состояния веществ, через которые истинные математические принципы или элементы пройдет.[2] Пятый элемент, неподкупная квинтэссенция эфир, считался основным строительным блоком небесных тел. Точка зрения Левкиппа и Эмпедокла, наряду с эфиром, была принята Аристотель и перешла в средневековую и ренессансную Европу. Современная концептуализация молекул начала развиваться в 19 веке вместе с экспериментальными доказательствами чистоты химические элементы и как отдельные атомы различных химических веществ, таких как водород и кислород, могут объединяться с образованием химически стабильных молекул, таких как молекулы воды.
17-го века
Самые ранние представления о формах и связях атомов были предложены Левкипп, Демокрит, и Эпикур которые рассудили, что твердость материала соответствует форме задействованных атомов. Таким образом, атомы железа твердые и крепкие с крючками, которые удерживают их в твердое тело; атомы воды гладкие и скользкие; атомы соли из-за своего вкуса острые и заостренные; Атомы воздуха легкие и кружатся, проникая во все другие материалы.[3] Демокрит был главным сторонником этой точки зрения. Используя аналогии, основанные на опыте чувства, он дал картину или изображение атома, в котором атомы отличались друг от друга своей формой, размером и расположением частей. Более того, связи объяснялись материальными связями, в которых отдельные атомы снабжались насадками: одни с крючками и ушками, другие с шарами и гнездами (см. Схему).[4]
С ростом схоластика и упадок Римской империи, атомная теория была оставлена на много веков в пользу различных теорий четырех элементов и более поздних алхимических теорий. Однако в 17 веке произошел возрождение теории атома, прежде всего благодаря работам Гассенди, и Ньютон. Среди других ученых того времени Гассенди глубоко изучал древнюю историю, написал крупные труды о Эпикур натурфилософия и был ее убедительным пропагандистом. Он пришел к выводу, что учет размера и формы атомов, движущихся в пустоте, может объяснить свойства материи. Тепло происходило из-за маленьких круглых атомов; от холода до пирамидальных атомов с острыми кончиками, что и объясняет колющее ощущение сильного холода; и твердые тела удерживались вместе переплетенными крючками.[5] Ньютон, хотя он признавал различные теории присоединения атомов, модные в то время, то есть «зацепленные атомы», «склеенные атомы» (тела в состоянии покоя) и теорию «склеивания вместе сговорчивыми движениями», скорее верил, как это известно в "Запрос 31" 1704 г. Opticks, что частицы притягиваются друг к другу некоторой силой, которая «при непосредственном контакте чрезвычайно сильна, на малых расстояниях выполняет химические операции и достигает не далеко от частиц с каким-либо ощутимым действием». [6]
Однако более конкретно концепция агрегатов или единиц связанных атомов, т. Е. "молекулы ", ведет свое происхождение от Роберт Бойл гипотеза 1661 года в его знаменитом трактате Скептический химик, этот вопрос состоит из группы частицы и это химическое изменение является результатом перегруппировки кластеров. Бойль утверждал, что основные элементы материи состояли из частиц различных видов и размеров, называемых "тельца ", которые могли объединяться в группы.
В 1680 г. корпускулярная теория за основу французский химик Николя Лемери предусмотрено, что кислотность любого вещества состояла из его заостренных частиц, а щелочи были наделены порами разного размера.[7] Согласно этой точке зрения, молекула состоит из корпускул, объединенных геометрической связью точек и пор.
18-ый век

Ранним предшественником идеи связанных «комбинаций атомов» была теория «комбинации через химическое сродство ". Например, в 1718 году французский химик, опираясь на концепцию комбинаций кластеров Бойля, Этьен Франсуа Жоффруа разработал теории химическое сродство объяснять комбинации частиц, полагая, что некая алхимическая «сила» сближает определенные алхимические компоненты. Имя Жоффруа наиболее известно в связи с его таблицами "родство " (таблицы des rapports), которую он представил Французская Академия в 1718 и 1720 гг.
Это были списки, составленные путем сопоставления наблюдений за действием веществ друг на друга, показывающие разную степень сродства, проявляемую аналогичными телами для разных реагенты. Эти таблицы сохранили свою моду до конца века, пока их не вытеснили более глубокие концепции, введенные CL Berthollet.
В 1738 году швейцарский физик и математик Даниэль Бернулли опубликовано Гидродинамика, которые легли в основу кинетическая теория газов. В этой работе Бернулли изложил аргумент, используемый до сих пор, что газы состоят из большого количества молекул, движущихся во всех направлениях, и их удары по поверхности вызывают образование газа. давление что мы чувствуем, и что мы переживаем как высокая температура это просто кинетическая энергия их движения. Теория была принята не сразу, отчасти потому, что сохранение энергии еще не было установлено, и для физиков не было очевидно, как столкновения между молекулами могут быть совершенно упругими.
В 1789 г. Уильям Хиггинс опубликовал взгляды на то, что он назвал комбинациями «абсолютных» частиц, которые предвещали концепцию валентные облигации. Если, например, согласно Хиггинсу, сила между конечной частицей кислорода и конечной частицей азота составляла 6, тогда сила силы была бы разделена соответственно, и аналогично для других комбинаций конечных частиц:

19 век

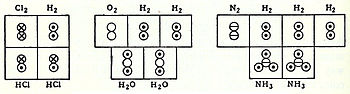
Подобно этим взглядам в 1803 г. Джон Далтон принял за единицу атомный вес водорода, самого легкого элемента, и определил, например, что соотношение для азотистый ангидрид было от 2 до 3, что дает формулу N2О3. Дальтон ошибочно предположил, что атомы «сцепляются» вместе, образуя молекулы. Позже, в 1808 году, Дальтон опубликовал свою знаменитую диаграмму объединенных «атомов»:
Амедео Авогадро создал слово «молекула».[8] В своей статье 1811 года «Эссе по определению относительных масс элементарных молекул тел» он по существу утверждает, т.е. Partington с Краткая история химии, который:[9]
Мельчайшие частицы газов не обязательно являются простыми атомами, но состоят из определенного числа этих атомов, объединенных притяжением в единый молекула.
Обратите внимание, что эта цитата не является дословным переводом. Авогадро использует название «молекула» как для атомов, так и для молекул. В частности, он использует название «элементарная молекула», когда обращается к атомам, и для усложнения вопроса также говорит о «составных молекулах» и «составных молекулах».
Во время пребывания в Верчелли Авогадро написал краткую записку (мемория), в которой он объявил гипотезу того, что мы теперь называем Закон Авогадро: равные объемы газов при одинаковой температуре и давлении содержат одинаковое количество молекул. Этот закон подразумевает, что соотношение, возникающее между массами одинаковых объемов разных газов, при одинаковых температуре и давлении, соответствует соотношению между соответствующими молекулярная масса. Таким образом, относительные молекулярные массы теперь можно было рассчитывать по массам проб газа.
Авогадро разработал эту гипотезу, чтобы согласовать Жозеф Луи Гей-Люссак 1808 год Закон об объемах и смешивании газов с Дальтоном 1803 г. атомная теория. Самая большая трудность, которую должен был решить Авогадро, заключалась в огромной путанице в то время в отношении атомов и молекул - одним из наиболее важных вкладов работы Авогадро было четкое различение одного от другого, признание того, что простые частицы тоже могут состоять из молекул, и что они состоят из атомов. Дальтон, напротив, не рассматривал эту возможность. Любопытно, что Авогадро рассматривает только молекулы, содержащие четное число атомов; он не говорит, почему исключены нечетные числа.
В 1826 году, основываясь на работах французского химика Авогадро, Жан-Батист Дюма состояния:
Газы в аналогичных условиях состоят из молекулы или атомы, расположенные на одинаковом расстоянии, что равносильно утверждению, что они содержат одно и то же число в одном объеме.
В соответствии с этими представлениями в 1833 г. французский химик Марк Антуан Огюст Годен представил четкое изложение гипотезы Авогадро,[10] что касается атомных весов, с помощью «объемных диаграмм», которые четко показывают как полукорректные молекулярные геометрии, такие как линейная молекула воды, так и правильные молекулярные формулы, такие как H2О:
В двух статьях, описывающих его «теорию атомарности элементов» (1857–58), Фридрих Август Кекуле был первым, кто предложил теорию о том, как каждый атом в органической молекуле связан с каждым другим атомом. Он предположил, что атомы углерода четырехвалентны и могут связываться друг с другом, образуя углеродные скелеты органических молекул.
В 1856 г. шотландский химик Арчибальд Купер начал исследование бромирование бензола в лаборатории Чарльз Вюрц в Париже.[11] Через месяц после выхода второй статьи Кекуле была опубликована независимая и во многом идентичная теория молекулярной структуры Купера. Он предложил очень конкретную идею молекулярной структуры, предположив, что атомы соединяются друг с другом, как в наши дни. Игрушки в конкретных трехмерных структурах. Купер был первым, кто использовал линии между атомами в сочетании со старым методом использования скобок для обозначения связей, а также постулировал прямые цепочки атомов как структуры одних молекул, кольцевые молекулы других, например, в Винная кислота и циануровая кислота.[12] В более поздних публикациях облигации Купера были представлены прямыми пунктирными линиями (хотя неизвестно, предпочитает ли это наборщик), например, с помощью алкоголь и Щавелевая кислота ниже:

В 1861 году неизвестный учитель венской средней школы по имени Джозеф Лошмидт издал за свой счет буклет под названием Chemische Studien I, содержащий новаторские молекулярные изображения, на которых показаны как "кольцевые" структуры, так и структуры с двойными связями, такие как:[13]
Лошмидт также предложил возможную формулу бензола, но оставил вопрос открытым. Первое предложение о современной структуре бензола было сделано Кекуле в 1865 году. Циклическая природа бензола была окончательно подтверждена кристаллографом. Кэтлин Лонсдейл. Бензол представляет собой особую проблему, поскольку для учета всех связей необходимо чередование двойной углеродные связи:

В 1865 г. немецкий химик Август Вильгельм фон Хофманн был первым, кто создал молекулярные модели стержней и шариков, которые он использовал в лекции в Королевский институт Великобритании, например, метан, показанный ниже:

В основе этой модели лежало ранее высказанное в 1855 г. предложение его коллеги. Уильям Одлинг который углерод является четырехвалентный. Отметим, что цветовая схема Хофманна используется и по сей день: азот = синий, кислород = красный, хлор = зеленый, сера = желтый, водород = белый.[14] Недостатки модели Хофманна были в основном геометрическими: углерод соединение было показано как планарный, а не тетраэдрические, и атомы были несоразмерны, например углерод был меньше по размеру, чем водород.
В 1864 году шотландский химик-органик Александр Крам Браун начал рисовать изображения молекул, в которых он заключил символы атомов в кружки и использовал пунктирные линии, чтобы соединить атомы вместе таким образом, чтобы удовлетворить валентность каждого атома.
1873 год, по многим оценкам, стал поворотным моментом в истории развития концепции «молекулы». В этом году известный шотландский физик Джеймс Клерк Максвелл опубликовал свою знаменитую тринадцатистраничную статью «Молекулы» в сентябрьском номере журнала Природа.[15] В первом разделе этой статьи Максвелл четко заявляет:
Атом - это тело, которое нельзя разрезать пополам; а молекула это наименьшая возможная порция определенного вещества.
После разговора о атомная теория из Демокрит Максвелл продолжает говорить нам, что слово «молекула» - это современное слово. Он заявляет: "этого не происходит в Словарь Джонсона. Идеи, которые он воплощает, принадлежат современной химии ». Нам говорят, что« атом »- это материальная точка, окруженная« потенциальными силами »и что, когда« летающие молекулы »ударяются о твердое тело в постоянной последовательности, это вызывает что вызвано давление воздуха и других газов. Однако в этот момент Максвелл отмечает, что никто никогда не видел молекулы и не обращался с ними.
В 1874 г. Якобус Хенрикус ван 'т Хофф и Джозеф Акилле Ле Бель независимо предположил, что феномен оптическая активность можно объяснить, если предположить, что химические связи между атомами углерода и их соседями направлены в сторону углов правильного тетраэдра. Это привело к лучшему пониманию трехмерной природы молекул.
Эмиль Фишер разработал Проекция Фишера техника для просмотра трехмерных молекул на двухмерном листе бумаги:

В 1898 г. Людвиг Больцманн, в его Лекции по теории газа, использовал теорию валентность чтобы объяснить явление газофазной диссоциации молекул, и при этом нарисовал один из первых элементарных, но подробных рисунков перекрытия атомных орбиталей. Отметив прежде всего известный факт, что молекулярные йод пар диссоциирует на атомы при более высоких температурах, Больцман утверждает, что мы должны объяснить существование молекул, состоящих из двух атомов, «двойного атома», как его называет Больцман, силой притяжения, действующей между двумя атомами. Больцман заявляет, что это химическое притяжение, вследствие определенных фактов химической валентности, должно быть связано с относительно небольшой областью на поверхности атома, называемой чувствительный регион.
Больцман заявляет, что эта «чувствительная область» будет лежать на поверхности атома или может частично находиться внутри атома и будет прочно соединена с ним. В частности, он утверждает, что «только когда два атома расположены так, что их чувствительные области находятся в контакте или частично перекрываются, между ними будет химическое притяжение. Затем мы говорим, что они химически связаны друг с другом». Это изображение подробно описано ниже, показывая α-чувствительная область атома-А, перекрывающегося с β-чувствительная область атома-B:[16]

20 век
В начале 20 века американский химик Гилберт Н. Льюис начал использовать точки в лекциях, обучая студентов в Гарвард, чтобы представить электроны вокруг атомов. Его ученики предпочитали эти рисунки, что стимулировало его в этом направлении. Из этих лекций Льюис отметил, что элементы с определенным числом электронов, по-видимому, обладают особой стабильностью. На это явление указал немецкий химик. Ричард Абегг в 1904 году, который Льюис назвал «законом валентности Абегга» (ныне широко известный как Правило Абегга ). Льюису казалось, что как только ядро из восьми электронов формируется вокруг ядра, этот слой заполняется, и начинается новый слой. Льюис также отметил, что различные ионы с восемью электронами тоже, казалось, обладал особой стабильностью. Исходя из этих взглядов, он предложил правило восьми или Правило октета: Ионы или атомы с заполненным слоем из восьми электронов обладают особой стабильностью..[17]
Более того, отметив, что куб имеет восемь углов, Льюис представил атом, имеющий восемь сторон, доступных для электронов, как угол куба. Впоследствии, в 1902 году он разработал концепцию, в которой кубические атомы могут связываться на своих сторонах, образуя молекулы кубической структуры.
Другими словами, связи пары электронов образуются, когда два атома имеют общий край, как в структуре C ниже. Это приводит к разделению двух электронов. Точно так же заряженные ионные связи образуются в результате переноса электрона от одного куба к другому без общего ребра. А. Промежуточное состояние B Льюис также постулировал, что общий угол только один.

Следовательно, двойные связи образованы разделением грани между двумя кубическими атомами. Это приводит к разделению четырех электронов.
В 1913 г., работая заведующим кафедрой химии Калифорнийский университет в Беркли Льюис зачитал предварительный набросок статьи английского аспиранта, Альфред Лаук Парсон, который был в Беркли в течение года. В этой статье Парсон предположил, что электрон это не только электрический заряд, но и небольшой магнит (или "магнетон "как он это назвал) и, кроме того, что химическая связь возникает в результате разделения двух электронов между двумя атомами.[18] Это, по словам Льюиса, означало, что соединение происходит, когда два электрона образуют общую границу между двумя полными кубами.
Об этих взглядах в своей знаменитой статье 1916 г. Атом и молекула, Льюис ввел «структуру Льюиса» для представления атомов и молекул, где точки представляют электроны и линии представляют ковалентные связи. В этой статье он разработал концепцию электронно-парная связь, в котором два атома могут иметь от одного до шести электронов, образуя таким образом одноэлектронная связь, а одинарная облигация, а двойная связь, или тройная связь.

По словам Льюиса:
Электрон может составлять часть оболочки двух разных атомов, и нельзя сказать, что он принадлежит только одному из них.
Более того, он предположил, что атом имеет тенденцию образовывать ион, приобретая или теряя количество электронов, необходимое для создания куба. Таким образом, структуры Льюиса показывают каждый атом в структуре молекулы, используя его химический символ. Линии проводятся между атомами, которые связаны друг с другом; иногда вместо линий используются пары точек. Избыточные электроны, образующие неподеленные пары, представлены в виде пар точек и помещаются рядом с атомами, на которых они находятся:

Обобщая свои взгляды на свою новую модель связи, Льюис заявляет:[19]
Два атома могут соответствовать правилу восьми или правилу октетов не только путем переноса электронов от одного атома к другому, но также за счет совместного использования одной или нескольких пар электронов ... Таким образом, два электрона связаны вместе, когда они находятся между два атомных центра, удерживаемые вместе в оболочках двух атомов, я считал химической связью. Таким образом, у нас есть конкретная картина этого физического объекта, того «крючка и ока», который является частью веры химика-органика.
В следующем году, в 1917 году, неизвестный американский инженер-химик по имени Линус Полинг учился методу дальтонского крепления на крючок в Орегонский сельскохозяйственный колледж, которое в то время было модным описанием связей между атомами. У каждого атома было определенное количество крючков, которые позволяли ему прикрепляться к другим атомам, и определенное количество глазков, которые позволяли другим атомам прикрепляться к нему. При соединении крючка и петли образовалась химическая связь. Однако Полинг не удовлетворился этим архаичным методом и обратился к недавно появившейся области квантовая физика для нового метода.
В 1927 году физики Фриц Лондон и Вальтер Хайтлер применил новую квантовую механику к насыщаемым, нединамическим силам притяжения и отталкивания, то есть обменным силам молекулы водорода. Их трактовка этой проблемы валентной связью в их совместной статье,[20] был вехой в том, что он подвел химию к квантовой механике. Их работа оказала влияние на Полинга, который только что получил докторскую степень и посетил Гайтлера и Лондон в Цюрихе. Guggenheim Fellowship.
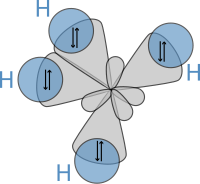
Впоследствии, в 1931 году, опираясь на работы Гейтлера и Лондона и теории, содержащиеся в знаменитой статье Льюиса, Полинг опубликовал свою новаторскую статью «Природа химической связи».[21] (видеть: рукопись ) в котором он использовал квантовая механика для расчета свойств и структур молекул, таких как углы между связями и вращение вокруг связей. На основе этих концепций Полинг разработал теория гибридизации для учета связей в молекулах, таких как CH4, в котором четыре sp³ гибридизированные орбитали перекрываются водород с 1 с орбитальный, дающий четыре сигма (σ) связи. Четыре связи имеют одинаковую длину и силу, что дает молекулярную структуру, как показано ниже:
Благодаря этим исключительным теориям Полинг выиграл в 1954 г. Нобелевская премия по химии. Примечательно, что он был единственным человеком, который когда-либо выигрывал два неразделенных Нобелевские премии, выиграв Нобелевская премия мира в 1963 г.
В 1926 г. французский физик Жан Перрен получил Нобелевскую премию по физике за убедительное доказательство существования молекул. Он сделал это, вычислив Число Авогадро используя три различных метода, все с использованием жидкофазных систем. Сначала он использовал gamboge мылообразная эмульсия, во-вторых, проводя экспериментальные работы на Броуновское движение и, в-третьих, подтверждением теории вращения частиц в жидкой фазе Эйнштейна.[22]
В 1937 г. химик К.Л. Волк представил концепцию супермолекулы (Übermoleküle) описать водородная связь в уксусная кислота димеры. Это в конечном итоге привело бы к области надмолекулярная химия, который является исследованием нековалентной связи.
В 1951 г. физик Эрвин Вильгельм Мюллер изобретает полевой ионный микроскоп и первым увидит атомы, например связанные атомные структуры на кончике металлического острия.
В 1999 г. исследователи из Университет из Вена сообщил о результатах экспериментов на волновая дуальность для C60 молекулы.[23] Данные, опубликованные Zeilinger et al. соответствовали де Бройль волновая интерференция для C60 молекулы. Этот эксперимент был отмечен расширением применимости дуальности волна-частица примерно на один порядок в макроскопическом направлении.[24]
В 2009 г. исследователи из IBM удалось сделать первый снимок реальной молекулы.[25] Используя атомно-силовой микроскоп каждый атом и связь пентацен молекула могла быть изображена.
Смотрите также
- История химии
- История квантовой механики
- История термодинамики
- История молекулярной биологии
- Кинетическая теория
- Атомная теория
Рекомендации
- ^ Рассел, Бертран (2007). История западной философии. Саймон и Шустер. п. 41. ISBN 978-1-4165-5477-6.
- ^ Рассел, Бертран (2007). История западной философии. Саймон и Шустер. п. 145. ISBN 978-1-4165-5477-6.
- ^ Пфеффер, Джереми, И .; Нир, Шломо (2001). Современная физика: вводный текст. Всемирная научная издательская компания. п. 183. ISBN 1-86094-250-4.
- ^ Видеть свидетельство DK 68 A 80, DK 68 A 37 и DK 68 A 43. См. Также Кассирер, Эрнст (1953). Очерк о человеке: введение в философию человеческой культуры. Doubleday & Co. стр.214. ISBN 0-300-00034-0. ASIN B0007EK5MM.
- ^ Лестер, Генри, М. (1956). Исторический фон химии. Джон Вили и сыновья. п. 112. ISBN 0-486-61053-5.
- ^ (а) Исаак Ньютон, (1704). Opticks. (стр. 389). Нью-Йорк: Дувр.
(б) Бернард, Пуллман; Райзингер, Аксель, Р. (2001). Атом в истории человеческой мысли. Издательство Оксфордского университета. п. 139. ISBN 0-19-515040-6.CS1 maint: несколько имен: список авторов (связь) - ^ Лемери, Николас. (1680). Приложение к курсу химии. Лондон, стр. 14-15.
- ^ Лей, Вилли (июнь 1966 г.). "Обновленная Солнечная система". Довожу до вашего сведения. Галактика Научная фантастика. С. 94–106.
- ^ Авогадро, Амедео (1811 г.). «Массы элементарных молекул тел». Journal de Physique. 73: 58–76.
- ^ Сеймур Х. Маускопф (1969). «Атомные структурные теории Ампера и Годена: молекулярные спекуляции и гипотеза Авогадро». Исида. 60 (1): 61–74. Дои:10.1086/350449. JSTOR 229022.
- ^ Концепции химической связи - Государственный университет Оклахомы
- ^ Боуден, Мэри Эллен (1997). Успешные в химии: человеческое лицо химических наук. Филадельфия, Пенсильвания: Фонд химического наследия. стр.90–93. ISBN 9780941901123.
- ^ Бадер А. и Паркер Л. (2001). "Джозеф Лошмидт ", Физика сегодня, Мар.
- ^ Оллис, В. Д. (1972). «Модели и молекулы». Труды Королевского института Великобритании. 45: 1–31.
- ^ Максвелл, Джеймс Клерк "Молекулы В архиве 2007-02-09 в Wayback Machine ". Природа, Сентябрь 1873 г.
- ^ Больцман, Людвиг (1898). Лекции по теории газа (Перепечатка ред.). Дувр. ISBN 0-486-68455-5.
- ^ Кобб, Кэти (1995). Creations of Fire - живая история химии от алхимии до атомной эры. Издательство "Персей". ISBN 0-7382-0594-X.
- ^ Парсон, А.Л. (1915). "Магнетонная теория строения атома". Смитсоновское издание 2371, Вашингтон.
- ^ «Валентность и структура атомов и молекул», Г. Н. Льюис, Серия монографий Американского химического общества, стр. 79 и 81.
- ^ Гейтлер, Вальтер; Лондон, Фриц (1927). "Wechselwirkung Neutraler Atome und homöopolare Bindung nach der Quantenmechanik". Zeitschrift für Physik. 44: 455–472. Bibcode:1927ZPhy ... 44..455H. Дои:10.1007 / BF01397394.
- ^ Полинг, Линус (1931). «Природа химической связи. Применение результатов, полученных из квантовой механики и теории парамагнитной восприимчивости, к структуре молекул». Варенье. Chem. Soc. 53: 1367–1400. Дои:10.1021 / ja01355a027.
- ^ Перрин, Жан, Б. (1926). Прерывистая структура материи, Нобелевская лекция, 11 декабря.
- ^ Arndt, M .; О. Наирз; J. Voss-Andreae; К. Келлер; Г. ван дер Зоу; А. Цайлингер (14 октября 1999 г.). «Волново-частичный дуализм молекул C60». Природа. 401 (6754): 680–682. Bibcode:1999Натура.401..680А. Дои:10.1038/44348. PMID 18494170.
- ^ Рэй, А. И. М. (14 октября 1999 г.). «Квантовая физика: волны, частицы и фуллерены». Природа. 401 (6754): 651–653. Bibcode:1999Натура.401..651R. Дои:10.1038/44294.
- ^ Потрясающее изображение одной молекулы.
дальнейшее чтение
- Партингтон, Дж. Р. (1989). Краткая история химии. Dover Publications, Inc. ISBN 0-486-65977-1.
- Аткинс, Питер (2003). Молекулы Аткинса, 2-е изд.. Издательство Кембриджского университета. ISBN 0-521-53536-0.
- Сарджент, Тед (2006). Танец молекул - как нанотехнологии меняют нашу жизнь. Громовой пресс. ISBN 1-56025-809-8.
- Шерри, Эрик Р. (2007). Периодическая таблица, ее история и ее значение. Издательство Оксфордского университета. ISBN 978-0-19-530573-9.
внешняя ссылка
- Геометрические структуры молекул. - Колледж Миддлбери
- Атомы и молекулы - Университет Макмастера
- 3D-просмотрщик молекул - Семья Уайлис
- Молекула месяца - Школа химии Бристольского университета
- [1] - Сайт Эрика Шерри по истории и философии химии
Типы
- Молекула антитела - Национальный музей здоровья
- 15 типов молекул - Определения ИЮПАК
Определения
- Определение молекулы - Государственный университет Фростбурга (Кафедра химии)
- Определение молекулы[постоянная мертвая ссылка ] - ИЮПАК
Статьи
- Молекулы, используемые для изготовления наноразмерных контейнеров - Лента новостей TRN
- Молекулярные компьютерные процессоры - Лаборатория HP

