Номенклатура неорганической химии ИЮПАК 2005 - Википедия - IUPAC nomenclature of inorganic chemistry 2005
Номенклатура неорганической химии, Рекомендации ИЮПАК 2005 г. это версия 2005 года Номенклатура неорганической химии (который неофициально называется Красная книга). Это свод правил для наименования неорганических соединений, рекомендованных Международный союз теоретической и прикладной химии (ИЮПАК).
Резюме
Издание 2005 г. заменяет их предыдущие рекомендации. Номенклатура Красная книга неорганической химии, Рекомендации ИЮПАК 1990 г. (Красная книга I), и «где необходимо» (sic) Номенклатура неорганической химии II, Рекомендации IUPAC 2000 (Красная книга II).
Рекомендации занимают более 300 страниц.[1] а полный текст можно скачать с IUPAC.[2] Были внесены исправления.[3]
Помимо реорганизации содержания, есть новый раздел по металлоорганическим соединениям и формальный список элементов, который будет использоваться вместо электроотрицательность списки в элементах последовательности в формулах и именах. Концепция предпочтительного названия IUPAC (PIN), часть пересмотренной синей книги для наименования органических соединений, еще не принята для неорганических соединений. Однако существуют рекомендации относительно того, какой метод именования следует использовать.
Методы именования
В рекомендациях описывается ряд различных способов именования соединений. Это:
- композиционное название (например, хлорид натрия)
- заместительное название на основе родительских гидридов (GeCl2Мне2 дихлордиметилгерман)
- аддитивное именование ([MnFO3] фторидотриоксидомарганец)
Дополнительно есть рекомендации по следующему:
- наименование кластерных соединений
- разрешенные названия для неорганических кислот и производных
- название твердых фаз, например нестехиометрические фазы
Для простого соединения, такого как AlCl3 различные соглашения об именах приводят к следующему:
- композиционный: трихлорид алюминия (стехиометрически ) или гексахлорид диалюминия (димер )
- замещающий: trichloralumane
- добавка: трихлорид алюминия; гексахлоридодиалюминий (димер без структурной информации); ди-μ-хлоридо-тетрахлоридо-1κ2Cl, 2κ2Cl-диалюминий (димер со структурной информацией)
Элементы секвенирования - список "электроотрицательности"
В рекомендациях использование электроотрицательности элементов для секвенирования было заменено формальным списком, который в общих чертах основан на электроотрицательности. В рекомендациях по-прежнему используются термины электроположительный и электроотрицательный для обозначения относительного положения элемента в этом списке.
Простое практическое правило игнорирования лантаноидов и актинидов:
- для двух элементов в разных группах - тогда элемент в группе с более высоким номером имеет более высокую "электроотрицательность"
- для двух элементов в одной группе элемент с меньшим атомным номером имеет более высокую "электроотрицательность".
- Установлено, что водород менее электроотрицателен, чем любой халькоген, и более электроотрицателен, чем любой пниктоген. Следовательно, формулы воды и аммиака можно записать H2O и NH3 соответственно.
Полный список, от наивысшей до самой низкой «электроотрицательности» (с добавлением элементов со 112 по 118, которые еще не были названы в 2005 году, в соответствующие группы):
- Группа 17 в последовательности атомных номеров, то есть F – Ts с последующим
- Группа 16 в последовательности атомных номеров, т.е. O – Lv с последующим
- ЧАС, водород, с последующим
- Группа 15 в последовательности атомных номеров, то есть N – Mc с последующим
- Группа 14 в последовательности атомных номеров, то есть C – Fl с последующим
- Группа 13 в последовательности атомных номеров, то есть B – Nh с последующим
- Группа 12 в последовательности атомных номеров, т.е. Zn – Cn с последующим
- Группа 11 в последовательности атомных номеров, т.е. Cu – Rg с последующим
- Группа 10 в последовательности атомных номеров, т.е. Ni – Ds с последующим
- Группа 9 в последовательности атомных номеров, т.е. Co – Mt с последующим
- Группа 8 в последовательности атомных номеров, т.е. Fe – Hs с последующим
- Группа 7 в последовательности атомных номеров, то есть Mn – Bh с последующим
- 6 группа в последовательности атомных номеров, то есть Cr – Sg с последующим
- Группа 5 в последовательности атомных номеров, т.е. V – Db с последующим
- Группа 4 в последовательности атомных номеров, т.е. Ti – Rf с последующим
- Группа 3 в последовательности атомных номеров, то есть Sc – Y с последующим
- то лантаноиды в последовательности атомных номеров, то есть La – Lu с последующим
- то актиноиды в последовательности атомных номеров, т.е. Ac – Lr с последующим
- Группа 2 в последовательности атомных номеров, то есть Be – Ra с последующим
- Группа 1 (кроме H) в последовательности атомных номеров, т.е. Li – Fr с последующим
- Группа 18 в последовательности атомных номеров, т.е. He – Og
Определение номенклатуры для использования
| Действие | Добавление сложный? | Определенный стехиометрия? | одноатомный ? | молекулярный ? | металл настоящее время? | Связь с углерод ? | переходный металл группа 3–12? | металл основной группы группы 1, 2, 3–6? |
|---|---|---|---|---|---|---|---|---|
| Рассматривайте каждый компонент отдельно использовать композиционный | да | |||||||
| Использовать твердые вещества именование | Нет | Нет | ||||||
| Название элемента или одноатомного катиона / аниона / радикала | Нет | да | да | |||||
| Разделите компоненты на «электроположительные» / «электроотрицательные». Рассматривайте каждый компонент отдельно Использовать обобщенный стехиометрический именование | Нет | да | Нет | Нет | ||||
| Использовать Синяя книга (Органическое соединение ) | Нет | да | Нет | да | Нет | да | ||
| Использовать добавка именование для группа 3-12 металлоорганические соединения | Нет | да | Нет | да | да | да | да | |
| Использовать замещающий именование для металлорганические соединения 3–6 группы Использовать композиционный для 1–2 групп металлоорганических соединений | Нет | да | Нет | да | да | да | Нет | да |
| Использовать добавка именование для координационные комплексы | Нет | да | Нет | да | да | Нет | да | |
| Выберите либо замещающий или же добавка | Нет | да | Нет | да | Нет | Нет |
Примечание "рассматривать отдельно" означает использовать таблицу решений для каждого компонента.
Имена элементов
Образец неопределенной структуры
Неопределенный образец просто берет имя элемента. Например, образец углерода (который может быть алмазом, графитом и т. Д. Или смесью) будет называться углеродом.
Конкретный аллотроп
Молекулярный
- О2 дикислород (допустимое название кислород)
- О3 триоксиген (допустимое название озон)
- п4 тетрафосфор (допустимое название белый фосфор)
- S6 гексасера (допустимое название ε-сера)
- S8 циклооктасера (допустимые названия полиморфных форм: α-сера, β-сера, γ-сера)
Кристаллическая форма
Это определяется символом элемента, за которым следует Символ Пирсона для кристаллической формы. (Обратите внимание, что в рекомендациях второй символ выделен курсивом.)
- Cп углерод (cF8) (приемлемое название ромб)
- Snп олово (тя4) (допустимое название β- или белое олово)
- Mnп марганец (ся58) (допустимое название α-марганец)
Аморфные распознанные аллотропы
Примеры включают Pп,. красный фосфор; В качествеп, аморфный мышьяк.
Соединения
Композиционные названия несут мало структурной информации и рекомендуются для использования, когда структурная информация недоступна или не требует передачи. Стоихометрические названия являются самыми простыми и отражают либо эмпирическую формулу, либо молекулярную формулу. Порядок элементов соответствует формальному списку электроотрицательностей для бинарных соединений и списку электроотрицательностей, чтобы сгруппировать элементы в два класса, которые затем располагаются в алфавитном порядке. Пропорции указаны ди-, три- и т. Д. (См. Числовой множитель ИЮПАК.) Если известно, что существуют сложные катионы или анионы, они называются сами по себе, а затем эти имена используются как часть имени соединения.
Бинарные соединения
В бинарных соединениях более электроположительный элемент ставится первым в формуле. Используется формальный список. Имя наиболее электроотрицательного элемента изменено на -ide, а имя наиболее электроотрицательного элемента оставлено без изменений.
Если взять бинарное соединение натрия и хлора: хлор находится первым в списке, поэтому в названии идет последним. Другие примеры:
- PCl5 пентахлорид фосфора
- Ca2п3 дикальцийтрифосфид
- NiSn станнид никеля
- Cr23C6 гексакарбид трикозахрома
Тройные соединения и не только
Следующее иллюстрирует принципы.
Четвертичное соединение 1: 1: 1: 1 между бромом, хлором, йодом и фосфором:
- PBrClI бромид фосфора иодид хлорида (фосфор является наиболее электроположительным, все остальные обозначены как электроотрицательные и расположены в алфавитном порядке)
Тройное соединение 2: 1: 5 сурьмы, меди и калия может быть названо двумя способами в зависимости от того, какой элемент (элементы) обозначен как электроотрицательный.
- CuK5Sb2 диантимонид пентакалия меди (и медь, и калий обозначены как электроположительные и расположены в алфавитном порядке)
- K5CuSb2 пентакалий диантимонид куприд (только калий обозначен как электроположительный, а два электроотрицательных элемента расположены в алфавитном порядке) (обратите внимание, что в красной книге этот пример показан неправильно)
Обозначение ионов и радикалов
Катионы
Одноатомные катионы называются, беря имя элемента и после него ставя заряд в скобках, например
- Na+
натрий (1+) - Cr3+
хром (3+)
Иногда необходимо использовать сокращенную форму имени элемента, например гермид для германия, поскольку германид относится к GeH−
3.
Многоатомные катионы одного и того же элемента называются по имени элемента, которому предшествует ди-, три- и др., например:
- Hg2+
2 димеркурий (2+)
Многоатомные катионы, состоящие из различных элементов, называются либо заместительно, либо аддитивно, например:
- PH+
4 фосфан - SbF+
4 тетрафторстибаний (заместитель) или тетрафторидурьма (1+) - Обратите внимание, что аммоний и оксоний являются приемлемыми названиями для NH+
4 и ЧАС
3О+
соответственно. (Hydronium не подходит для ЧАС
3О+
[нужна цитата ])
Анионы
Одноатомные анионы названы как элемент, модифицированный концом -ide. Стоимость указана в скобках (необязательно для 1-), например:
- Cl− хлорид (1-) или хлорид
- S2− сульфид (2-)
Некоторые элементы берут свое латинское имя в качестве корня, например
- серебро, Ag, арджентид
- медь, Cu, куприд
- железо, Fe, феррид
- олово, Sn, станнид
Многоатомные анионы одного и того же элемента называются по имени элемента, которому предшествует ди-, три- и др., например:
- О22− диоксид (2-) (или пероксид в качестве допустимого названия)
- C22− дикарбид (2-) (или ацетилид в качестве допустимого названия)
- S22− дисульфид (2-)
или иногда в качестве альтернативы, производной от замещающего имени, например
- S22− дисульфандиид
Многоатомные анионы, состоящие из различных элементов, называются либо заместительно, либо аддитивно, окончания имен имеют вид -ид и -ат соответственно, например :
- GeH3− германид (заместитель) или тригидридогерманат (1-) (добавка)
- TeH3− заместитель теллануида, где -uide указывает анион, состоящий из дополнительного гидрида, присоединенного к исходному гидриду
- [ПФ6]− гексафтор-λ5-фосфануид (заместитель) или гексафторидофосфат (1-) (добавка)
- ТАК32− триоксидосульфат (2-) (добавка) или сульфит (допустимое несистематическое название)
Полный список альтернативных допустимых несистематических названий катионов и анионов находится в рекомендациях. Многие анионы имеют названия, полученные от неорганических кислот, и они будут рассмотрены позже.
Радикалы
Наличие неспаренных электронов можно обозначить знаком "·". Например:
- Он·+ гелий (·+)
- N2(2·)2+ диазот (2·2+)
Наименование гидратов и подобных соединений решетки
Использование термина гидрат все еще допустимо, например, Na2ТАК4· 10H2О, декагидрат сульфата натрия. Рекомендуемый метод - назвать его сульфатом натрия - вода (1/10). Аналогичным образом другие примеры решетчатых соединений:
- CaCl2· 8NH3, хлорид кальция - аммиак (1/8)
- 2Na2CO3· 3H2О2, карбонат натрия - перекись водорода (2/3)
- AlCl3· 4EtOH, хлорид алюминия - этанол (1/4)
Указание пропорций с использованием заряда или степени окисления
В качестве альтернативы ди-, три- префиксу можно использовать либо заряд, либо степень окисления. Рекомендуется зарядка, так как степень окисления может быть неоднозначной и открытой для обсуждения.
Заместительная номенклатура
Этот метод наименования обычно соответствует установленной органической номенклатуре ИЮПАК. Приведены гидриды элементов основной группы (группы 13–17). -ан базовые имена, например боран, BH3. Приемлемые альтернативные названия для некоторых исходных гидридов - вода, а не оксидан, и аммиак, а не азан. В этих случаях основное название предназначено для использования для замещенных производных.
В этом разделе рекомендаций рассматриваются наименования соединений, содержащих кольца и цепи.
Основные гидриды
| BH3 | боран | CH4 | метан | NH3 | азане (аммиак ) | ЧАС2О | оксидан (воды ) | HF | флюоран (фтороводород ) |
| AlH3 | Alumane | SiH4 | силан | PH3 | фосфан (фосфин ) | ЧАС2S | сульфан (сероводород или сероводород) | HCl | хлоран (хлористый водород ) |
| GaH3 | галлан | GeH4 | немецкий | Пепел3 | арсан (арсин ) | ЧАС2Se | селане (селенид водорода или селенид дигидрогена) | HBr | Bromane (бромистый водород ) |
| Дюйм3 | индиган | SnH4 | Станнане | SbH3 | Стибейн (Стибин ) | ЧАС2Te | теллан (теллурид водорода или теллурид дигидрогена) | ЗДРАВСТВУЙ | йодан (йодистый водород ) |
| TlH3 | таллан | PbH4 | отвес | БиГ3 | висмутан (висмутин ) | ЧАС2По | полейн (полонид водорода или полонид дигидрогена) | Шляпа | Astatane (водородный астатид ) |
Гидриды с нестандартной связью - лямбда-конвенция
Если соединение имеет нестандартные связи по сравнению с исходным гидридом, например PCl5 используется лямбда-соглашение. Например:
- PCl5 пентахлор-λ5-фосфан
- SF6 гексафтор-λ6-сульфан
Полиядерные гидриды
Префикс ди-, три- и т. д. добавляется к имени родительского гидрида. Примеры:
- HOOH, диоксидан (допустимое название - перекись водорода)
- ЧАС2PPH2, дифосфан
- ЧАС3SiSiH2SiH2SiH3, тетрасилан
Кольца и цепочки
Рекомендации описывают три способа присвоения «родительских» названий гомоядерным моноциклическим гидридам (то есть одиночным кольцам, состоящим из одного элемента):
- то Номенклатура Ганча – Видмана (метод предпочтителен для колец размером 3–10)
- «номенклатура замещения скелета» - определение замены атомов углерода в соответствующем углеродном соединении атомами другого элемента (например, кремний становится силой, германием, германием) и мультипликативным префиксом три, тетра, пента и т. д. (метод, предпочтительный для колец больше чем 10)
- добавив префикс цикло на имя соответствующей неразветвленной незамещенной цепи
Гидриды бора
За стехиометрическим названием следует количество атомов водорода в скобках. Например B2ЧАС6, диборан (6). Больше структурной информации можно передать, добавив «структурный дескриптор» близко-, нидо-, арахно-, дефис-, кладо- префиксы.
Существует полностью систематический метод нумерации атомов в кластерах гидрида бора и метод описания положения мостиковых атомов водорода с помощью символа μ.
Металлоорганические соединения основной группы
Для металлоорганических соединений основной группы 13–16 групп рекомендуется использовать замещающую номенклатуру. Примеры:
- AlH2Меня назвали метилалуман
- BiI2Ph по имени дийодо (фенил) висмутан
Для металлоорганических соединений 1–2 групп можно использовать добавку (указывающую на молекулярный агрегат) или композиционное обозначение. Примеры:
- [BeEtH] названный этилгидридобериллий или этанидогидридобериллий.
- [Mg (η5-C5ЧАС5)2] с именем bis (η5-циклопентадиенил) магний или бис (η5-циклопентадиенидо) магний
- Na (CHCH2) этенид натрия (композиционное название)
Однако в рекомендации отмечается, что в будущих проектах по номенклатуре эти соединения будут рассматриваться.
Аддитивная номенклатура
Это название было разработано в основном для координационных соединений, хотя оно может найти более широкое применение. Примеры:
- Si (ОН)4 тетрагидроксидокремний (добавка) или силанететрол (заместитель) (обратите внимание, что кремниевая кислота является приемлемым названием - ортокремний был исключен).
- [CoCl (NH3)5] Cl2 пентаамминхлоридокобальта (2+) хлорид
Рекомендуемый порядок наименования одноядерных соединений
Рекомендации включают блок-схему, которую можно очень кратко резюмировать:
- идентифицировать центральный атом,
- идентифицировать и называть лиганды,
- указать способ координации лигандов, то есть с использованием соглашений каппа и / или эта
- последовательность лигандов
- указать координационную геометрию, т.е. многогранный символ, индекс конфигурации (используя Правила CIP и абсолютная конфигурация для оптически активных соединений.
Имена лигандов
Анионные лиганды
Если имя аниона оканчивается на -ide, то его имя как лиганда изменяется на -o. Например, хлорид-анион Cl− становится хлоридом. В этом отличие от наименования органических соединений и наименования заместителей, где хлор рассматривается как нейтральный, и он становится хлором, как в PCl.3, который можно назвать трихлорфосфаном или трихлоридофосфором как заместительно, так и аддитивно.
Аналогично, если имена анионов оканчиваются на -ite, -ate, тогда имена лигандов будут -ito, -ato.
Нейтральные лиганды
Нейтральные лиганды не меняют названия, за исключением следующих случаев:
- Вода "аква"
- Аммиак, "аммин"
- Окись углерода связана через углерод, «карбонил»
- Окись азота, связанная через азот, «нитрозил»
Примеры названий лигандов
| Формула | имя |
|---|---|
| Cl− | хлоридо |
| CN− | цианидо |
| ЧАС− | гидридо |
| D−или же 2ЧАС− | дейтеридо или [2H] гидридо |
| PhCH2CH2Se− | 2-фенилэтан-1-селенолато |
| MeCOO− | ацетато или этаноато |
| Мне2В качестве− | диметиларсанидо |
| MePH− | метилфосфанидо |
| MeCONH2 | ацетамид (не ацетамидо) |
| MeCONH− | ацетилазанидо или ацетиламидо (не ацетамидо) |
| MeNH2 | метанамин |
| MeNH− | метилазанидо, или метиламидо, или метанаминидо |
| MePH2 | метилфосфан |
| CO | карбонил |
Последовательность и положение лигандов и центральных атомов
Лиганды упорядочены в алфавитном порядке по имени и предшествуют имени центрального атома. Число координирующих лигандов обозначено префиксами ди-, три-, тетра- пента- и т. д. для простых лигандов или бис-, трис-, тетракис- и т.д. для сложных лигандов. Например:
- [CoCl (NH3)5] Cl2 пентаамминхлоридокобальта (3+) хлорид, где аммин (NH3) предшествует хлориду. Имя (имена) центрального атома идут после лигандов. Если имеется более одного центрального атома, ему предшествуют ди-три-, тетра- и т. Д.
- Операционные системы3(CO)12, додекакарбонилтриосмий
Если есть разные центральные атомы, они упорядочены с использованием списка электроотрицательности.
- [ReCo (CO)9] нонакарбонилренийкобальт
Мостиковые лиганды - использование символа μ
Лиганды могут соединять два или более центра. Префикс μ используется для указания мостикового лиганда как в формуле, так и в имени. Например, димерная форма трихлорид алюминия:

- Al2Cl4(мк-Cl)2
- ди-μ-хлоридо-тетрахлоридо-1κ2Cl, 2κ2Cl-диалюминий
Этот пример иллюстрирует порядок мостиковых и немостиковых лигандов одного и того же типа. В формуле мостиковые лиганды следуют за немостиковыми лигандами, тогда как в названии мостиковые лиганды предшествуют немостиковым. Обратите внимание на использование каппа-соглашения, чтобы указать, что на каждый алюминий приходится два концевых хлорида.
Индекс моста
Если существует более двух центров, соединенных мостом, индекс моста добавляется как нижний индекс. Например в основной ацетат бериллия который можно представить себе как тетраэдрическое расположение атомов Be, связанных 6 ацетат-ионами, образующих клетку с центральным оксидным анионом, формула и название следующие:
- [Быть4(μ4-O) (μ-O2CMe)6]
- гексакис (μ-ацетато-κО: κО′) -Μ4-oxido-тетраэдр-тетрабериллий
Μ4 описывает образование мостикового соединения центрального оксидного иона. (Обратите внимание на использование каппа-соглашения для описания образования мостиков ацетат-иона, в котором задействованы оба атома кислорода.) В названии, где лиганд участвует в различных способах образования мостиков, множественное образование мостиков перечислено в порядке убывания сложности, например μ3 мостик перед μ2 мосты.
Каппа, κ, конвенция
Соглашение о каппа используется, чтобы указать, какие атомы лиганда связаны с центральным атомом, и в полиядерных разновидностях, какие атомы, как мостиковые, так и немостиковые, связываются с каким центральным атомом. Для монодентатных лигандов нет двусмысленности в отношении того, какой атом образует связь с центральным атомом. Однако, когда лиганд имеет более одного атома, который может связываться с центральным атомом, соглашение о каппа используется для указания, какие атомы в лиганде образуют связь. Атомарный символ элемента выделен курсивом и ему предшествует каппа, κ. Эти символы помещаются после той части имени лиганда, которая представляет кольцо, цепь и т. Д., Где расположен лиганд. Например:
- пентаамминенитрито-κО-кобальт (III) указывает, что нитритный лиганд связывается через атом кислорода
Если определенным элементом образуется более одной связи из лиганда, числовой надстрочный индекс дает количество. Например:
- аква [(этан-1,2-дийлдинитрило-κ2N,N’) Трис (ацетато-κО) ацетато] кобальтат (1-), анион кобальта, образованный водой и пентадентатом edta, который связан через два атома азота и три атома кислорода. В edta есть две связи от атомов азота, которые обозначены -κ2N,N'. Три связи кислорода обозначены трис (ацетато-κО), где на каждый ацетат приходится одна перевязка.
В полиядерных комплексах использование символа каппа расширяется двумя связанными способами. Во-первых, чтобы указать, какие лигирующие атомы связаны с каким центральным атомом, а во-вторых, для мостикового лиганда, какие центральные атомы задействованы. Центральные атомы необходимо идентифицировать, т.е. присвоить им номера. (Это формально рассматривается в рекомендациях). Чтобы указать, какие лигирующие атомы в лиганде связываются с каким центральным атомом, номера центральных атомов предшествуют символу каппа, а числовой надстрочный индекс указывает количество лигирований, а за ним следует атомный символ. Несколько вхождений разделяются запятыми.
Примеры:
- ди-μ-хлоридо-тетрахлоридо-1κ2Cl, 2κ2Cl-диалюминий, (трихлорид алюминия ).
- тетрахлоридо-1κ2Cl, 2κ2Cl указывает на наличие двух хлоридных лигандов на каждом атоме алюминия.
- декакарбонил-1κ3C, 2κ3C, 3κ4C-ди-μ-гидридо-1: 2κ2ЧАС; 1: 2κ2ЧАС-Triangulo-(3 Операционные системы—Операционные системы), (Декарбонилдигидридотриосмий ).
- декакарбонил-1κ3C, 2κ3C, 3κ4C показывает, что есть три карбонильные группы на двух атомах осмия и четыре на третьем.
- ди-μ-гидридо-1: 2κ2ЧАС; 1: 2κ2ЧАС указывает на наличие двух гидридных мостиков между атомом осмия 1 и атомом осмия 2.
Eta, η, соглашение
Систематизировано использование η для обозначения тактильных ощущений. Использование η1 не рекомендуется. Если описание задействованных атомов неоднозначно, необходимо указать положение атомов. Это иллюстрируется примерами:
- Cr (η6-C6ЧАС6)2, названный bis (η6-бензол) хром, так как все (смежные) атомы в бензольных лигандах участвуют, их положение не нужно указывать
- [(1,2,5,6-η) -циклоокта-1,3,5,7-тетраен] (η5-циклопентадиенил) кобальт, в котором только две (в положениях 1 и 5) из четырех двойных связей связаны с центральным атомом.
Координационная геометрия
Для любого координационного числа выше 2 возможна более чем одна координационная геометрия. Например, четырехкоординатные координационные соединения могут быть тетраэдрическими, квадратными, квадратно-пирамидальными или прямоугольными. В многогранный символ используется для описания геометрии. А индекс конфигурации определяется по положению лигандов и вместе с многогранный символ ставится в начале имени. Например в комплексе (SP-4-3) - (ацетонитрил) дихлорид (пиридин) платина (II) (SP-4-3) в начале названия описывает квадратную плоскую геометрию, координату 4 с индексом конфигурации 3, указывающим положение лигандов вокруг центрального атома. Подробнее см. многогранный символ.
Металлоорганические группы 3–12
Номенклатура присадок обычно рекомендуется для металлоорганических соединений групп 3–12 (переходные металлы и цинк, кадмий и ртуть).
Металлоцены
Следуя из ферроцен - первое сэндвич-соединение с центральным атомом Fe, координированным с двумя параллельными циклопентадиенильными кольцами - широко используются названия соединений с аналогичной структурой, таких как осмоцен и ванадоцен. Рекомендуется, чтобы окончание имени океан следует ограничить соединениями, в которых есть дискретные молекулы бис (η5-циклопентадиенил) металл (и замещенные в кольцо аналоги), где циклопентадиенильные кольца по существу параллельны, а металл находится в d-блоке. Терминология НЕ применяется к соединениям s- или p-блочных элементов, таких как Ba (C5ЧАС5)2 или Sn (C5ЧАС5)2.
Примеры соединений, соответствующих критериям:
- ванадоцен, [V (η5-C5ЧАС5)2]
- хромоцен, [Cr (η5-C5ЧАС5)2]
- кобальтоцен, [Co (η5-C5ЧАС5)2]
- родоцен, [Rh (η5-C5ЧАС5)2]
- никелоцен, [Ni (η5-C5ЧАС5)2]
- рутеноцен, [Ru (η5-C5ЧАС5)2]
- осмоцен, [Os (η5-C5ЧАС5)2]
- манганоцен, [Mn (η5-C5ЧАС5)2]
- реноцен, [Re (η5-C5ЧАС5)2].
Примеры соединений, которые не следует называть металлоценами:
- C10ЧАС10Ti
- [Ti (η5-C5ЧАС5)2Cl2] правильное название дихлоридобис (η5-циклопентадиенил) титан НЕ дихлорид титаноцена
Полиядерные кластерные соединения
Связи металл-металл
В полиядерных соединениях со связями металл-металл они показаны после названия элемента следующим образом: (3 Операционные системы—Операционные системы) в Декарбонилдигидридотриосмий. Пара скобок содержит количество образованных связей (если больше 1), за которым следуют выделенные курсивом атомные символы элемента, разделенные «длинным тире».
Геометрия многоядерного кластера
Геометрия полиядерных кластеров может варьироваться по сложности. Дескриптор, например тетраэдр или дескриптор CEP, например Тд- (13) -Δ4-близко] может быть использован. это определяется сложностью кластера. Ниже приведены некоторые примеры дескрипторов и эквивалентов CEP. (Дескрипторы CEP названы в честь Кейси, Эванса и Пауэлла, которые описали систему.[4]
| количество атомов | дескриптор | Дескриптор CEP |
|---|---|---|
| 3 | Triangulo | |
| 4 | квадро | |
| 4 | тетраэдр | [Тд- (13) -Δ4-близко] |
| 5 | [D3ч- (131) -Δ6-близко] | |
| 6 | октаэдро | [Очас- (141) -Δ8-близко] |
| 6 | трипризмо | |
| 8 | антипризмо | |
| 8 | додекаэдро | [D2d- (2222) -Δ6-близко] |
| 12 | икосаэдро | [ячас- (1551) -Δ20-близко] |
Примеры:
декарбонилдимарганец 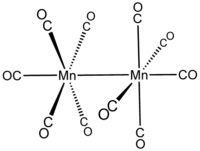 бис (пентакарбонилмарганец) (Mn—Mn)
бис (пентакарбонилмарганец) (Mn—Mn)
додекакарбонилтетрародий 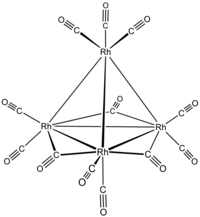 три-μ-карбонил-1: 2κ2C; 1: 3κ2C; 2: 3κ2C-нонакарбонил-1κ2C, 2κ2C, 3κ2C, 4κ3C-[Тd- (13) -Δ4-близко] -тетрародий (6 Rh—Rh)
три-μ-карбонил-1: 2κ2C; 1: 3κ2C; 2: 3κ2C-нонакарбонил-1κ2C, 2κ2C, 3κ2C, 4κ3C-[Тd- (13) -Δ4-близко] -тетрародий (6 Rh—Rh)
или три-μ-карбонил-1: 2κ2C; 1: 3κ2C; 2: 3κ2C-нонакарбонил-1κ2C, 2κ2C, 3κ2C, 4κ3C-тетраэдро-тетрародий (6 Rh—Rh)
Неорганические кислоты
Имена водорода
Рекомендации включают описание водородных названий кислот. Следующие примеры иллюстрируют этот метод:
- HNO3 водород (нитрат)
- ЧАС2ТАК4 дигидроген (сульфат)
- HSO4− водород (сульфат) (2-)
- ЧАС2S дигидроген (сульфид)
Обратите внимание, что отличие от метода композиционного наименования (сероводород), так как при обозначении водорода НЕТ пространства между электроположительными и электроотрицательными компонентами.
Этот метод не дает структурной информации о положении гидронов (атомов водорода). Если эта информация должна быть передана, следует использовать название добавки (примеры см. В списке ниже).
Список допустимых имен
В рекомендациях дается полный список допустимых названий для обычных кислот и родственных анионов. Выбор из этого списка показан ниже.
| кислотно приемлемое название | родственные анионы - допустимые названия и добавочные названия | ||
|---|---|---|---|
| борная кислота, [B (OH)3] | дигидрогенборат, [BO (OH)2]− дигидроксидооксидоборат (1-) | гидроборат, [BO2(ОЙ)]2− гидроксидодиоксидоборат (2-) | борат, [BO3]3− триоксидоборат (3-) |
| угольная кислота, [CO (OH)2] | гидрокарбонат, [CO2(ОЙ)]− гидроксидодиоксидокарбонат (1-) | карбонат, [CO3]2− триоксидокарбонат (2-) | |
| хлорная кислота, [ClO2(ОЙ)] гидроксидодиоксидохлор | хлорат, [ClO3]− триоксидохлорат (1-) | ||
| хлористая кислота, [ClO (OH)] гидроксидооксидохлор | хлорит, [ClO2]− диоксидохлорат (1-) | ||
| азотная кислота, [НЕТ2(ОЙ)] гидроксидодиоксид азота | нитрат, [НЕТ3−] триоксидонитрат (1-) | ||
| азотистая кислота, [NO (OH)] гидроксидооксид азота | нитрит, [NO2]− диоксидонитрат (1-) | ||
| хлорная кислота, [ClO3(ОЙ)] гидроксидотриоксидохлор | перхлорат, [ClO4]− тетраоксидохлорат (1-) | ||
| фосфорная кислота, [PO (OH)3] тригидроксидооксидофосфор | дигидрофосфат, [PO2(ОЙ)2]− дигидроксидодиоксидофосфат (1-) | гидрофосфат, [PO3(ОЙ)]2− гидроксидотриоксидофосфат (2-) | фосфат, [PO4]3− тетраоксидофосфат (3-) |
| фосфоновая кислота, [PHO (OH)2] гидридодигидроксидооксидофосфор | гидрофосфонат, [PHO2(ОЙ)]− гидридогидроксидодиоксидофосфат (1-) | фосфонат, [PHO3]2− гидридотриоксидофосфат (2-) | |
| фосфористая кислота, H3PO3 тригидроксидофосфор | дигидрогенфосфит [PO (OH)2]− дигидроксидооксидофосфат (1-)) | гидрофосфит, [ПО2(ОЙ)]2− гидроксидодиоксидофосфат (2-) | фосфит, [ПО3]3− триоксидофосфат (3-) |
| серная кислота, [SO2(ОЙ)2] дигидроксидодиоксидосера | гидросульфат, [SO3(ОЙ)]− гидроксидотриоксидосульфат (1-) | сульфат, [SO4]2− тетраоксидосульфат (2-) | |
Твердые тела
Стехиометрические фазы названы композиционно. Нестехиометрические фазы сложнее. По возможности следует использовать формулы, но при необходимости можно использовать следующие наименования:
- сульфид железа (II) (дефицит железа)
- дикарбид молибдена (избыток углерода)
Минеральные названия
Обычно названия минералов не должны использоваться для указания химического состава. Однако название минерала можно использовать для указания типа структуры в формуле, например
- BaTiO3 (тип перовскита)
Примерные формулы и вариативный состав
Простое обозначение может использоваться там, где мало информации о механизме изменчивости либо доступно, либо ее не требуется передавать:
- ~ FeS (приблизительно или приблизительно)
Если имеется непрерывный диапазон состава, это может быть записано, например, K (Br, Cl) для смеси KBr и KCl и (Li2, Mg) Cl2 для смеси LiCl и MgCl2Рекомендуется использовать следующий обобщенный метод, например
- CuИксNi1-х для (Cu, Ni)
- KBrИксCl1-х для K (Br, Cl)
Отметим, что катионные вакансии в CoO могут быть описаны CoO1-х
Обозначения точечных дефектов (Крегера – Винка)
Точечные дефекты, симметрия площадки и ее занятость можно описать с помощью Обозначения Крегера – Винка, обратите внимание, что IUPAC предпочитает, чтобы вакансии указывались V а не V (элемент ванадий).
Номенклатура фаз
Чтобы указать кристаллическую форму соединения или элемента, Символ Пирсона может быть использовано. Использование Strukturbericht (например, A1 и т. д.) или греческие буквы не принимаются. За символом Пирсона могут следовать пробел и формула прототипа. Примеры:
- углерод (cF 8), алмаз
- RuAl (CP22, PM3m) (CsCl тип)
Полиморфизм
Рекомендуется идентифицировать полиморфы (например, для ZnS, где две формы образуют цинковую обманку (кубическую) и вюрцит (гексагональную)) как ZnS (c) и ZnS (час) соответственно.
Примечания и ссылки
- ^ Номенклатура рекомендаций ИЮПАК по неорганической химии Издание 2005 г. Н. Г. Коннелли и др. RSC Publishing http://www.chem.qmul.ac.uk/iupac/bioinorg/
- ^ Номенклатура неорганической химии Рекомендации ИЮПАК 2005 г. - Полный текст (PDF)
- ^ Поправки к номенклатуре неорганической химии: Рекомендации ИЮПАК 2005 г.
- ^ «Система дескрипторов и принципы нумерации замкнутых многогранников бора по крайней мере с одной осью симметрии вращения и одной плоскостью симметрии». Кейси Дж. Б., Эванс В. Дж., Пауэлл В. Х. Неорг. Chem., 20, 5,(1981), 1333–1341 Дои:10.1021 / ic50219a001
