Фосфин - Phosphine
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Фосфан | |||
| Другие имена Фосфамин Тригидрид фосфора Фосфорированный водород | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.029.328 | ||
| Номер ЕС |
| ||
| 287 | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 2199 | ||
| |||
| Характеристики | |||
| PH3 | |||
| Молярная масса | 33.99758 г / моль | ||
| Внешность | Бесцветный газ | ||
| Запах | как рыба или чеснок[1] | ||
| Плотность | 1.379 г / л, газ (25 ° C) | ||
| Температура плавления | -132,8 ° С (-207,0 ° F, 140,3 К) | ||
| Точка кипения | -87,7 ° С (-125,9 ° F, 185,5 К) | ||
| 31.2 мг / 100 мл (17 ° C) | |||
| Растворимость | Растворим в спирте, эфир, CS2 слабо растворим в бензол, хлороформ, этиловый спирт | ||
| Конъюгированная кислота | Фосфоний (химическая формула PH+ 4) | ||
| 2.144 | |||
| Вязкость | 1.1×10−5 Pas | ||
| Структура | |||
| Тригонально-пирамидальный | |||
| 0.58 D | |||
| Термохимия | |||
Теплоемкость (C) | 37 Дж / моль⋅К | ||
Стандартный моляр энтропия (S | 210 Дж / моль⋅К[2] | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | 5 кДж / моль[2] | ||
Свободная энергия Гиббса (Δжграмм˚) | 13 кДж / моль | ||
| Опасности | |||
| Паспорт безопасности | ICSC 0694 | ||
| Пиктограммы GHS |     | ||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | Горючий газ | ||
| 38 ° С (100 ° F, 311 К) (см. текст) | |||
| Пределы взрываемости | 1.79–98%[1] | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 3.03 мг / кг (крыса, перорально) | ||
LC50 (средняя концентрация ) | 11 промилле (крыса, 4 час)[3] | ||
LCLo (самый низкий опубликованный ) | 1000 промилле (млекопитающее, 5 мин) 270 промилле (мышь, 2 час) 100 промилле (морская свинка, 4 час) 50 промилле (кот, 2 час) 2500 промилле (кролик, 20 мин) 1000 промилле (человек, 5 мин)[3] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 0,3 частей на миллион (0,4 мг / м3)[1] | ||
REL (Рекомендуемые) | TWA 0,3 частей на миллион (0,4 мг / м3), ST 1 частей на миллион (1 мг / м3)[1] | ||
IDLH (Непосредственная опасность) | 50 промилле[1] | ||
| Родственные соединения | |||
Другой катионы | |||
Родственные соединения | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Фосфин (ИЮПАК имя: фосфан) представляет собой бесцветное, легковоспламеняющееся, очень токсичное газовое соединение с химическая формула PH3, классифицируется как гидрид пниктогена. Чистый фосфин без запаха, но технический сорт образцы имеют очень неприятный запах как гниющая рыба, из-за наличия заменен фосфин и дифосфан (П2ЧАС4). Со следами P2ЧАС4 присутствует, PH3 самопроизвольно воспламеняется на воздухе (пирофорный ), горящий светящимся пламенем.
Фосфин - это также общее название класса фосфорорганические соединения замещенных фосфанов - класс фосфанов, в которых атомы водорода заменены на органическое производное, имеющую общую формулу PR3. Органофосфины важны для катализаторы где они образуют комплекс (сцепляются) с ионами различных металлов; комплексы, полученные из хиральный фосфин может катализировать реакции с образованием хиральный, обогащенный товары.
История
Филипп Женжембр (1764–1838), ученик Лавуазье, впервые получил фосфин в 1783 году при нагревании белый фосфор в водном растворе поташ (карбонат калия).[4][NB 1]
Возможно, из-за его сильной связи с элементалью фосфор, фосфин когда-то считался газообразной формой элемента, но Лавуазье (1789) распознал его как комбинацию фосфора с водородом и описал как фосфор д'гидроген (фосфид водорода).[NB 2]
В 1844 году Поль Тенар, сын французского химика Луи Жак Тенар, использовал холодная ловушка для отделения дифосфина от фосфина, который был образован из фосфид кальция, тем самым демонстрируя, что P2ЧАС4 отвечает за спонтанное воспламенение, связанное с PH3, а также для характерного оранжевого / коричневого цвета, который может образовываться на поверхностях, который является продуктом полимеризации.[5] Он считал формулу дифосфина PH2, и, таким образом, промежуточное звено между элементарным фосфором, высшими полимерами и фосфином. Фосфид кальция (номинально Ca3п2) производит больше P2ЧАС4 по сравнению с другими фосфидами из-за преобладания связей Р-Р в исходном материале.
Название «фосфин» впервые было использовано для фосфорорганических соединений в 1857 году, будучи аналогом органических соединений. амины (NR3).[NB 3][6] Газовый PH3 к 1865 г. (или ранее) получил название «фосфин».[7]
Структура и свойства
PH3 это тригонально-пирамидальный молекула с C3v молекулярная симметрия. В длина связи P − H составляет 1,42Å, H − P − H валентные углы 93,5°. В дипольный момент составляет 0,58 Д, которая увеличивается с увеличением замена из метильные группы в серии: CH3PH2, 1,10 D; (CH3)2PH 1,23 D; (CH3)3P, 1,19 D. Напротив, дипольные моменты аминов уменьшаются при замещении, начиная с аммиак, имеющий дипольный момент 1,47 D. Низкий дипольный момент и почти ортогональные валентные углы позволяют сделать вывод, что в PH3 связи P − H почти полностью pσ (P) - sσ (H) и 3s орбиталь фосфора мало способствует связыванию фосфора и водорода в этой молекуле. По этой причине неподеленную пару на фосфоре можно рассматривать как преимущественно образованную 3s-орбиталью фосфора. Сильный химический сдвиг атома фосфора в 31P ЯМР спектр согласуется с выводом о том, что электроны неподеленной пары занимают 3s-орбиталь (Fluck, 1973). Эта электронная структура приводит к отсутствию нуклеофильность в целом и отсутствие основности в частности (стр.Kах = –14),[8] а также способность формировать только слабые водородные связи.[9]
Водный растворимость PH3 легкий; 0,22 см3 газа растворяется в 1 см3 воды. Фосфин легче растворяется в неполярные растворители чем в воде из-за неполярных связей P-H. Это технически амфотерный в воде, но активность кислот и оснований низкая. Обмен протонов происходит через фосфоний (PH+
4) ион в кислых растворах и через фосфанид (PH−
2) при высоком pH, с константами равновесия Kб = 4×10−28 и Kа = 41.6×10−29.
Фосфиновые ожоги с образованием плотного белого облака фосфорная кислота:
- PH3 + 2 O2 → H3PO4
Подготовка и возникновение
Фосфин можно получить разными способами.[10] Промышленно это может быть произведено реакцией белого фосфор с натрий или же гидроксид калия, производя калий или же гипофосфит натрия как побочный продукт.
- 3 КОН + П4 + 3 часа2O → 3 KH2PO2 + PH3
В качестве альтернативы катализируемый кислотой непропорциональность белого фосфор дает фосфорная кислота и фосфин. Оба маршрута имеют промышленное значение; кислотный путь является предпочтительным методом, если необходима дальнейшая реакция фосфина на замещенные фосфины. Кислотный путь требует очистки и повышения давления. Его также можно получить (как описано выше) путем гидролиза фосфида металла, такого как фосфид алюминия или же фосфид кальция. Чистые образцы фосфина, не содержащие P2ЧАС4, могут быть приготовлены с помощью действия гидроксид калия на иодид фосфония (PH4Я).
Лабораторные маршруты
Готовится в лаборатории путем диспропорционирования фосфористая кислота[11]
- 4 ч3PO3 → PH3 + 3 часа3PO4
Выделение фосфина происходит при температуре около 200 ° C. Альтернативные методы включают гидролиз фосфид алюминия, фосфид кальция, и трис (триметилсилил) фосфин.
Вхождение
Фосфин входит в состав атмосферы Земли в очень низких и очень изменчивых концентрациях.[12] Это может внести значительный вклад в глобальный биохимический цикл фосфора. Наиболее вероятный источник снижение из фосфат в разлагающемся органическом веществе, возможно, за счет частичного восстановления и диспропорции, поскольку экологические системы не имеют известных восстановителей, обладающих достаточной силой для прямого превращения фосфата в фосфин.[13]
Он также встречается в Юпитер турбулентная атмосфера, когда она образуется в горячих недрах планеты и вступает в реакцию с другими соединениями в верхних слоях атмосферы.[14] Абиотический синтез фосфина требует огромных затрат энергии, как, например, в конвективных штормах газовых гигантов размером с планету.[15]
Возможная внеземная биосигнатура
Фосфин также был обнаружен в умеренной зоне Венера' атмосфере (приблизительно 50 км (31 миль) над уровнем моря) на высоте 20ppb, концентрация, которая невозможна с помощью известных химических процессов.[16] Венере не хватает высоких температур и давлений для образования фосфина. газовые гиганты такие как Юпитер; таким образом, требуется другое объяснение его присутствия.[17] Не ожидается, что фосфин сохранится в атмосфере Венеры, поскольку он подвержен ультрафиолетовый радиация, в конечном итоге она будет поглощена водой и углекислым газом; таким образом, его необходимо пополнить. В документе, объявляющем об открытии, предполагается, что фосфин «мог происходить из неизвестной фотохимии или геохимии, или, по аналогии с биологическим производством PH3 на Земле, от присутствия жизни ».[16][17][18] По этой причине предлагается использовать фосфин. биоподпись за астробиология. PH3 связан с анаэробный экосистемы на Земле, что может свидетельствовать о жизни на бескислородных экзопланетах. По состоянию на 2020 год[Обновить], не известно абиотический процесс вырабатывает фосфин на планетах земной группы в заметных количествах, поэтому обнаруживаемые количества фосфина могут указывать на наличие жизни. В частности, согласно оригинальному исследованию: «Фосфин является многообещающим биосигнатурным газом, поскольку он не имеет известных абиотических ложных срабатываний на планетах земной группы из любого источника, который мог бы генерировать высокие потоки, необходимые для обнаружения».[19][20][21]
Фосфины
Органофосфины - это соединения формулы PRпЧАС3−п. Эти соединения часто классифицируют по значению п: первичные фосфины (п = 1), вторичные фосфины (п = 2), третичные фосфины (п = 3). Все имеют пирамидальную структуру. Их реакционная способность также аналогична - они могут окисляться до уровня фосфора (V), они могут протонироваться и алкилироваться по фосфору с образованием соли фосфония, а для первичных и вторичных производных они могут быть депротонированы сильными основаниями с образованием органофосфид производные.
Первичные фосфины
Первичные фосфины обычно получают алкилированием фосфина. Простые алкильные производные, такие как метилфосфин (CH3PH2) получают алкилированием производных щелочных металлов MPH2 (M есть Ли, Na, или же K ). Другой путь синтеза включает обработку соответствующих хлорфосфинов гидридными реагентами. Например, сокращение дихлорфенилфосфин с литийалюминийгидрид дает фенилфосфин (PhPH2).
Вторичные фосфины
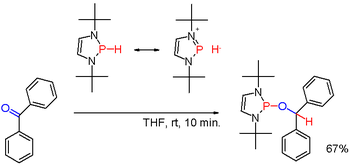
Вторичные фосфины получают аналогично первичным фосфинам. Их также получают восстановительным расщеплением триарилфосфинов щелочными металлами с последующим гидролизом образовавшейся фосфидной соли. Последний путь используется для подготовки дифенилфосфин (Ph2PH). Диорганофосфиновые кислоты, R2P (O) OH, также можно восстановить с помощью гидрид диизобутилалюминия. Вторичные фосфины обычно имеют протонный характер. Но при модификации подходящими заместителями, как в некоторых (редко) диазафосфолены (схема 3), полярность связи P-H может быть инвертирована (см .: умполунг ) и образующийся фосфин гидрид может восстановить карбонильную группу, как в примере бензофенон еще одним способом.[22]
Третичные фосфины
Третичные фосфины обычно получают обработкой трихлорид фосфора или же трифенилфосфит с литийорганические реагенты или же Реактивы Гриньяра. Они обычно используются как лиганды по координационной химии. Третичные фосфины типа PRR'R ″ представляют собой "п-хиральный "и оптически стабильный.
Циклические фосфины
Вторичные и третичные фосфины встречаются в циклических формах. Трехчленные кольца фосфираны (ненасыщенный: фосфирены ) пятичленные кольца фосфоланы (ненасыщенный: фосфол ), а шестичленные - фосфинаны.
Приложения
Фосфорорганическая химия
Фосфин является предшественником многих фосфорорганические соединения. Реагирует с формальдегидом в присутствии хлористый водород давать тетракис (гидроксиметил) фосфоний хлорид, который используется в текстиле. В гидрофосфинирование алкенов - это универсальный путь к множеству фосфинов. Например, в присутствии основных катализаторов PH3 добавляет Майкл акцепторы Такие как акрилонитрил:[23]
- PH3 + 3 канала2= CHZ → P (CH2CH2Z)3 (Z - НЕТ2, CN или C (O) NH2)
Кислотный катализ применим к гидрофосфинированию с изобутилен и родственные аналоги:
- PH3 + R2C = CH2 → R2(CH3) CPH2 (R представляет собой Me, алкил и т. Д.)
Микроэлектроника
Фосфин используется как присадка в полупроводник промышленность, и прекурсор для осаждения составные полупроводники. Коммерчески значимые продукты включают фосфид галлия и фосфид индия.[24]
Фумигант
За сельскохозяйственное использование, гранулы фосфид алюминия, фосфид кальция, или же фосфид цинка высвобождает фосфин при контакте с атмосферной водой или кислотой желудка грызунов. Эти гранулы также содержат агенты, снижающие вероятность зажигание или же взрыв высвободившегося фосфина. Более свежей альтернативой является использование самого газообразного фосфина, который требует разбавления либо CO2 или N2 или даже воздух, чтобы довести его до температуры ниже точки воспламенения. Использование газа позволяет избежать проблем, связанных с твердыми остатками фосфида металла, и приводит к более быстрой и эффективной борьбе с целевыми вредителями.
Потому что ранее популярные фумигант бромистый метил был прекращен в некоторых странах в соответствии с Монреальский протокол, фосфин - единственный широко используемый, экономичный, быстродействующий фумигант, который не оставляет остатков на хранящемся продукте. Вредители с высоким уровнем сопротивление по отношению к фосфину стали обычным явлением в Азии, Австралии и Бразилии. Высокий уровень резистентности также может возникать в других регионах, но это не так тщательно отслеживается. Генетические варианты, которые способствуют высокому уровню устойчивости к фосфину, были идентифицированы в дигидролипоамиддегидрогеназа ген.[25] Идентификация этого гена теперь позволяет быстро идентифицировать устойчивых насекомых на молекулярном уровне.
Безопасность
Газообразный фосфин более плотный, чем воздух, и, следовательно, может собираться в низинах. Он может образовывать взрывоопасные смеси с воздухом, а также может самовоспламеняться.
Фосфин может всасываться в организм при вдыхании. Прямой контакт с жидкостью фосфина - хотя и маловероятен - может вызвать обморожение, как и другие криогенные жидкости. Основным органом-мишенью газообразного фосфина являются дыхательные пути.[26] По данным США 2009 г. Национальный институт охраны труда и здоровья (NIOSH) карманный справочник и США Управление по охране труда (OSHA), среднее 8-часовое воздействие на дыхательные пути не должно превышать 0,3 ppm. NIOSH рекомендует, чтобы кратковременное воздействие на дыхательные пути газообразного фосфина не превышало 1 ppm. В Немедленно опасно для жизни или здоровья уровень составляет 50 промилле. Чрезмерное воздействие газообразного фосфина вызывает тошноту, рвоту, боли в животе, диарею, жажду, стеснение в груди, одышка (затрудненное дыхание), мышечная боль, озноб, ступор или обморок и отек легких.[27][28] Сообщалось, что фосфин имеет запах разлагающейся рыбы или чеснока при концентрациях ниже 0,3 ppm. Запах обычно ограничен лабораторными помещениями или производством фосфина, поскольку запах исходит от способа извлечения фосфина из окружающей среды. Однако это может произойти и в другом месте, например, на полигонах промышленных отходов. Воздействие более высоких концентраций может вызвать обонятельная усталость.[29]
Токсичность
Смерть наступила в результате случайного воздействия фумигационных материалов, содержащих фосфид алюминия или фосфин.[30][31][32][33] Может поглощаться либо вдыхание или же трансдермально.[30] Как респираторный яд, он влияет на транспорт кислорода или препятствует его использованию различными клетками организма.[32] Экспозиция приводит к отек легких (легкие наполняются жидкостью).[33] Газ фосфин тяжелее воздуха, поэтому остается ближе к полу. [34]
Фосфин, по-видимому, в основном является редокс-токсином, вызывающим повреждение клеток, вызывая окислительный стресс и дисфункцию митохондрий.[35] Устойчивость у насекомых вызвана мутацией митохондриального метаболического гена.[25]
Смотрите также
- Дифосфан, H2PPH2, упрощенное до H4п2
- Дифосфины, Р2PPR2, Р2P (CH2)пPR2
- Дифосфен, HP = PH
- Дифосфены, RP = PR ′
- Оксид фосфина, Р3P = O
- Фосфоран, PR5, Р3P = CR2
- Фосфинит, P (ИЛИ) R2
- Фосфонит, P (ИЛИ)2р
- Фосфит, P (ИЛИ)3
- Фосфинат, Р2P (RO) O
- Фосфонат, RP (RO)2О
- Фосфат, P (RO)3О
Примечания
- ^ Для получения дополнительной информации о ранней истории фосфина см .:
- Британская энциклопедия (Издание 1911 г.), т. 21, стр. 480: Фосфор: фосфин.
- Томас Томсон, Система химии, 6 изд. (Лондон, Англия: Болдуин, Крэдок и Джой, 1820 г.), т. 1, п. 272.
- ^ Примечание:
- На стр. 222 его Traité élémentaire de chimie, т. 1 (Париж, Франция: Кюше, 1789 г.) Лавуазье называет соединение фосфора и водорода "фосфор д'гидроген" (фосфид водорода). Тем не мение, на стр. 216, он называет соединение водорода и фосфора "Combinaison inconnue". (комбинация неизвестна), но в сноске он говорит о реакциях водорода с серой и фосфором: "Ces combinaisons ont lieu dans l'état de gaz & il en résulte du gaz hydrogène sulfurisé & phosphorisé". (Эти комбинации встречаются в газообразном состоянии, и из них образуется сернистый и фосфорный газообразный водород.)
- В английском переводе Роберта Керра романа Лавуазье 1790 г. Traité élémentaire de chimie … - а именно, Лавуазье с Робертом Керром, пер., Элементы химии … (Эдинбург, Шотландия: Уильям Крич, 1790) - Керр переводит Лавуазье "фосфор д'гидроген" как «фосфор водорода» (п. 204 ), а Лавуазье - на стр. 216 его Traité élémentaire de chimie … - не дал названия комбинации водорода и фосфора, Керр называет ее «гидрурет фосфора или фосфор водорода» (п. 198 ). Замечание Лавуазье об этом соединении: "Combinaison inconnue". - переводится: «доселе неизвестно». Сноска Лавуазье переводится как: «Эти комбинации происходят в состоянии газа и образуют, соответственно, сернистый и фосфорированный кислородный газ». Слово «кислород» в переводе - ошибка, потому что в исходном тексте четко написано: «гидроген» (водород). (Ошибка была исправлена в последующих выпусках.)
- ^ В 1857 г. Август Вильгельм фон Хофманн объявил о синтезе органических соединений, содержащих фосфор, который он назвал "триметилфосфин " и "триэтилфосфин »по аналогии с« амином »(азоторганические соединения),« арсином »(мышьяковоорганические соединения) и« стибином »(сурьмоорганические соединения).
Рекомендации
- ^ а б c d е ж Карманный справочник NIOSH по химической опасности. "#0505". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б Зумдал, Стивен С. (2009). Химические принципы (6-е изд.). Хоутон Миффлин. п. A22. ISBN 978-0-618-94690-7.
- ^ а б «Фосфин». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Генджембр (1783) "Mémoire sur un nouveau gas obtenu, par l'action des elements alkalines, sur le phosphore de Kunckel" (Воспоминание о новом газе, полученном действием щелочных веществ на фосфор Кункеля), Mémoires de mathématique et de Physique, 10 : 651–658.
- ^ Поль Тенар (1844) «Память о комбинациях фосфора с гидрогеном» (Воспоминание о соединениях фосфора с водородом), Comptes rendus, 18 : 652–655.
- ^ A.W. Хофманн; Огюст Каур (1857). «Исследования по фосфорным основаниям». Труды Лондонского королевского общества (8): 523–527.
(Со страницы 524:) Базы Me3P и E3P, продукты этой реакции, которые мы предлагаем назвать соответственно триметилфосфином и триэтилфосфином,…
- ^ Уильям Одлинг, Курс практической химии для студентов-медиков, 2-е изд. (Лондон, Англия: Longmans, Green, and Co., 1865), стр.227, 230.
- ^ Штрейтвизер, Эндрю; Heathcock, Clayton H .; Косовер, Эдвард М. (2017). Введение в органическую химию. Нью-Дели: Medtech (Scientific International, переиздание исправленного 4-го издания, Macmillan, 1998). п. 828. ISBN 9789385998898.
- ^ Сенников, П. Г. (1994). "Слабое H-соединение вторым рядом (PH3, H2S) и третий ряд (AsH3, H2Se) Гидриды ». Журнал физической химии. 98 (19): 4973–4981. Дои:10.1021 / j100070a006.
- ^ Той, А. Д. Ф. (1973). Химия фосфора. Оксфорд, Великобритания: Pergamon Press.
- ^ Gokhale, S.D .; Джолли, У. Л., «Фосфин», Inorganic Syntheses, 1967, том 9, стр. 56–58. Дои:10.1002 / 9780470132401.ch17
- ^ Gassmann, G .; van Beusekom, J.E.E .; Глиндеманн, Д. (1996). «Морской атмосферный фосфин». Naturwissenschaften. 83 (3): 129–131. Bibcode:1996NW ..... 83..129G. Дои:10.1007 / BF01142178. S2CID 39778453.
- ^ Roels, J .; Verstraete, W. (2001). «Биологическое образование летучих соединений фосфора, обзорная статья». Биоресурсные технологии. 79 (3): 243–250. Дои:10.1016 / S0960-8524 (01) 00032-3. PMID 11499578.
- ^ Каплан, Сара (11 июля 2016 г.). «Первые водяные облака обнаружены за пределами нашей солнечной системы - вокруг потерпевшей неудачу звезды». Вашингтон Пост. Получено 14 сентября 2020.
- ^ Чу, Дженнифер (18 декабря 2019 г.). «Знак того, что инопланетяне могут вонять». Новости MIT. Получено 14 сентября 2020.
- ^ а б Greaves, J.S .; Richards, A.M.S .; Bains, W .; и другие. (2020). «Фосфин в облачных облаках Венеры». Природа Астрономия. arXiv:2009.06593. Дои:10.1038 / с41550-020-1174-4. S2CID 221655755. Получено 14 сентября 2020.
- ^ а б Стирон, Шеннон; Чанг, Кеннет; Овербай, Деннис (14 сентября 2020 г.). "Жизнь на Венере? Астрономы видят сигнал в ее облаках". Нью-Йорк Таймс. Получено 14 сентября 2020.
- ^ Дрейк, Надя (14 сентября 2020 г.). «Возможный признак жизни на Венере вызывает жаркие споры». Национальная география. Получено 14 сентября 2020.
- ^ Соуза-Сильва, Клара; Сигер, Сара; Ранджан, Сукрит; Петковски, Януш Юранд; Чжан, Чжучан; Ху, Рэнью; Бейнс, Уильям (11 октября 2019 г.). «Фосфин как биосигнатурный газ в атмосферах экзопланет». Астробиология (опубликовано в феврале 2020 г.). 20 (2): 235–268. arXiv:1910.05224. Bibcode:2020AsBio..20..235S. Дои:10.1089 / аст.2018.1954. PMID 31755740. S2CID 204401807.
- ^ Чу, Дженнифер (18 декабря 2019 г.). «Знак того, что инопланетяне могут вонять». MIT News.
- ^ «Фосфин может сигнализировать о существовании инопланетной анаэробной жизни на скалистых планетах». Научные новости. 26 декабря 2019.
- ^ Burck, S .; Гудат, Д .; Nieger, M .; Du Mont, W.-W. (2006). "п-Замещенные водородом 1,3,2-диазафосфолены: молекулярные гидриды ». Журнал Американского химического общества. 128 (12): 3946–3955. Дои:10.1021 / ja057827j. PMID 16551102.
- ^ Трофимов, Борис А .; Арбузова, Светлана Н .; Гусарова, Нина К. (1999). «Фосфин в синтезе фосфорорганических соединений». Российские химические обзоры. 68 (3): 215–227. Bibcode:1999RuCRv..68..215T. Дои:10.1070 / RC1999v068n03ABEH000464.
- ^ Bettermann, G .; Krause, W .; Riess, G .; Хофманн, Т. (2002). «Соединения фосфора неорганические». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a19_527.
- ^ а б Schlipalius, D. I .; Valmas, N .; Tuck, A. G .; Jagadeesan, R .; Ma, L .; Kaur, R .; и другие. (2012). «Основной метаболический фермент опосредует устойчивость к газу фосфина». Наука. 338 (6108): 807–810. Bibcode:2012Sci ... 338..807S. Дои:10.1126 / наука.1224951. PMID 23139334. S2CID 10390339.
- ^ «Карта экстренного реагирования NIOSH». CDC. Получено 6 апреля 2010.
- ^ "Карманный справочник NIOSH". CDC.3 февраля 2009 г.. Получено 6 апреля 2010.
- ^ «ВОЗ - Таблицы данных по пестицидам - № 46: Фосфин». Inchem.org. Архивировано из оригинал 18 февраля 2010 г.. Получено 6 апреля 2010.
- ^ «Предупреждение NIOSH: предотвращение отравления фосфином и взрывов во время фумигации». CDC. 10 июля 1995 г.. Получено 6 апреля 2010.
- ^ а б Идо Эфрати; Нир Хассон (22 января 2014 г.). «Двое малышей умирают после того, как дом в Иерусалиме опрыскали от вредителей». Гаарец. Получено 23 января 2014.
- ^ "Семья Алькала-де-Гуадаира Мурио трас иньялар фосфина де унос тапонес". RTVE.es (на испанском). Radio y Televisión Española. EFE. 3 февраля 2014 г.
- ^ а б Юлия Сислер (13 марта 2014 г.). «Смерть женщин из Квебека в Таиланде могла быть вызвана пестицидами». CBC News.
- ^ а б Эми Би Ван (3 января 2017 г.). «4 ребенка погибли после того, как пестициды выпустили токсичный газ под их домом, - сообщает полиция». Вашингтон Пост. Получено 6 января 2017.
- ^ «Пестицид виноват в смерти 8-месячного ребенка в Форт-Мак-Мюррей». CBC News. 23 февраля 2015 г.. Получено 23 февраля 2015.
- ^ Нат, NS; Бхаттачарья, я; Tuck, AG; Schlipalius, DI; Эберт, PR (2011). «Механизмы токсичности фосфина». Журнал токсикологии. 2011: 494168. Дои:10.1155/2011/494168. ЧВК 3135219. PMID 21776261.
дальнейшее чтение
- Флак, Э. (1973). «Химия фосфина». Темы современной химии. Fortschritte der Chemischen Forschung. 35: 1–64. Дои:10.1007 / BFb0051358. ISBN 3-540-06080-4.
- Всемирная организация здравоохранения (1988 г.). Фосфин и отдельные фосфиды металлов. Критерии гигиены окружающей среды. 73. Женева: Совместное спонсорство ЮНЕП, МОТ и ВОЗ.











