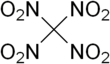Тетранитрометан - Tetranitromethane
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Тетранитрометан | |||
| Другие имена TNM Тетан | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.007.359 | ||
| КЕГГ | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1510 | ||
| |||
| |||
| Характеристики | |||
| CN4О8 | |||
| Молярная масса | 196,04 г / моль | ||
| Внешность | От бесцветного до бледно-желтого жидкого или твердого вещества | ||
| Запах | Острый | ||
| Плотность | 1,623 г / см3 | ||
| Температура плавления | 13,8 ° С (56,8 ° F, 286,9 К) | ||
| Точка кипения | 126 ° С (259 ° F, 399 К) | ||
| инсол | |||
| Давление газа | 8 мм рт. Ст. (20 ° C)[2] | ||
| -43.02·10−6 см3/ моль | |||
| Опасности | |||
| Главный опасности | Окислитель, может образовывать взрывоопасные смеси | ||
| Паспорт безопасности | ICSC 1468 | ||
Классификация ЕС (DSD) (устарело) |   | ||
| R-фразы (устарело) | R8 R23 / 24/25 R36 / 38 R45 | ||
| S-фразы (устарело) | S17 S45 | ||
| NFPA 704 (огненный алмаз) | |||
| Смертельная доза или концентрация (LD, LC): | |||
LC50 (средняя концентрация ) | 18 частей на миллион (крыса, 4 часа) 100 частей на миллион (кошка, 20 мин) 54 частей на миллион (мышь, 4 часа)[3] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 1 ppm (8 мг / м3)[2] | ||
REL (Рекомендуемые) | TWA 1 ppm (8 мг / м3)[2] | ||
IDLH (Непосредственная опасность) | 4 частей на миллион[2] | ||
| Родственные соединения | |||
Родственные соединения | Гексанитроэтан Октанитропентан Тринитрометан | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Тетранитрометан или же TNM является органический окислитель с химической формулой C (NO2)4. Его химическая структура состоит из четырех нитрогруппы присоединен к одному атому углерода. В 1857 году он был впервые синтезирован по реакции натрия цианоацетамид с азотная кислота.[4]
Использует
Он был исследован для использования в качестве окислителя в двухкомпонентные ракеты; однако его высокая температура плавления делает его непригодным. Высокоочищенный тетранитрометан нельзя заставить взорваться, но его чувствительность резко повышается из-за окисляемых примесей, таких как добавки, предотвращающие замерзание. Это делает его практически непригодным для использования в качестве топлива.[5] В лаборатории он используется как реагент для обнаружения двойных связей в органических соединениях и как нитрующий реагент. Он также нашел применение в качестве добавки к дизельному топливу для увеличения цетановое число.[6]
Подготовка
TNM - это бледно-желтая жидкость, которую можно приготовить в лаборатории нитрование из уксусный ангидрид с безводным азотная кислота (Метод Чаттауэя).[7] Этот метод был опробован в промышленных масштабах в 1950-х годах компанией Nitroform Products в Ньюарке, США, но весь завод был разрушен взрывом в 1953 году.[8]
Первое промышленное производство было начато в Германии во время Вторая Мировая Война в целях повышения цетанового числа дизельного топлива. Этот процесс улучшил оригинальный метод, который начинался с уксусная кислота и азотная кислота.[9] Без учета урожайности или стоимости за несколько недель было произведено около 10 тонн TNM. Однако этот производственный процесс больше не использовался в промышленности после окончания войны из-за высоких связанных с этим затрат.[10]
Для коммерческого использования более дешевый метод, начиная с ацетилен был использован.[11]Во-первых, азотная кислота, содержащая нитрат ртути, восстанавливается ацетиленом, что приводит к тринитрометан (нитроформ) и смесь углекислый газ и оксид азота как отработанный газ. Оксиды азота ценны и обычно восстанавливаются в виде азотной кислоты в абсорбционной башне. Полученная нитроформа превращается в TNM путем добавления азотной и серной кислоты при более высоких температурах. С помощью этого метода до очистки можно достичь выхода 90% (в расчете на азотную кислоту).[12]
Безопасность
На способность TNM детонировать в значительной степени влияет присутствие примесей даже в небольших количествах. TNM образует чрезвычайно мощные взрывоопасные смеси, когда топливо добавляется в стехиометрических пропорциях. Многие из этих смесей показывают чувствительность к удару даже выше, чем у нитроглицерин.[13]
TNM реагирует с влагой при повышенном pH с образованием тринитрометан (нитроформ), который легко вступает в реакцию с металлами с образованием очень нестабильных и взрывоопасных солей.
Тетранитрометан очень токсичен. Абсорбция всего 2,5 мг / кг может вызвать метгемоглобинемия, отек легких и поражение печени, почек и центральной нервной системы. Есть основания полагать, что это канцероген для человека.[14]
Рекомендации
- ^ Индекс Merck, 11-е издание, 9164.
- ^ а б c d Карманный справочник NIOSH по химической опасности. "#0605". Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Тетранитрометан». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ Л. Н. Шишков (1857). "Sur la конституция молниеносной уксусной и новой серии корпусов происходит от ацетальной кислоты". Анналы химии и тела. 49 (11): 310.
- ^ Дж. Г. Чинкель (1956). «Тетранитрометан как окислитель ракетного топлива». Промышленная и инженерная химия. 48 (4): 732–735. Дои:10.1021 / ie50556a022.
- ^ К. В. Алтухов, В. В. Перекалин (1976). «Химия тетранитрометана». Российские химические обзоры. 45 (11): 1052–1066. Дои:10.1070 / RC1976v045n11ABEH002759.
- ^ Лян, П. (1941). «Тетранитрометан» (PDF). Органический синтез. 21: 105.; Коллективный объем, 3, п. 803
- ^ Махони против Nitroform Co., 114 A.2d 863 (Апелляционное отделение штата Нью-Джерси, 1955 г.).
- ^ Ф. Д. Чаттауэй (1910). «Простой способ получения тетранитрометана». Журнал химического общества. 97: 2099–2102. Дои:10.1039 / CT9109702099.
- ^ К. Ф. Хагер (1949). «Тетранитрометан». Промышленная и инженерная химия. 41 (10): 2168–2172. Дои:10.1021 / ie50478a028.
- ^ К. Дж. П. Ортон, П. В. Маккай (1920). «Действие азотной кислоты на непредельные углеводороды. Действие азотной кислоты на ацетилен». Журнал химического общества. 117: 283–297. Дои:10.1039 / CT9201700283.
- ^ Урбанский, Тадеуш (1964). Химия и технология взрывчатых веществ. я. Pergamon Press. С. 589–594. LCCN 83002261.
- ^ Урбанский, Тадеуш (1964). Химия и технология взрывчатых веществ. я. Pergamon Press. п. 593. LCCN 83002261.
- ^ Национальная токсикологическая программа (2011). «Тетранитрометан» (PDF). Отчет о канцерогенных веществах (12-е изд.). Национальная токсикологическая программа. В архиве (PDF) из оригинала 31.01.2013. Получено 2012-08-14.