Этилендиамин - Википедия - Ethylenediamine
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Предпочтительное название IUPAC Этан-1,2-диамин | |||
| Систематическое название ИЮПАК Этан-1,2-диамин[2] | |||
| Другие имена Эдамин[1] 1,2-диаминоэтан, 'en', когда лиганд | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| Сокращения | en | ||
| 605263 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.154 | ||
| Номер ЕС |
| ||
| 1098 | |||
| КЕГГ | |||
| MeSH | этилендиамин | ||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1604 | ||
| |||
| |||
| Характеристики | |||
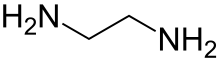
| C2ЧАС8N2 | |||
| Молярная масса | 60.100 г · моль−1 | ||
| Внешность | Бесцветная жидкость[3] | ||
| Запах | Аммиачный[3] | ||
| Плотность | 0,90 г / см3[3] | ||
| Температура плавления | 8 ° С (46 ° F, 281 К)[3] | ||
| Точка кипения | 116 ° С (241 ° F, 389 К)[3] | ||
| смешивающийся | |||
| бревно п | −2.057 | ||
| Давление газа | 1,3 кПа (при 20 ° C) | ||
Закон Генри постоянный (kЧАС) | 5,8 моль Па−1 кг−1 | ||
| |||
| 1.4565 | |||
| Термохимия | |||
Теплоемкость (C) | 172,59 Дж К−1 моль−1 | ||
Стандартный моляр энтропия (S | 202,42 Дж К−1 моль−1 | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −63,55–−62,47 кДж моль−1 | ||
Станд. Энтальпия горение (ΔcЧАС⦵298) | −1,8678–−1,8668 МДж моль−1 | ||
| Опасности | |||
| Пиктограммы GHS |     | ||
| Сигнальное слово GHS | Опасность | ||
| H226, H302, H312, H314, H317, H334 | |||
| P261, P280, P305 + 351 + 338, P310 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | 34 ° С (93 ° F, 307 К)[3] | ||
| 385 ° С (725 ° F, 658 К)[3] | |||
| Пределы взрываемости | 2.7–16% | ||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза ) | 500 мг / кг (перорально, крыса) 470 мг / кг (перорально, морская свинка) 1160 мг / кг (перорально, крыса)[5] | ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 10 частей на миллион (25 мг / м3)[4] | ||
REL (Рекомендуемые) | TWA 10 частей на миллион (25 мг / м3)[4] | ||
IDLH (Непосредственная опасность) | 1000 частей на миллион[4] | ||
| Родственные соединения | |||
Родственные алканамины | 1,2-диаминопропан, 1,3-диаминопропан | ||
Родственные соединения | Этиламин, Этилендинитрамин | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Этилендиамин (сокращенно en когда лиганд ) это органическое соединение с формула C2ЧАС4(NH2)2. Эта бесцветная жидкость с аммиак -подобный запах - сильно базовый амин. Это широко используемый строительный блок в химическом синтезе, около 500000 тонны Год выпуска 1998.[6] Этилендиамин легко вступает в реакцию с влагой влажного воздуха, образуя едкий, токсичный и раздражающий туман, даже кратковременное воздействие которого может нанести серьезный вред здоровью (см. Раздел «Безопасность»). Этилендиамин - первый член так называемого полиэтиленамины.
Синтез
Этилендиамин производят промышленным способом путем обработки 1,2-дихлорэтан с аммиак под давлением при 180 ° С в водной среде:[6][7]
В этой реакции хлористый водород образуется, которая образует соль с амином. Амин высвобождается при добавлении едкий натр и затем может быть восстановлен исправление. Диэтилентриамин (ДЕТА) и триэтилентетрамин (TETA) образуются как побочные продукты.
Еще один промышленный путь получения этилендиамина включает реакцию этаноламин и аммиак:[8]
Этот процесс включает прохождение газообразных реагентов над слоем никеля. гетерогенные катализаторы.
Этилендиамин можно очистить обработкой гидроксидом натрия для удаления воды с последующей дистилляцией.[9]
Приложения
Этилендиамин в больших количествах используется для производства многих промышленных химикатов. Он образует производные с карбоновые кислоты (включая жирные кислоты ), нитрилы, спирты (при повышенных температурах), алкилирующие агенты, сероуглерод, и альдегиды и кетоны. Из-за своей бифункциональной природы, имея два амина, он легко образует гетероциклы, такие как имидазолидины.
Прекурсор хелатирующих агентов, лекарств и агрохимикатов
Наиболее известным производным этилендиамина является хелатирующий агент EDTA, который образуется из этилендиамина через Синтез Стрекера с участием цианид и формальдегид. Гидроксиэтилэтилендиамин - еще один коммерчески значимый хелатирующий агент.[6] Многочисленные биоактивные соединения и лекарства содержат N-CH.2-CH2-N связь, в том числе некоторые антигистаминные препараты.[10] Соли этиленбисдитиокарбамата являются коммерчески значимыми фунгицидами под торговыми марками. Манеб, Манкозеб, Зинеб, и Метирам. Немного имидазолин -содержащие фунгициды являются производными этилендиамина.[6]
Фармацевтический ингредиент
Этилендиамин - это ингредиент в общем бронходилататор препарат, средство, медикамент аминофиллин, где он служит для растворения активного ингредиента теофиллин. Этилендиамин также использовался в дерматологических препаратах, но был удален из некоторых, поскольку он вызывает контактный дерматит.[11] При использовании в качестве фармацевтического наполнителя после перорального приема биодоступность составляет около 0,34 из-за существенного эффект первого прохода. Менее 20% устраняется почечный экскреция.[12]
Производное этилендиамина антигистаминные препараты являются старейшими из пяти классов антигистаминные препараты первого поколения, начиная с пипероксан aka benodain, обнаруженный в 1933 году в Институте Пастера во Франции, а также мепирамин, трипеленнамин, и антазолин. Остальные классы - производные этаноламина, алкиламин, пиперазин, и другие (в первую очередь трициклические и тетрациклические соединения, относящиеся к фенотиазины, трициклические антидепрессанты, так же хорошо как ципрогептадин -фениндамин семья)
Роль в полимерах
Этилендиамин, поскольку он содержит две аминогруппы, является широко используемым предшественником различных полимеров. Конденсаты, полученные из формальдегида, являются пластификаторами. Он широко используется при производстве полиуретановых волокон. PAMAM класс дендримеры происходят из этилендиамина.[6]
Тетраацетилэтилендиамин
В отбеливание активатор тетраацетилэтилендиамин образуется из этилендиамина. Производная N,N-этиленбис (стеарамид) (EBS) является коммерчески значимой формойразделительный агент и поверхностно-активное вещество в бензине и моторном масле.
Другие приложения
- как растворитель, это смешивающийся с полярными растворителями и используется для солюбилизации белки Такие как альбумины и казеин. Он также используется в некоторых гальваника ванны.
- как замедлитель коррозии в красках и охлаждающие жидкости.
- дигидроиодид этилендиамина (EDDI) добавляется в корм для животных в качестве источника йодида.
- химикаты для цветная фотография развивающийся, связующие, клеи, смягчители ткани, лечение агенты для эпоксидные смолы, и красители.
- как соединение для повышения чувствительности нитрометан во взрывчатку. Эта смесь использовалась при Пикатинни Арсенал во время Второй мировой войны, давая прозвище смеси нитрометана и этилендиамина PLX, или жидкое взрывчатое вещество Пикатинни.
Координационная химия
Этилендиамин - хорошо известный двузубый хелатирующий лиганд за координационные соединения, причем два атома азота отдают свои неподеленные пары электронов, когда этилендиамин действует как лиганд. В неорганической химии его часто называют сокращенно «en». Комплекс [Co (этилендиамин)3]3+ архетипичный хиральный трис-хелатный комплекс. В саленовые лиганды, некоторые из которых используются в катализе, образуются в результате конденсации салицилальдегиды и этилендиамин.
Родственные лиганды
Родственные производные этилендиамина включают: этилендиаминтетрауксусная кислота (ЭДТА), тетраметилэтилендиамин (TMEDA) и тетраэтилэтилендиамин (ТИДА). Хиральный аналоги этилендиамина включают 1,2-диаминопропан и транс-диаминоциклогексан.
Безопасность
Этилендиамин, как аммиак и другие низкомолекулярные амины, раздражает кожу и органы дыхания. Жидкий этилендиамин, если его не хранить плотно, выделяет токсичные и раздражающие пары в окружающую среду, особенно при нагревании. Пары реагируют с влагой во влажном воздухе, образуя характерный белый туман, который чрезвычайно раздражает кожу, глаза, легкие и слизистые оболочки.
Рекомендации
- ^ "32007R0129". Евросоюз. 12 февраля 2007 г. Приложение II.. Получено 3 мая 2012.
- ^ «Этилендиамин - Резюме соединения». PubChem Compound. США: Национальный центр биотехнологической информации. 16 сентября 2004 г. Идентификационные и связанные записи. Получено 3 мая 2012.
- ^ а б c d е ж грамм Записывать в базе данных веществ GESTIS Институт охраны труда и здоровья
- ^ а б c Карманный справочник NIOSH по химической опасности. "#0269". Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Этилендиамин». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б c d е Карстен Эллер, Эрхард Хенкес, Роланд Россбахер, Хартмут Хёке «Амины, алифатические» в Энциклопедии промышленной химии Ульмана, 2005 Wiley-VCH Verlag, Weinheim. Дои:10.1002 / 14356007.a02_001
- ^ Ханс-Юрген Арпе, Industrielle Organische Chemie, 6. Auflage (2007), Seite 245, Wiley VCH
- ^ Ханс-Юрген Арпе, Industrielle Organische Chemie, 6. Auflage (2007), Seite 275, Wiley VCH
- ^ Роллинсон, Карл Л .; Байлар-младший, Джон К. (1946). «Соли трис (этилендиамин) хрома (III)». Неорганические синтезы. Неорганические синтезы. 2. С. 196–200. Дои:10.1002 / 9780470132333.ch60. ISBN 9780470132333.
- ^ Kotti, S.R.S.S .; Тиммонс, К. и Ли, Г. (2006). «Вицинальные диамино-функциональные группы как привилегированные структурные элементы в биологически активных соединениях и использование их синтетической химии». Химическая биология и дизайн лекарств. 67 (2): 101–114. Дои:10.1111 / j.1747-0285.2006.00347.x. PMID 16492158.
- ^ Hogan DJ (январь 1990 г.). «Аллергический контактный дерматит на этилендиамин. Постоянная проблема». Дерматол Клин. 8 (1): 133–6. Дои:10.1016 / S0733-8635 (18) 30536-9. PMID 2137392.
- ^ Зуидема Дж. (23 августа 1985 г.). «Этилендиамин, профиль сенсибилизирующего вспомогательного вещества». Аптека Мир и наука. 7 (4): 134–40. Дои:10.1007 / BF02097249. PMID 3900925.
внешняя ссылка
![]() СМИ, связанные с Этилендиамин в Wikimedia Commons
СМИ, связанные с Этилендиамин в Wikimedia Commons



