Липоевая кислота - Википедия - Lipoic acid
 | |
 | |
 | |
| Имена | |
|---|---|
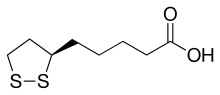
| Название ИЮПАК (р) -5- (1,2-Дитиолан-3-ил) пентановая кислота | |
| Другие имена α-липоевая кислота; Альфа-липоевая кислота; Тиоктовая кислота; 6,8-дитиоктановая кислота | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.012.793 |
| КЕГГ | |
| MeSH | Липоевая + кислота |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C8ЧАС14О2S2 | |
| Молярная масса | 206.32 г · моль−1 |
| Внешность | Желтые игольчатые кристаллы |
| Температура плавления | 60–62 ° С (140–144 ° F, 333–335 К) |
| Очень плохо растворим (0,24 г / л)[1] | |
| Растворимость в этаноле 50 мг / мл | Растворимый |
| Фармакология | |
| A16AX01 (ВОЗ) | |
| Фармакокинетика: | |
| 30% (устно)[2] | |
| Родственные соединения | |
Родственные соединения | Липоамид Спаржевая кислота |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Липоевая кислота (ЛА), также известный как α-липоевая кислота и Альфа-липоевая кислота (ALA) и тиоктовая кислота, является сероорганическое соединение происходит от каприловая кислота (октановая кислота).[3] ALA обычно вырабатывается у животных и необходима для аэробный метаболизм. Он также производится и доступен как пищевая добавка в некоторых странах, где он продается как антиоксидант, и доступен как фармацевтический препарат в другие страны.[3]
Физические и химические свойства
Липоевая кислота (ЛК), также известная как α-липоевая кислота,[3][4] альфа-липоевая кислота (ALA) и тиоктовая кислота[5] является сероорганическое соединение происходит от октановая кислота.[3] LA содержит два атома серы (в C6 и C8), соединенных между собой дисульфидная связь и, таким образом, считается окисленным, хотя любой атом серы может существовать в более высоких степенях окисления.[3]
Атом углерода у C6 хиральный и молекула существует как два энантиомеры (р) - (+) - липоевая кислота (RLA) и (S) - (-) - липоевая кислота (SLA) и как рацемическая смесь (р/S) -липоевая кислота (R / S-LA).
LA физически выглядит как желтое твердое вещество и структурно содержит концевую карбоновую кислоту и концевое дитиолановое кольцо.
Для использования в пищевая добавка материалы и компаундирование аптеки, USP создал официальную монографию для R / S-LA.[6][7]
Биологическая функция
«Липоат» - это сопряженное основание липоевой кислоты и наиболее распространенной формы LA в физиологических условиях.[3] Большинство эндогенно продуцируемых RLA не являются «свободными», поскольку октановая кислота, предшественник RLA, связывается с ферментными комплексами до ферментативной вставки атомов серы. В качестве кофактора RLA ковалентно присоединяется амидной связью к концевому остатку лизина липоильных доменов фермента. Одна из наиболее изученных ролей RLA - это кофактор пируватдегидрогеназный комплекс (PDC или PDHC), хотя он также является кофактором в других ферментных системах (описанных ниже).[3]
Только (р) - (+) - энантиомер (RLA) существует в природе и необходим для аэробный метаболизм потому что RLA является важным кофактор многих ферментных комплексов.[3]
Биосинтез и привязанность
Предшественник липоевой кислоты, октановая кислота, производится через биосинтез жирных кислот в виде октаноил-белок-носитель ацила.[3] В эукариоты, второй путь биосинтеза жирных кислот в митохондрии используется для этой цели.[3] Октаноат переносится как сложный тиоэфир белок-носитель ацила из биосинтез жирных кислот для амид белка липоильного домена фермент называется октаноилтрансферазой.[3] Два атома водорода октаноата заменяются серными группами через радикальный SAM механизм, по липоилсинтаза.[3] В результате липоевая кислота синтезируется прикрепленной к белкам, а свободная липоевая кислота не образуется. Липоевая кислота может быть удалена всякий раз, когда белки разрушаются, а также под действием фермента липоамидазы.[8] Свободный липоат может использоваться некоторыми организмами как фермент, называемый липоат протеин лигаза который ковалентно связывает его с правильным белком. В лигаза деятельность этого фермент требует АТФ.[9]
Сотовый транспорт
Вместе с натрий и витамины биотин (B7) и пантотеновая кислота (B5) липоевая кислота попадает в клетки через SMVT (натрийзависимый поливитаминный переносчик). Каждое из соединений, транспортируемых SMVT, конкурентоспособно с другими. Например, исследования показали, что увеличение потребления липоевой кислоты[10] или пантотеновая кислота[11] снижает поглощение биотина и / или активность биотин-зависимых ферментов.
Ферментативная активность
Липоевая кислота - это кофактор не менее пяти фермент системы.[3] Два из них находятся в цикл лимонной кислоты благодаря которому многие организмы превращают питательные вещества в энергию. Липоилированный ферменты липоевая кислота присоединена к ним ковалентно. Перенос липоильной группы ацил группы в 2-оксокислота дегидрогеназа комплексы и метиламин группа в комплекс расщепления глицина или же глициндегидрогеназа.[3]
Реакции переноса 2-оксокислоты дегидрогеназы протекают по аналогичному механизму в:
- то пируватдегидрогеназный комплекс
- то α-кетоглутаратдегидрогеназа или же 2-оксоглутаратдегидрогеназа сложный
- то оксикислота дегидрогеназа с разветвленной цепью (BCDH) комплекс
- то ацетоиндегидрогеназа сложный.
Наиболее изученным из них является комплекс пируватдегидрогеназы.[3] Эти комплексы имеют три центральные субъединицы: E1-3, которые представляют собой декарбоксилазу, липоилтрансферазу и дигидролипоамиддегидрогеназа, соответственно. Эти комплексы имеют центральное ядро E2, а другие субъединицы окружают это ядро, образуя комплекс. В промежутке между этими двумя субъединицами липоильный домен переносит промежуточные звенья между активными центрами.[3] Сам липоильный домен прикреплен гибким линкером к ядру E2, и количество липоильных доменов варьируется от одного до трех для данного организма. Число доменов варьировалось экспериментально и, по-видимому, мало влияло на рост, пока не было добавлено более девяти, хотя более трех уменьшили активность комплекса.[12]
Липоевая кислота служит кофактором для ацетоиндегидрогеназа комплекс, катализирующий превращение ацетоин (3-гидрокси-2-бутанон) в ацетальдегид и ацетилкофермент А.[3]
В система расщепления глицином отличается от других комплексов и имеет другую номенклатуру.[3] В этой системе белок H представляет собой свободный липоильный домен с дополнительными спиралями, белок L представляет собой дигидролипоамиддегидрогеназу, белок P представляет собой декарбоксилазу, а белок T передает метиламин от липоата к тетрагидрофолат (THF) с получением метилен-THF и аммиака. Затем метилен-ТГФ используется серингидроксиметилтрансферазой для синтеза серин из глицин. Эта система является частью завода фотодыхание.[13]
Биологические источники и разложение
Липоевая кислота присутствует во многих продуктах питания, в которых она связана с лизином в белках,[3] но немного больше в почках, сердце, печени, шпинате, брокколи и дрожжевом экстракте.[14] Встречающаяся в природе липоевая кислота всегда ковалентно связана и не является легко доступной из пищевых источников.[3] Кроме того, количество липоевой кислоты в пищевых источниках невелико. Например, при очистке липоевой кислоты для определения ее структуры использовалось приблизительно 10 тонн остатков печени, что давало 30 мг липоевой кислоты.[15] В результате вся липоевая кислота, доступная в виде добавок, синтезируется химическим путем.
Исходные уровни (до приема) RLA и R-DHLA в плазме человека не обнаружены.[16] RLA был обнаружен при 12,3-43,1 нг / мл после кислотного гидролиза, который высвобождает связанную с белком липоевую кислоту. Ферментативный гидролиз липоевой кислоты, связанной с белком, высвобождает 1,4-11,6 нг / мл и <1-38,2 нг / мл при использовании субтилизин и алькалаз, соответственно.[17][18][19]
Пищеварительные протеолитические ферменты отщепляют остаток R-липоиллизина от комплексов митохондриальных ферментов, полученных из пищи, но неспособны расщеплять липоевую кислоту.L-лизин амидная связь.[20] И синтетический липоамид, и (р) -липоил-L-лизин быстро расщепляются липоамидазами сыворотки, которые высвобождают свободные (р) -липоевая кислота и либо L-лизин или аммиак.[3] Мало что известно о разложении и использовании алифатических сульфидов, таких как липоевая кислота, за исключением цистеин.[3]
Липоевая кислота метаболизируется различными способами при введении млекопитающим в качестве пищевой добавки.[3][21] Липоевая кислота частично разлагается в результате множества превращений, которые могут происходить в различных комбинациях. Наблюдали разложение до тетранорлипоевой кислоты, окисление одного или обоих атомов серы до сульфоксида и S-метилирование сульфида. Конъюгация немодифицированной липоевой кислоты с глицином была обнаружена особенно у мышей.[21] У людей разложение липоевой кислоты аналогично, хотя неясно, сильно ли окисляются атомы серы.[3][22] Очевидно, млекопитающие не способны использовать липоевую кислоту в качестве источника серы.
Химический синтез

SLA не существовало до химического синтеза в 1952 году.[23][24] SLA производится в равных количествах с RLA во время ахиральных производственных процессов. Рацемическая форма более широко использовалась клинически в Европе и Японии в 1950-1960-х годах, несмотря на раннее признание того, что различные формы LA не биоэквивалентны.[25] Первые синтетические процедуры появились для RLA и SLA в середине 1950-х годов.[26][27][28][29] Достижения в хиральной химии привели к появлению более эффективных технологий производства отдельных энантиомеров обоими классическое разрешение и асимметричный синтез и спрос на RLA также вырос в это время. В 21 веке R / S-LA, RLA и SLA с высокой химической и / или оптической чистотой доступны в промышленных количествах. В настоящее время большая часть мировых поставок R / S-LA и RLA производится в Китае и меньшие количества - в Италии, Германии и Японии. RLA производится путем модификации процесса, впервые описанного Георгом Лангом, доктором философии. дипломной работы и позже запатентованной ДеГуссой.[30][31] Хотя RLA является предпочтительным с точки зрения питания из-за его «витаминоподобной» роли в метаболизме, как RLA, так и R / S-LA широко доступны в качестве пищевых добавок. Обе стереоспецифический и, как известно, происходят нестереоспецифические реакции in vivo и вносят вклад в механизмы действия, но имеющиеся на сегодняшний день данные указывают на то, что RLA может быть эутомер (предпочтительная с питательной и терапевтической точки зрения форма).[32][33]
Фармакология
Фармакокинетика
Человек 2007 года фармакокинетический Исследование RLA натрия показало, что максимальная концентрация в плазме и биодоступность значительно выше, чем у формы свободной кислоты, и конкурируют с уровнями в плазме, достигнутыми при внутривенном введении формы свободной кислоты.[34] Кроме того, были достигнуты высокие уровни в плазме, сравнимые с таковыми в моделях на животных, где был активирован Nrf2.[34]
Различные формы LA не биоэквивалентны.[25][неосновной источник необходим ] Очень мало исследований сравнивают отдельные энантиомеры с рацемической липоевой кислотой. Неясно, может ли вдвое больше рацемической липоевой кислоты заменить RLA.[34]
Токсическая доза LA для кошек намного ниже, чем у людей или собак, и вызывает гепатоцеллюлярную токсичность.[35]
Фармакодинамика
Механизм и действие липоевой кислоты при внешнем поступлении в организм противоречивы. Липоевая кислота в клетке, по-видимому, в первую очередь вызывает реакцию окислительного стресса, а не непосредственно улавливает свободные радикалы. Этот эффект характерен для RLA.[4] Несмотря на сильно восстанавливающую среду, ЛК была обнаружена внутриклеточно как в окисленной, так и в восстановленной формах.[36] LA способна улавливать реактивный кислород и реактивные формы азота в биохимическом анализе из-за длительного времени инкубации, но мало доказательств того, что это происходит внутри клетки или что улавливание радикалов способствует первичным механизмам действия LA.[4][37] Относительно хорошая поглощающая способность LA по отношению к хлорноватистой кислоте (бактерицидное средство, продуцируемое нейтрофилами, которое может вызывать воспаление и повреждение тканей) обусловлена натянутой конформацией 5-членного дитиоланового кольца, которое теряется при восстановлении до DHLA. В клетках LA восстанавливается до дигидролипоевой кислоты, которая обычно считается более биологически активной формой LA и формой, ответственной за большинство антиоксидантных эффектов и за снижение окислительно-восстановительной активности несвязанного железа и меди.[38] Эта теория была поставлена под сомнение из-за высокого уровня реактивности двух свободных сульфгидрилов, низких внутриклеточных концентраций DHLA, а также быстрого метилирования одного или обоих сульфгидрилов, быстрого окисления боковой цепи до более коротких метаболитов и быстрого оттока из клетки. Хотя и DHLA, и LA были обнаружены внутри клеток после введения, большая часть внутриклеточного DHLA, вероятно, существует в виде смешанных дисульфидов с различными остатками цистеина из цитозольных и митохондриальных белков.[32] Недавние результаты показывают, что терапевтический и антивозрастной эффекты обусловлены модуляцией передачи сигналов и транскрипции генов, что улучшает антиоксидантный статус клетки. Однако это, вероятно, происходит через прооксидантные механизмы, а не за счет улавливания радикалов или эффектов восстановления.[4][37][39]
Все дисульфид формы LA (R / S-LA, RLA и SLA) можно свести к DHLA хотя в модельных системах сообщалось как о тканеспецифическом, так и о стереоселективном (предпочтение одного энантиомера другому) редукции. Как минимум два цитозольных фермента, глутатионредуктаза (GR) и тиоредоксинредуктаза (Trx1) и два митохондриальных фермента, липоамиддегидрогеназа и тиоредоксинредуктаза (Trx2) уменьшить LA. SLA стереоселективно восстанавливается цитозольным GR, тогда как Trx1, Trx2 и липоамиддегидрогеназа стереоселективно снижают RLA. (р) - (+) - липоевая кислота ферментативно или химически восстанавливается до (р) - (-) - дигидролипоевая кислота, тогда как (S) - (-) - липоевая кислота восстанавливается до (S) - (+) - дигидролипоевая кислота.[40][41][42][43][44][45][46] Дигидролипоевая кислота (DHLA) также может образовываться внутриклеточно и внеклеточно посредством неферментативных, реакции тиол-дисульфидного обмена.[47]
RLA может функционировать in vivo как витамин B и в более высоких дозах, например, питательные вещества растительного происхождения, такие как куркумин, сульфорафан, ресвератрол, и другие пищевые вещества, которые вызывают ферменты детоксикации фазы II, действуя таким образом как цитопротекторные агенты.[39][48] Эта реакция на стресс косвенно улучшает антиоксидантную способность клетки.[4]
(S) -энантиомер LA оказался токсичным при введении крысам с дефицитом тиамина.[49][50]
Несколько исследований продемонстрировали, что SLA либо имеет более низкую активность, чем RLA, либо препятствует специфическим эффектам RLA за счет конкурентное торможение.[51][52][53][54][55]
Использует
R / S-LA и RLA широко доступны в США в виде безрецептурных пищевых добавок в форме капсул, таблеток и жидкостей на водной основе и продаются как антиоксиданты.[3]
Хотя организм может синтезировать LA, он также может абсорбироваться из пищи. Пищевые добавки в дозах от 200 до 600 мг могут обеспечить до 1000 раз больше, чем можно получить из обычного рациона. Всасывание в желудочно-кишечном тракте непостоянно и снижается при употреблении пищи. Поэтому рекомендуется принимать диетический LA за 30–60 минут до или как минимум через 120 минут после еды. Максимальные уровни LA в крови достигаются через 30–60 минут после приема пищевых добавок, и считается, что он в значительной степени метаболизируется в печени.[56]
В Германии LA одобрен как препарат для лечения диабетическая невропатия с 1966 г. и отпускается без рецепта.[57]
Клинические исследования
Согласно Американское онкологическое общество по состоянию на 2013 год «в настоящее время нет надежных научных доказательств того, что липоевая кислота предотвращает развитие или распространение рака».[58] По состоянию на 2015 год внутривенное введение ALA не одобрено нигде в мире, кроме Германии для диабетическая невропатия, но была доказана разумная безопасность и эффективность в четырех клинических испытаниях; однако другое крупное испытание, продолжавшееся четыре года, не обнаружило отличий от плацебо.[59] По состоянию на 2012 год не было убедительных доказательств того, что альфа-липоевая кислота помогает людям с митохондриальные нарушения.[60] Обзор 2018 года рекомендует ALA в качестве добавки против ожирения с низкой дозировкой (<600 мг / день) в течение короткого периода времени (<10 недель), однако она слишком дорога, чтобы быть практичной в качестве дополнительной терапии ожирения.[61]
Прочие липоевые кислоты
- β-липоевая кислота представляет собой тиосульфинат α-липоевой кислоты
Рекомендации
- ^ «Липоевая кислота». Pubmed. NCBI. Получено 18 октября, 2018.
- ^ Тейхерт, Дж; Hermann, R; Ruus, P; Прейсс, Р. (ноябрь 2003 г.). «Кинетика плазмы, метаболизм и экскреция с мочой альфа-липоевой кислоты после перорального приема у здоровых добровольцев». Журнал клинической фармакологии. 43 (11): 1257–67. Дои:10.1177/0091270003258654. PMID 14551180. S2CID 30589232.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у «Липоевая кислота». Информационный центр по микронутриентам, Институт Линуса Полинга, Государственный университет Орегона, Корваллис. 1 января 2019 г.. Получено 5 ноября 2019.
- ^ а б c d е Шай, КП; Моро, РФ; Смит, EJ; Хаген, TM (июнь 2008 г.). «Является ли альфа-липоевая кислота поглотителем активных форм кислорода in vivo? Доказательства того, что она инициирует сигнальные пути стресса, которые способствуют эндогенной антиоксидантной способности». IUBMB Life. 60 (6): 362–7. Дои:10.1002 / iub.40. PMID 18409172. S2CID 33008376.
- ^ Релянович, М; Reichel, G; Ретт, К; Лобиш, М; и другие. (Сентябрь 1999 г.). «Лечение диабетической полинейропатии с помощью антиоксиданта тиоктовой кислоты (альфа-липоевая кислота): двухлетнее многоцентровое рандомизированное двойное слепое плацебо-контролируемое испытание (ALADIN II). Альфа-липоевая кислота при диабетической невропатии». Свободные радикальные исследования. 31 (3): 171–9. Дои:10.1080/10715769900300721. PMID 10499773.
- ^ USP32-NF27. п. 1042.
- ^ «Фармакопейный форум». 34 (5): 1209. Цитировать журнал требует
| журнал =(помощь) - ^ Цзян, Y; Кронан, Дж. Э. (2005). "Клонирование экспрессии и демонстрация Enterococcus faecalis липоамидаза (инактиваза пируватдегидрогеназы) как амидогидролаза триады Ser-Ser-Lys ». Журнал биологической химии. 280 (3): 2244–56. Дои:10.1074 / jbc.M408612200. PMID 15528186.
- ^ Cronan, JE; Чжао, X; Цзян, Y (2005). Пул, РК (ред.). Функция, присоединение и синтез липоевой кислоты в кишечная палочка. Успехи микробной физиологии. 50. С. 103–46. Дои:10.1016 / S0065-2911 (05) 50003-1. ISBN 9780120277506. PMID 16221579.
- ^ Zempleni, J .; Trusty, T. A .; Мок, Д. М. (1997). «Липоевая кислота снижает активность биотин-зависимых карбоксилаз в печени крыс». Журнал питания. 127 (9): 1776–81. Дои:10.1093 / jn / 127.9.1776. PMID 9278559.
- ^ Chirapu, S. R .; Rotter, C.J .; Miller, E.L .; Varma, M. V .; Dow, R.L .; Финн, М. Г. (2013). «Высокая специфичность в ответ натрий-зависимого поливитаминного переносчика на производные пантотеновой кислоты». Актуальные темы медицинской химии. 13 (7): 837–42. Дои:10.2174/1568026611313070006. PMID 23578027.
- ^ Machado, RS; Кларк, DP; Гость, младший (1992). «Построение и свойства комплексов пируватдегидрогеназы с максимум девятью липоильными доменами на цепь липоатацетилтрансферазы». Письма о микробиологии FEMS. 79 (1–3): 243–8. Дои:10.1111 / j.1574-6968.1992.tb14047.x. PMID 1478460.
- ^ Douce, R; Бургиньон, Дж; Neuburger, M; Ребейл, Ф (2001). «Глициндекарбоксилазная система: увлекательный комплекс». Тенденции в растениеводстве. 6 (4): 167–76. Дои:10.1016 / S1360-1385 (01) 01892-1. PMID 11286922.
- ^ Дуррани, AI; Шварц, H; Нагл, М; Зонтаг, Г. (октябрь 2010 г.). «Определение свободной альфа-липоевой кислоты в пищевых продуктах с помощью ВЭЖХ в сочетании с CEAD и ESI-MS». Пищевая химия. 120 (4): 38329–36. Дои:10.1016 / j.foodchem.2009.11.045.
- ^ Рид, LJ (октябрь 2001 г.). «Следы исследований от липоевой кислоты до комплексов дегидрогеназы альфа-кетокислот». Журнал биологической химии. 276 (42): 38329–36. Дои:10.1074 / jbc.R100026200. PMID 11477096.
- ^ Hermann, R; Niebch, G; Borbe, HO; Fieger, H; и другие. (1996). «Энантиоселективная фармакокинетика и биодоступность различных рацемических составов у здоровых добровольцев». Европейский журнал фармацевтических наук. 4 (3): 167–74. Дои:10.1016/0928-0987(95)00045-3.
- ^ Тейхерт, Дж; Прейсс, Р. (1997). Методы высокоэффективной жидкостной хроматографии для определения липоевой и дигидролипоевой кислоты в плазме крови человека. Методы в энзимологии. 279. С. 159–66. Дои:10.1016 / S0076-6879 (97) 79019-0. ISBN 9780121821807. PMID 9211267.
- ^ Тейхерт, Дж; Прейсс, Р. (октябрь 1995 г.). «Определение липоевой кислоты в плазме крови человека методом высокоэффективной жидкостной хроматографии с электрохимическим детектированием». Журнал хроматографии B. 672 (2): 277–81. Дои:10.1016/0378-4347(95)00225-8. PMID 8581134.
- ^ Тейхерт, Дж; Прейсс, Р. (ноябрь 1992 г.). «ВЭЖХ-методы определения липоевой кислоты и ее восстановленной формы в плазме крови человека». Международный журнал клинической фармакологии, терапии и токсикологии. 30 (11): 511–2. PMID 1490813.
- ^ Biewenga, GP; Haenen, GR; Баст, А (сентябрь 1997 г.). «Фармакология антиоксиданта липоевой кислоты». Общая фармакология. 29 (3): 315–31. Дои:10.1016 / S0306-3623 (96) 00474-0. PMID 9378235.
- ^ а б Schupke, H; Hempel, R; Питер, G; Hermann, R; и другие. (Июнь 2001 г.). «Новые метаболические пути альфа-липоевой кислоты». Метаболизм и утилизация лекарств. 29 (6): 855–62. PMID 11353754.
- ^ Тейхерт, Дж; Hermann, R; Ruus, P; Прейсс, Р. (ноябрь 2003 г.). «Кинетика плазмы, метаболизм и экскреция с мочой альфа-липоевой кислоты после перорального приема у здоровых добровольцев». Журнал клинической фармакологии. 43 (11): 1257–67. Дои:10.1177/0091270003258654. PMID 14551180. S2CID 30589232.
- ^ Хорнбергер, CS; Хайтмиллер, РФ; Gunsalus, IC; Шнакенберг, GHF; и другие. (1953). «Синтез DL - липоевой кислоты». Журнал Американского химического общества. 75 (6): 1273–7. Дои:10.1021 / ja01102a003.
- ^ Хорнбергер, CS; Хайтмиллер, РФ; Gunsalus, IC; Шнакенберг, GHF; и другие. (1952). «Синтетический препарат липоевой кислоты». Журнал Американского химического общества. 74 (9): 2382. Дои:10.1021 / ja01129a511.
- ^ а б Климан, А; Borbe, HO; Ульрих, H (1991). «Тиоктовая кислота-липоевая кислота». In Borbe, HO; Ульрих, H (ред.). Thioctsäure: Neue Biochemische, Pharmakologische und Klinische Erkenntnisse zur Thioctsäure [Тиоктовая кислота. Новая биохимия, фармакология и результаты клинической практики с тиоктовой кислотой]. Симпозиум в Висбадене, Германия, 16–18 февраля 1989 г. Франкфурт, Германия: Verlag. С. 11–26. ISBN 9783891191255.
- ^ Фонтанелла, L (1955). «Приготовление оптических антиподов альфа-липоевой кислоты». Il Farmaco; Edizione Scientifica. 10 (12): 1043–5. PMID 13294188.
- ^ Уолтон, Э; Вагнер, А.Ф .; Бакалавр, FW; Петерсон, LH; и другие. (1955). «Синтез (+) - липоевой кислоты и ее оптического антипода». Журнал Американского химического общества. 77 (19): 5144–9. Дои:10.1021 / ja01624a057.
- ^ Акер, Д.С. Уэйн, WJ (1957). «Оптически активные и радиоактивные α-липоевая кислота». Журнал Американского химического общества. 79 (24): 6483–6487. Дои:10.1021 / ja01581a033.
- ^ Дегучи, Й; Миура, К. (июнь 1964 г.). «Исследования по синтезу тиоктовой кислоты и родственных ей соединений. XIV. Синтез (+) - тиоктамида». Якугаку Засши. 84 (6): 562–3. Дои:10.1248 / yakushi1947.84.6_562. PMID 14207116.
- ^ Ланг, G (1992). Метаболизм a-липоевой кислоты in vitro, особенно с учетом энантиоселективной биотрансформации (Кандидатская диссертация). Мюнстер, Германия: Университет Мюнстера.
- ^ Патент США 5281722, Blaschke, G; U Scheidmantel & H Bethge et al., "Получение и использование солей чистых энантиомеров альфа-липоевой кислоты", выданный 25 января 1994 г., переуступленный DeGussa.
- ^ а б Карлсон, Д.А.; Янг, KL; Фишер, SJ; Ульрих, Х. «Глава 10: Оценка стабильности и фармакокинетики лекарственных форм R-липоевой кислоты и R-дигидролипоевой кислоты в плазме здоровых людей». Липоевая кислота: производство энергии, антиоксидантная активность и влияние на здоровье. С. 235–70. В Пакер и Пател, 2008 г..
- ^ Пакер, л; Kraemer, K; Римбах, Г. (октябрь 2001 г.). «Молекулярные аспекты липоевой кислоты в профилактике осложнений диабета». Питание. 17 (10): 888–95. Дои:10.1016 / S0899-9007 (01) 00658-X. PMID 11684397.
- ^ а б c Карлсон, Д.А.; Смит, АР; Фишер, SJ; Янг, KL; и другие. (Декабрь 2007 г.). «Фармакокинетика плазмы R - (+) - липоевой кислоты, вводимой в виде R - (+) - липоата натрия здоровым людям» (PDF). Обзор альтернативной медицины. 12 (4): 343–51. PMID 18069903.
- ^ Hill, AS; Werner, JA; Роджерс, QR; О'Нил, SL; и другие. (Апрель 2004 г.). «Липоевая кислота в 10 раз более токсична для кошек, чем для людей, собак или крыс». Журнал физиологии животных и питания животных. 88 (3–4): 150–6. Дои:10.1111 / j.1439-0396.2003.00472.x. PMID 15059240.
- ^ Пакер, л; Witt, EH; Tritschler, HJ (август 1995 г.). «Альфа-липоевая кислота как биологический антиоксидант». Свободная радикальная биология и медицина. 19 (2): 227–50. Дои:10.1016 / 0891-5849 (95) 00017-П. PMID 7649494.
- ^ а б Шай, КП; Моро, РФ; Смит, EJ; Смит, АР; и другие. (Октябрь 2009 г.). «Альфа-липоевая кислота как пищевая добавка: молекулярные механизмы и терапевтический потенциал». Biochimica et Biophysica Acta. 1790 (10): 1149–60. Дои:10.1016 / j.bbagen.2009.07.026. ЧВК 2756298. PMID 19664690.
- ^ Haenen, GRMM; Баст, А (1991). «Удаление хлорноватистой кислоты липоевой кислотой». Биохимическая фармакология. 42 (11): 2244–6. Дои:10.1016 / 0006-2952 (91) 90363-А. PMID 1659823.
- ^ а б Шай, КП; Шенви, S; Хаген, TM. «Ch. 14 липоевая кислота как индуктор детоксикационных ферментов фазы II посредством активации экспрессии зависимых от Nr-f2 генов». Липоевая кислота: производство энергии, антиоксидантная активность и влияние на здоровье. С. 349–71. В Пакер и Пател, 2008 г..
- ^ Arnér, ES; Nordberg, J; Холмгрен, А. (август 1996 г.). «Эффективное восстановление липоамида и липоевой кислоты тиоредоксинредуктазой млекопитающих». Сообщения о биохимических и биофизических исследованиях. 225 (1): 268–74. Дои:10.1006 / bbrc.1996.1165. PMID 8769129.
- ^ Biaglow, JE; Ayene, IS; Koch, CJ; Донахью, Дж; и другие. (Апрель 2003 г.). «Радиационная реакция клеток при изменении окислительно-восстановительного потенциала тиола». Радиационные исследования. 159 (4): 484–94. Bibcode:2003РадР..159..484Б. Дои:10.1667 / 0033-7587 (2003) 159 [0484: RROCDA] 2.0.CO; 2. PMID 12643793.
- ^ Haramaki, N; Рука; Handelman, GJ; Tritschler, HJ; и другие. (1997). «Цитозольные и митохондриальные системы для НАДН- и НАДФН-зависимого восстановления альфа-липоевой кислоты». Свободная радикальная биология и медицина. 22 (3): 535–42. Дои:10.1016 / S0891-5849 (96) 00400-5. PMID 8981046.
- ^ Константинеску, А; Выберите, U; Handelman, GJ; Haramaki, N; и другие. (Июль 1995 г.). «Снижение и транспорт липоевой кислоты эритроцитами человека». Биохимическая фармакология. 50 (2): 253–61. Дои:10.1016 / 0006-2952 (95) 00084-D. PMID 7632170.
- ^ Мэй, JM; Qu, ZC; Нельсон, ди-джей (июнь 2006 г.). «Клеточная способность к восстановлению дисульфидов: интегрированная мера окислительно-восстановительной способности клеток». Сообщения о биохимических и биофизических исследованиях. 344 (4): 1352–9. Дои:10.1016 / j.bbrc.2006.04.065. PMID 16650819.
- ^ Джонс, Вт; Ли, Х; Qu, ZC; Perriott, L; и другие. (Июль 2002 г.). «Поглощение, рециркуляция и антиоксидантные действия альфа-липоевой кислоты в эндотелиальных клетках». Свободная радикальная биология и медицина. 33 (1): 83–93. Дои:10.1016 / S0891-5849 (02) 00862-6. PMID 12086686.
- ^ Schempp, H; Ульрих, H; Эльстнер, EF (1994). «Стереоспецифическое восстановление R (+) - тиоктовой кислоты липоамиддегидрогеназой / диафоразой свиного сердца». Zeitschrift für Naturforschung C. 49 (9–10): 691–2. Дои:10.1515 / znc-1994-9-1023. PMID 7945680.
- ^ Biewenga, GP; Haenen, GRMM; Баст, А (1997). «Глава 1: Обзор химии липоатов». В Fuchs, J; Пакер, л; Циммер, G (ред.). Липоевая кислота для здоровья и болезней. CRC Press. стр.1–32. ISBN 9780824700935.
- ^ Lii, CK; Лю, KL; Cheng, YP; Lin, AH; и другие. (Май 2010 г.). «Сульфорафан и альфа-липоевая кислота усиливают экспрессию класса pi глутатион-S-трансферазы посредством активации c-jun и Nrf2». Журнал питания. 140 (5): 885–92. Дои:10.3945 / jn.110.121418. PMID 20237067.
- ^ Gal, EM; Разевская Д.Е. (август 1960 г.). «Исследования метаболизма липоевой кислоты in vivo. 1. Судьба DL-липоевой кислоты-S35 у нормальных крыс и крыс с дефицитом тиамина». Архивы биохимии и биофизики. 89 (2): 253–61. Дои:10.1016/0003-9861(60)90051-5. PMID 13825981.
- ^ Галь Е.М. (июль 1965 г.). «Обращение селективной токсичности (-) - альфа-липоевой кислоты тиамином у крыс с дефицитом тиамина». Природа. 207 (996): 535. Bibcode:1965Натура.207..535Г. Дои:10.1038 / 207535a0. PMID 5328673. S2CID 4146866.
- ^ Патент США 6271254, Ульрих, H; CH Weischer & J Engel et al., "Фармацевтические композиции, содержащие R-альфа-липоевую кислоту или S-альфа-липоевую кислоту в качестве активного ингредиента", выданный 07.08.2001, переданный ASTA Pharma.
- ^ Килич, Ф; Handelman, GJ; Сербинова, Е; Пакер, л; и другие. (Октябрь 1995 г.). «Моделирование кортикального катарактогенеза 17: in vitro действие α-липоевой кислоты на глюкозо-индуцированное повреждение мембраны хрусталика, модель диабетического катарактогенеза». Международная биохимия и молекулярная биология. 37 (2): 361–70. PMID 8673020.
- ^ Artwohl, M; Шметтерер, Л; Райнер, G; и другие. (Сентябрь 2000 г.). Модуляция антиоксидантами эндотелиального апоптоза, пролиферации и ассоциированной экспрессии гена / белка. 36-е ежегодное собрание Европейской ассоциации по изучению диабета, 17–21 сентября 2000 г., Иерусалим, Израиль. Диабетология. 43 (Приложение 1) (опубликовано в августе 2000 г.). Abs 274. PMID 11008622.
- ^ Стрипер, RS; Henriksen, EJ; Джейкоб, S; Хокама, JY; и другие. (Июль 1997 г.). «Дифференциальные эффекты стереоизомеров липоевой кислоты на метаболизм глюкозы в инсулинорезистентных скелетных мышцах». AJP: Эндокринология и метаболизм. 273 (1, часть 1): E185–91. Дои:10.1152 / ajpendo.1997.273.1.E185. PMID 9252495.
- ^ Frölich, L; Götz, ME; Weinmüller, M; Юдим, МБ; и другие. (Март 2004 г.). «(r) -, но не (s) -альфа-липоевая кислота, стимулирует дефицитный комплекс пируватдегидрогеназы мозга при сосудистой деменции, но не при деменции Альцгеймера». Журнал нейронной передачи. 111 (3): 295–310. Дои:10.1007 / s00702-003-0043-5. PMID 14991456. S2CID 20214857.
- ^ Макилдафф, Кортни Э; Рутково, Сьюард Б. (01.01.2011). «Критическая оценка использования альфа-липоевой кислоты (тиоктовой кислоты) в лечении симптоматической диабетической полинейропатии». Терапия и управление клиническими рисками. 7: 377–385. Дои:10.2147 / TCRM.S11325. ISSN 1176-6336. ЧВК 3176171. PMID 21941444.
- ^ Ziegle, D .; Релянович, М; Mehnert, H; Грис, Ф.А. (1999). «α-Липоевая кислота в лечении диабетической полинейропатии в Германии». Экспериментальная и клиническая эндокринология и диабет. 107 (7): 421–30. Дои:10.1055 / с-0029-1212132. PMID 10595592.
- ^ «Липоевая кислота». Американское онкологическое общество. Ноябрь 2008 г.. Получено 5 октября 2013.
- ^ Джавед, S; Петропулос, Индиана; Алам, У; Малик, РА (январь 2015 г.). «Лечение болезненной диабетической невропатии». Терапевтические достижения при хронических заболеваниях. 6 (1): 15–28. Дои:10.1177/2040622314552071. ЧВК 4269610. PMID 25553239.
- ^ Пфеффер Г, Маджамаа К., Тернбулл Д.М., Торберн Д., Чиннери П.Ф. (апрель 2012 г.). «Лечение митохондриальных нарушений». Кокрановская база данных Syst Rev (4): CD004426. Дои:10.1002 / 14651858.CD004426.pub3. ЧВК 7201312. PMID 22513923.
- ^ Намази, Назли; Лариджани, Багер; Азадбахт, Лейла (2018). «Добавка альфа-липоевой кислоты в лечении ожирения: систематический обзор и метаанализ клинических испытаний». Клиническое питание. 37 (2): 419–428. Дои:10.1016 / j.clnu.2017.06.002. ISSN 0261-5614. PMID 28629898.
внешняя ссылка
 СМИ, связанные с Липоевая кислота в Wikimedia Commons
СМИ, связанные с Липоевая кислота в Wikimedia Commons
