Субтилизин - Subtilisin
| Пептидаза S8, связанная с субтилизином | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Символ | Пептидаза_S8 | ||||||||
| Pfam | PF00082 | ||||||||
| ИнтерПро | IPR015500 | ||||||||
| PROSITE | PDOC00125 | ||||||||
| CATH | 1cse | ||||||||
| SCOP2 | 1cse / Объем / СУПФАМ | ||||||||
| CDD | cd07477 | ||||||||
| |||||||||
| Субтилизин БПН | |||||||
|---|---|---|---|---|---|---|---|
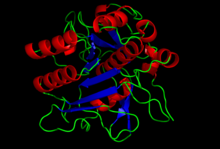 Кристальная структура субтилизина S8 домена.[1] | |||||||
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | апр | ||||||
| Количество CAS | 9014-01-1 | ||||||
| Entrez | 5712479 | ||||||
| PDB | 1-е 2 Больше структур | ||||||
| UniProt | P00782 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 3.4.21.62 | ||||||
| |||||||
| GO: 0004252 | |||||||
Субтилизин это протеаза (а переваривание белков фермент ) первоначально полученный из Bacillus subtilis.[2][3][4][5][6][7][8]
Субтилизины относятся к subtilases, группа сериновые протеазы которые, как и все сериновые протеазы, инициируют нуклеофильный нападение на пептид (амидная) связь через серин остаток на активный сайт. Субтилизины обычно имеют молекулярную массу 27 кДа. Их можно получить из определенных типов почва бактерии, Например, Bacillus amyloliquefaciens из которых они выделяются в больших количествах.
Номенклатура
Субтилизин также коммерчески известен как Алькалаза®, Alcalase® 0,6 л, Алькалаза® 2,5 л, ALK-фермент, бациллопептидаза А, бациллопептидаза B, Биопраз щелочной протеиназы Bacillus subtilis, биопраз AL 15, биопраз APL 30, колистиназа, субтилизин J, субтилизин S41, субтилизин Сендай, субтилизин GX, субтилизин E, субтилизин BL, гененаза I, Esperase®, максатаза, термоаз ПК 10, протеаза XXVII, термоаз, сверхсильный, субтилизин DY, субтилопептидаза, SP 266, Savinase® 8.0L, Савиназа® 4.0Т, казусасэ, протеаза VIII, оптик, Щелочная протеиназа Bacillus subtilis, протин A 3L, Савиназа®, Савиназа® 16,0 л, Савиназа® 32,0 л EX, orientase 10B, протеаза S). Это тип серинэндопептидаза семейства MEROPS S8.
Структура
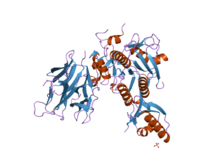
Структура субтилизина была определена Рентгеновская кристаллография. Зрелая форма состоит из 275 остатков. глобулярный белок с несколькими альфа-спирали, и большой бета-лист. N-конец содержит пропетидный домен I9 (ИнтерПро: IPR010259 ), который способствует сворачиванию субтилизина. Протеолитическое удаление домена активирует фермент. Это структурно не связано с химотрипсин -клановых сериновых протеаз, но использует тот же тип каталитическая триада в активный сайт. Это делает его классическим примером конвергентная эволюция.
Механизм катализа
Активный сайт имеет сеть реле заряда, включающую Asp-32, His-64 и активный сайт Ser-221, организованные в виде каталитическая триада. Сеть реле заряда функционирует следующим образом: карбоксилатная боковая цепь водородных связей Asp-32 с азотсвязанным протоном на His-64. имидазол звенеть. Это возможно, потому что Asp отрицательно заряжен физиологически. pH. Другой азот на His-64 водородными связями с протоном O-H Ser-221. Это последнее взаимодействие приводит к разделению зарядов O-H, при этом атом кислорода более нуклеофильный. Это позволяет атому кислорода Ser-221 атаковать входящие субстраты (т.е. пептидные связи), чему способствует соседняя карбоксиамидная боковая цепь Asn-155.
Несмотря на то, что Asp-32, His-64 и Ser-221 последовательно далеко друг от друга, они сходятся в 3D структура для формирования активного сайта.
Подводя итог описанным выше взаимодействиям, Ser-221 действует как нуклеофил и раскалывает пептидные связи с частично отрицательным атомом кислорода. Это возможно из-за природы участка ретрансляции заряда субтилизина.
Приложения
Инструмент исследования
В молекулярной биологии используют Б. subtilis как модельный организм, ген, кодирующий субтилизин (апрель) часто является вторым предпочтительным геном после Эми для интеграции репортерных конструкций в, благодаря своей необязательности.
Коммерческий
На основе белков субтилизины широко используются в коммерческих продуктах (нативный фермент легко инактивируется моющими средствами и высокими температурами) и также называется пятновыводителем, например, в прачечной.[9] и мытье посуды моющие средства, косметика, переработка пищевых продуктов,[10] мази по уходу за кожей,[11] контактные линзы чистящие средства, и для исследований в синтетическая органическая химия.
Охрана труда
Люди могут подвергаться воздействию субтилизина на рабочем месте при вдыхании, глотании, контакте с кожей и глазами. В Национальный институт охраны труда и здоровья (NIOSH) установил рекомендуемый предел воздействия (REL) 0,00006 мг / м3 за 60-минутный период.[12]
Субтилизин может вызвать «ферментно-детергентную астму». Люди, чувствительные к субтилизину (алькалазе), обычно также имеют аллергию на бактерии Bacillus subtilis. [13]
Рекомендации
- ^ PDB: 1-е 2; Ботт Р., Ультч М., Коссякофф А., Грейкар Т., Кац Б., Пауэр С. (июнь 1988 г.). «Трехмерная структура субтилизина Bacillus amyloliquefaciens при 1,8 А и анализ структурных последствий инактивации пероксида». Журнал биологической химии. 263 (16): 7895–906. PMID 3286644.
- ^ Оттесен М., Свендсен И. (1970). «Субтилизины». Методы Энзимол. 19: 199–215. Дои:10.1016/0076-6879(70)19014-8.
- ^ Маркланд Ф. С., Смит Е. Л. (1971). «Субтилизины: первичная структура, химические и физические свойства». В Boyer PD (ред.). Ферменты. 3 (3-е изд.). Нью-Йорк: Academic Press. С. 561–608.
- ^ Филипп М, Бендер МЛ (1983). «Кинетика субтилизина и тиолсубтилизина». Молекулярная и клеточная биохимия. 51 (1): 5–32. Дои:10.1007 / bf00215583. PMID 6343835.
- ^ Недков П., Обертюр В., Брауницер Г. (апрель 1985 г.). «Определение полной аминокислотной последовательности субтилизина DY и ее сравнение с первичными структурами субтилизинов BPN ', Carlsberg и amylosacchariticus». Биологическая химия Хоппе-Зейлер. 366 (4): 421–30. Дои:10.1515 / bchm3.1985.366.1.421. PMID 3927935.
- ^ Икемура Х., Такаги Х., Иноуэ М. (июнь 1987 г.). «Необходимость пропоследовательности для продукции активного субтилизина Е в Escherichia coli». Журнал биологической химии. 262 (16): 7859–64. PMID 3108260.
- ^ Полгар Л. (1987). «Структура и функция сериновых протеаз». В Brocklehurst K, Neuberger A (ред.). Гидролитические ферменты. Амстердам: Эльзевир. ISBN 0-444-80886-8.
- ^ Васанта Н., Томпсон Л.Д., Родос С., Баннер С., Нэгл Дж., Филпула Д. (сентябрь 1984 г.). «Гены щелочной протеазы и нейтральной протеазы из Bacillus amyloliquefaciens содержат большую открытую рамку считывания между областями, кодирующими сигнальную последовательность и зрелый белок». Журнал бактериологии. 159 (3): 811–9. Дои:10.1128 / JB.159.3.811-819.1984. ЧВК 215730. PMID 6090391.
- ^ «Содержимое моющего средства для стирки Spar».
- ^ Чаплин М. (20 декабря 2004 г.). «Применение протеаз в пищевой промышленности». Лондонский университет Южного берега. Архивировано из оригинал на 2010-03-14. Получено 3 марта 2015.
- ^ «Мазь Callex®». Архивировано из оригинал на 2008-02-03. Получено 3 марта 2015.
- ^ "CDC - Карманный справочник NIOSH по химической опасности - субтилизины". www.cdc.gov. Получено 2015-11-21.
- ^ Словарь Мосби по медицине, сестринскому делу и смежным вопросам здоровья, 14-е издание, стр. 557
