Пролилэндопептидаза - Prolyl endopeptidase
Пролилэндопептидаза (PE) также известный как пролилолигопептидаза или же фермент, расщепляющий постпролин является фермент что у людей кодируется ПОДГОТОВКА ген.[4][5]
Функция
| пролилолигопептидаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 3.4.21.26 | ||||||||
| Количество CAS | 72162-84-6 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Пролилэндопептидаза представляет собой большую цитозольную фермент который принадлежит к особому классу серин пептидазы. Впервые он был описан в цитозоле мозга кролика как олигопептидаза, который разрушает нонапептид брадикинин на облигации Pro-Phe.[6] Фермент участвует в созревании и деградации пептидные гормоны и нейропептиды Такие как альфа-меланоцит-стимулирующий гормон, лютеинизирующий гормон-рилизинг-гормон (LH-RH), тиреотропин-рилизинг-гормон, ангиотензин, нейротензин, окситоцин, вещество P и вазопрессин. PREP расщепляет пептидные связи на C-терминал сторона пролин остатки. Его активность ограничивается действием на олигопептиды менее 10 кДа, и он абсолютно необходим для транс-конфигурации пептидная связь предшествующий пролин.
Пролилэндопептидазы участвуют в созревании и деградации пептида. гормоны и нейропептиды.[5]
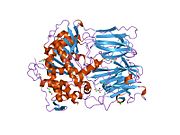
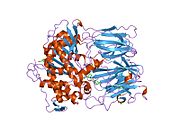
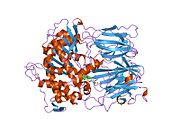
Структура
Пролилэндопептидаза - это цитозольная пролилэндопептидаза, которая расщепляет пептид связи на С-конце пролиловых остатков в пептидах, которые составляют примерно до 30 аминокислоты длинный. Только короткие белковые остатки способны проникать в активный центр пролилэндопептидазы из-за четкого бета-винт область, которая действует как механизм стробирующего фильтра.[7][8]
Клиническое значение
Измененная активность PREP может быть связана с расстройства аутистического спектра и различные психологические заболевания, такие как шизофрения, мания и клиническая депрессия.[9]
Однако существует противоречивая информация относительно точной роли, которую пролилэндопептидаза играет в патофизиологии депрессии, при этом более ранние исследования документально подтверждают это. уменьшился активность фермента у пациентов с депрессией, но более поздние исследования демонстрируют, что торможение того же фермента фактически приводит к облегчению симптомов депрессии.[10][11]
Некоторые типы пролилэндопептидазы использовались в исследованиях для снижения склонности к глютен -содержащий пшеница продукты для обострения глютеновая болезнь.[12] Однако ферменты, вводимые перорально, потенциально подвергаются инактивации в желудочно-кишечном тракте.[13]
Ингибиторы
Известно несколько ингибиторов пролилэндопептидазы,[14][15] и были предложены как возможные ноотропный и антидепрессант наркотики.[16][17] Известные соединения включают
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000085377 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Ванхуф Г., Гуссенс Ф., Хендрикс Л., Де Мистер I, Хендрикс Д., Вринд Г., Ван Брокховен С., Шарп С. (декабрь 1994 г.). «Клонирование и анализ последовательности гена, кодирующего пролилэндопептидазу лимфоцитов человека». Ген. 149 (2): 363–6. Дои:10.1016/0378-1119(94)90177-5. PMID 7959018.
- ^ а б «Ген Entrez: пролилэндопептидаза PREP».
- ^ Oliveira EB, Martins AR, Camargo AC (май 1976 г.). «Выделение эндопептидаз мозга: влияние размера и последовательности субстратов, структурно связанных с брадикинином». Биохимия. 15 (9): 1967–74. Дои:10.1021 / bi00654a026. PMID 5120.
- ^ Fülöp V, Böcskei Z, Polgár L (июль 1998 г.). «Пролилолигопептидаза: необычный бета-пропеллерный домен регулирует протеолиз». Клетка. 94 (2): 161–70. Дои:10.1016 / S0092-8674 (00) 81416-6. PMID 9695945. S2CID 17074611.
- ^ Fülöp V, Szeltner Z, Polgár L (сентябрь 2000 г.). «Катализ сериновых олигопептидаз контролируется механизмом стробирующего фильтра». EMBO Rep. 1 (3): 277–81. Дои:10.1093 / embo-reports / kvd048. ЧВК 1083722. PMID 11256612.
- ^ Момени Н., Нордстрем Б.М., Хорстманн В., Аварсейи Х., Сивберг Б.В. (2005). «Нарушение активности пролилэндопептидазы в плазме крови у детей с расстройствами аутистического спектра». BMC Psychiatry. 5: 27. Дои:10.1186 / 1471-244X-5-27. ЧВК 1190193. PMID 15932649.
- ^ Маес М., Гуссенс Ф., Шарпе С., Калабрез Дж., Деснидер Р., Мельцер Х.Ю. (1995). «Изменения активности пролилэндопептидазы плазмы при депрессии, мании и шизофрении: эффекты антидепрессантов, стабилизаторов настроения и антипсихотических препаратов». Психиатрия Res. 58 (3): 217–25. Дои:10.1016 / 0165-1781 (95) 02698-В. PMID 8570777. S2CID 42691937.
- ^ Хлебникова Н.Н., Крупина Н.А., Кушнарева Е.Ю., Золотов Н.Н., Крыжановский Г.Н. (2012). «Влияние имипрамина и ингибитора пролилэндопептидазы бензилоксикарбонил-метионил-2 (S) -цианопирролидина на активность пролинспецифических пептидаз в головном мозге крыс с экспериментальным тревожно-депрессивным синдромом». Булл Эксп Биол Мед. 152 (4): 409–12. Дои:10.1007 / s10517-012-1540-z. PMID 22803098. S2CID 15088734.
- ^ Степняк Д., Спений-Деккинг Л., Митеа С. и др. (Октябрь 2006 г.). «Высокоэффективная деградация глютена с помощью недавно идентифицированной пролилэндопротеазы: последствия для целиакии». Am J Physiol Gastrointest Liver Physiol. 291 (4): G621–9. Дои:10.1152 / ajpgi.00034.2006. PMID 16690904.
- ^ Fuhrmann G, Leroux JC (май 2011 г.). «Флуоресцентная визуализация in vivo активности экзогенных ферментов в желудочно-кишечном тракте». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 108 (22): 9032–7. Bibcode:2011PNAS..108.9032F. Дои:10.1073 / pnas.1100285108. ЧВК 3107327. PMID 21576491.
- ^ Ярхо Е.М., Веняляйнен Дж. И., Путиайнен С. и др. (Март 2007 г.). «2 (S) - (Циклоалк-1-енкарбонил) -1- (4-фенилбутаноил) пирролидины и 2 (S) - (ароил) -1- (4-фенилбутаноил) пирролидины в качестве ингибиторов пролилолигопептидазы». Биоорг. Med. Chem. 15 (5): 2024–31. Дои:10.1016 / j.bmc.2006.12.036. PMID 17215128.
- ^ Kánai K, Arányi P, Böcskei Z, et al. (Декабрь 2008 г.). «Ингибирование пролилолигопептидазы молекулами типа N-ацилпропирролидина». J. Med. Chem. 51 (23): 7514–22. Дои:10.1021 / jm800944x. PMID 19006380.
- ^ Морейн П., Боэкинга PH, Демазьер А., Де Нантей Дж., Лютрингер Р. (2007). «Психотропный профиль S 17092, ингибитора пролилэндопептидазы, с использованием количественной ЭЭГ у молодых здоровых добровольцев». Нейропсихобиология. 55 (3–4): 176–83. Дои:10.1159/000107070. PMID 17700042. S2CID 27856130.
- ^ Хлебникова Н.Н., Крупина Н.А., Богданова Н.Г., Золотов Н.Н., Крыжановский Г.Н. (январь 2009 г.). «Влияние ингибитора пролилендопептидазы бензилоксикарбонил-метионил-2 (S) -цианопирролидина на развитие экспериментального депрессивного синдрома у крыс». Бык. Exp. Биол. Med. 147 (1): 26–30. Дои:10.1007 / s10517-009-0458-6. PMID 19526123. S2CID 25448235.
- ^ Йошимото Т., Кадо К., Мацубара Ф., Корияма Н., Кането Х., Цура Д. (декабрь 1987 г.). «Специфические ингибиторы пролилэндопептидазы и их антиамнестический эффект». J. Pharmacobio-Dyn. 10 (12): 730–5. Дои:10.1248 / bpb1978.10.730. PMID 3330562.
- ^ Tarragó T, Kichik N, Claasen B, Prades R, Teixidó M, Giralt E (август 2008 г.). «Байкалин, пролекарство, способное достигать ЦНС, является ингибитором пролилолигопептидазы». Биоорг. Med. Chem. 16 (15): 7516–24. Дои:10.1016 / j.bmc.2008.04.067. PMID 18650094.
- ^ Тоиде К., Шинода М., Миядзаки А. (1998). «Новый ингибитор пролилэндопептидазы, JTP-4819 - его поведенческие и нейрохимические свойства для лечения болезни Альцгеймера». Rev Neurosci. 9 (1): 17–29. Дои:10.1515 / revneuro.1998.9.1.17. PMID 9683325. S2CID 24450362.
- ^ Ялканен А.Дж., Путтонен К.А., Веналайнен Дж.И., Синерва В., Маннила А., Руотсалайнен С., Ярхо Е.М., Валлен Е.А., Мяннистё П.Т. (февраль 2007 г.). «Благоприятный эффект ингибирования пролилолигопептидазы на пространственную память у молодых, но не у старых крыс, получавших скополамин». Basic Clin. Pharmacol. Токсикол. 100 (2): 132–8. Дои:10.1111 / j.1742-7843.2006.00021.x. PMID 17244263.
- ^ Морейн П., Лестаж П., Де Нантей Дж., Йохемсен Р., Робин Дж. Л., Гез Д., Бойер П. А. (2002). «S 17092: ингибитор пролилэндопептидазы как потенциальный терапевтический препарат при нарушении памяти. Доклинические и клинические исследования». Препарат для ЦНС. 8 (1): 31–52. Дои:10.1111 / j.1527-3458.2002.tb00214.x. ЧВК 6741683. PMID 12070525.
внешняя ссылка
- пролил + эндопептидаза, + человек в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Запись пролилэндопептидазы в Национальном центре биотехнологической информации
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для пролилэндопептидазы человека