Протеаза - Википедия - Protease

А протеаза (также называемый пептидаза или же протеиназа) является фермент который катализирует (увеличивает скорость) протеолиз, разбивка белки на меньшие полипептиды или один аминокислоты. Они делают это, раскалывая пептидные связи внутри белков гидролиз, реакция, при которой вода разрывает связи. Протеазы участвуют во многих биологических функциях, включая пищеварение проглоченных белков, катаболизм белков (расщепление старых белков),[1][2] и клеточная сигнализация.
Без дополнительных вспомогательных механизмов протеолиз был бы очень медленным, на сотни лет.[3] Протеазы можно найти во всех формах жизни и вирусы. Они самостоятельно эволюционировал несколько раз, и разные классы протеаз могут выполнять одну и ту же реакцию совершенно разными каталитические механизмы.
Иерархия протеаз
На основе каталитического остатка
Протеазы можно разделить на семь широких групп:[4]
- Сериновые протеазы - с использованием серина алкоголь
- Цистеиновые протеазы - с использованием цистеина тиол
- Треониновые протеазы - с использованием треонина вторичный спирт
- Аспарагиновые протеазы - используя аспартат карбоновая кислота
- Глутаминовые протеазы - с использованием глутамата карбоновая кислота
- Металлопротеазы - используя металл, обычно цинк[1][2]
- Аспарагиновые пептидные лиазы - используя аспарагин выполнить реакция элиминации (не требует воды)
В 1993 году протеазы были впервые сгруппированы в 84 семейства в соответствии с их эволюционным родством и классифицированы по четырем каталитическим типам: сериновые, цистеиновые, аспарагиновые и металлопротеазы.[5] В треонин и глютаминовая кислота протеазы не были описаны до 1995 и 2004 гг. соответственно. Механизм, используемый для раскалывания пептидная связь предполагает создание аминокислота остаток, который имеет цистеин и треонин (протеазы) или молекула воды (аспарагиновая кислота, металло- и кислотные протеазы) нуклеофильны, так что они могут атаковать пептид карбоксил группа. Один из способов сделать нуклеофил - это каталитическая триада, где гистидин остаток используется для активации серин, цистеин, или же треонин как нуклеофил. Однако это не эволюционная группировка, поскольку типы нуклеофилов имеют развивались конвергентно в разных надсемейства, а некоторые суперсемейства демонстрируют дивергентную эволюцию до нескольких разных нуклеофилов.
Пептидные лиазы
Седьмой каталитический тип протеолитических ферментов, аспарагинпептидлиаза, был описан в 2011 году. Его протеолитический механизм необычен, поскольку гидролиз, он выполняет реакция элиминации.[6] Во время этой реакции каталитический аспарагин образует циклическую химическую структуру, которая расщепляется по остаткам аспарагина в белках при правильных условиях. Учитывая его принципиально иной механизм, его включение в качестве пептидазы может быть спорным.[6]
Эволюционная филогения
Современная классификация эволюционных протеаз надсемейства находится в базе данных MEROPS.[7] В этой базе данных протеазы классифицируются в первую очередь по кланам (надсемейство ) на основе структуры, механизма и порядка каталитического остатка (например, Клан ПА где P означает смесь семейств нуклеофилов). Внутри каждого «клана» протеазы подразделяются на семьи на основе сходства последовательностей (например, семейства S1 и C3 в клане PA). Каждое семейство может содержать многие сотни связанных протеаз (например, трипсин, эластаза, тромбин и стрептогризин внутри семейства S1).
В настоящее время известно более 50 кланов, каждый из которых указывает на независимое эволюционное происхождение протеолиза.[7]
Классификация на основе оптимального pH
В качестве альтернативы протеазы можно классифицировать по оптимальному pH в которых они активны:
- Кислотные протеазы
- Нейтральные протеазы участвует в гиперчувствительность 1 типа. Здесь он выпущен тучные клетки и вызывает активацию дополнять и кинины.[8] В эту группу входят Calpains.
- Основные протеазы (или же щелочные протеазы)
Ферментативная функция и механизм
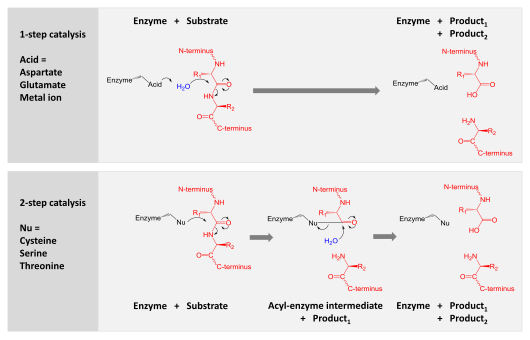
Протеазы участвуют в переваривание длинные белковые цепи на более короткие фрагменты путем расщепления пептидные связи эта ссылка аминокислота остатки. Некоторые отделяют концевые аминокислоты от белковой цепи (экзопептидазы, Такие как аминопептидазы, карбоксипептидаза А ); другие атакуют внутренние пептидные связи белка (эндопептидазы, Такие как трипсин, химотрипсин, пепсин, папаин, эластаза ).
Катализ
Катализ достигается одним из двух механизмов:
- Аспарагиновая, глутаминовая и металлопротеазы активируют молекулу воды, которая выполняет нуклеофильную атаку на пептидную связь с целью ее гидролиза.
- Сериновые, треониновые и цистеиновые протеазы используют нуклеофильный остаток (обычно в каталитическая триада ). Этот остаток выполняет нуклеофильную атаку на ковалентно связывают протеазу с белком-субстратом, высвобождая первую половину продукта. Этот ковалентный промежуточный ацил-фермент затем гидролизуется активированной водой для завершения катализа путем высвобождения второй половины продукта и регенерации свободного фермента.
Специфика
Протеолиз может быть очень беспорядочный так что гидролизуется широкий спектр белковых субстратов. Это касается пищеварительных ферментов, таких как трипсин которые должны быть способны расщеплять массив поглощенных белков на более мелкие пептидные фрагменты. Беспорядочные протеазы обычно связываются с одной аминокислотой на субстрате и поэтому обладают специфичностью только в отношении этого остатка. Например, трипсин специфичен для последовательностей ... K ... или ... R ... ('' = сайт расщепления).[9]
И наоборот, некоторые протеазы высокоспецифичны и расщепляют только субстраты с определенной последовательностью. Свертывание крови (например, тромбин ) и процессинг вирусных полипротеинов (таких как Протеаза TEV ) требует такого уровня специфичности для достижения точных событий расщепления. Это достигается за счет протеаз, имеющих длинную щель для связывания или туннель с несколькими карманами вдоль него, которые связывают указанные остатки. Например, Протеаза TEV специфичен для последовательности ... ENLYFQ S ... ('' = сайт расщепления).[10]
Деградация и автолиз
Протеазы, которые сами по себе являются белками, расщепляются другими молекулами протеаз, иногда той же разновидности. Это действует как метод регуляции активности протеаз. Некоторые протеазы менее активны после автолиза (например, Протеаза TEV ), в то время как другие более активны (например, трипсиноген ).
Биоразнообразие протеаз
Протеазы встречаются у всех организмов, начиная с прокариоты к эукариоты к вирусы. Эти ферменты участвуют во множестве физиологических реакций, от простого переваривания пищевых белков до строго регулируемых каскадов (например, каскад свертывания крови, то система комплемента, апоптоз пути и каскад активации пропенолоксидазы беспозвоночных). Протеазы могут разрывать определенные пептидные связи (ограниченный протеолиз), в зависимости от аминокислота последовательность белка или полностью расщепить пептид до аминокислот (неограниченный протеолиз). Активность может быть деструктивным изменением (отменой функции белка или его перевариванием до его основных компонентов), активацией функции или сигналом в сигнальном пути.
Растения
Растительные растворы, содержащие протеазу, называемые вегетарианский сычужный фермент сотни лет использовались в Европе и на Ближнем Востоке для изготовления кошерные и халяльные сыры. Вегетарианский сычужный фермент из Витания коагулянс использовался тысячи лет как Аюрведический средство от пищеварения и диабета на индийском субконтиненте. Он также используется для изготовления Панир.
Геномы растений кодируют сотни протеаз, функция которых в основном неизвестна. Те, у кого известная функция, в основном участвуют развивающий регулирование.[11] Протеазы растений также играют роль в регуляции фотосинтез.[12]
Животные
Протеазы используются во всем организме для различных метаболических процессов. Кислотные протеазы, секретируемые в желудок (например, пепсин ) и сериновые протеазы, присутствующие в двенадцатиперстная кишка (трипсин и химотрипсин ) позволяют нам переваривать белок, содержащийся в пище. Протеазы, присутствующие в сыворотке крови (тромбин, плазмин, Фактор Хагемана и т. д.) играют важную роль в свертывании крови, а также в лизисе сгустков и в правильной работе иммунной системы. Другие протеазы присутствуют в лейкоцитах (эластаза, катепсин G ) и играют несколько различных ролей в метаболическом контроле. Немного змеиный яд также протеазы, такие как гремучая змея гемотоксин и препятствовать каскаду свертывания крови жертвы. Протеазы определяют время жизни других белков, играющих важную физиологическую роль, таких как гормоны, антитела или другие ферменты. Это один из самых быстрых «включений» и «выключений» регуляторных механизмов в физиологии организма.
Путем сложных совместных действий протеазы могут действовать как каскад реакции, результатом которых является быстрое и эффективное усиление реакции организма на физиологический сигнал.
Бактерии
Бактерии секретируют протеазы гидролизовать пептидные связи в белках и, следовательно, расщепление белков на составляющие аминокислоты. Бактериальные и грибковые протеазы особенно важны для глобального углерод и азот циклы рециркуляции белков, и такая активность, как правило, регулируется сигналами питания в этих организмах.[13] Чистое влияние пищевой регуляции активности протеаз среди тысяч видов, присутствующих в почве, можно наблюдать на уровне всего микробного сообщества, поскольку белки расщепляются в ответ на ограничение углерода, азота или серы.[14]
Бактерии содержат протеазы, отвечающие за общий контроль качества белка (например, AAA + протеасома ) унижая развернутые или неправильно свернутые белки.
Секретируемая бактериальная протеаза также может действовать как экзотоксин и быть примером фактор вирулентности в бактериальном патогенез (Например, эксфолиативный токсин ). Бактериальные экзотоксические протеазы разрушают внеклеточные структуры.
Вирусы
В геномах некоторых вирусов кодируется один массивный полипротеин, которому нужна протеаза, чтобы расщепить его на функциональные единицы (например, вирус гепатита С вирус и пикорнавирусы ).[15] Эти протеазы (например, Протеаза TEV ) обладают высокой специфичностью и расщепляют только очень ограниченный набор последовательностей субстрата. Поэтому они являются общей целью для ингибиторы протеазы.[16][17]
Использует
Область исследования протеаз огромна. С 2004 г. ежегодно публиковалось около 8000 статей в этой области.[18] Протеазы используются в промышленности, медицине и как инструмент фундаментальных биологических исследований.[19][20]
Пищеварительные протеазы являются частью многих стиральные порошки а также широко используются в хлебопекарной промышленности в улучшитель хлеба. В медицине используются различные протеазы как для их естественной функции (например, для контроля свертывания крови), так и для полностью искусственных функций (например для направленной деградации патогенных белков). Высокоспецифичные протеазы, такие как Протеаза TEV и тромбин обычно используются для раскалывания слитые белки и Теги сходства контролируемым образом.
Ингибиторы
Активность протеаз подавляется ингибиторы протеазы.[21] Одним из примеров ингибиторов протеазы является серпин надсемейство. Это включает в себя альфа-1-антитрипсин (который защищает организм от собственных чрезмерных воздействий воспалительный протеазы), альфа-1-антихимотрипсин (что делает то же самое), С1-ингибитор (который защищает организм от чрезмерной активации собственной система комплемента ), антитромбин (защищает организм от чрезмерного коагуляция ), ингибитор активатора плазминогена-1 (который защищает организм от недостаточной коагуляции, блокируя запускаемые протеазой фибринолиз ), и нейросерпин.[22]
Природные ингибиторы протеазы включают семейство липокалин белки, которые играют роль в регуляции и дифференцировке клеток. Липофильный Было обнаружено, что лиганды, присоединенные к белкам липокалина, обладают свойствами ингибирования опухолевых протеаз. Естественный ингибиторы протеазы не следует путать с ингибиторы протеазы используется в антиретровирусной терапии. Немного вирусы, с ВИЧ / СПИД среди них зависят от протеаз в их репродуктивном цикле. Таким образом, ингибиторы протеазы разработаны как противовирусное средство средства.
Другие природные ингибиторы протеаз используются в качестве защитных механизмов. Распространенными примерами являются ингибиторы трипсина найдены в семенах некоторых растений, наиболее заметными для человека являются соевые бобы, основная продовольственная культура, где они действуют, чтобы отпугнуть хищников. Сырые соевые бобы токсичный для многих животных, включая человека, до тех пор, пока содержащиеся в них ингибиторы протеаз не будут денатурированы.
Смотрите также
- Протеаза
- Клан ПА
- Конвергентная эволюция
- Протеолиз
- Каталитическая триада
- Карта протеолиза
- Протеазы в ангиогенезе
- Интрамембранные протеазы
- Ингибитор протеазы (фармакология)
- Ингибитор протеазы (биология)
- TopFIND - база данных специфичности протеаз, субстратов, продуктов и ингибиторов
- МЕРОПЫ - База данных эволюционных групп протеаз
Рекомендации
- ^ а б Кинг, Джон V .; Liang, Wenguang G .; Scherpelz, Kathryn P .; Шиллинг, Александр Б .; Мередит, Стивен С .; Тан, Вэй-Джен (2014-07-08). «Молекулярная основа распознавания и деградации субстрата протеазой предпоследовательности человека». Структура. 22 (7): 996–1007. Дои:10.1016 / j.str.2014.05.003. ISSN 1878-4186. ЧВК 4128088. PMID 24931469.
- ^ а б Шэнь, Юэцюань; Иоахимиак, Анджей; Рознер, Марша Рич; Тан, Вэй-Джен (19.10.2006). «Структуры человеческого разлагающего инсулин фермента раскрывают новый механизм распознавания субстрата». Природа. 443 (7113): 870–874. Дои:10.1038 / природа05143. ISSN 1476-4687. ЧВК 3366509. PMID 17051221.
- ^ Радзичка А., Вольфенден Р. (июль 1996 г.). "Скорости некаталитического гидролиза пептидных связей в нейтральном растворе и переходное состояние сродства протеаз". JACS. 118 (26): 6105–6109. Дои:10.1021 / ja954077c.
- ^ Ода К. (2012). «Новые семейства карбоксилпептидаз: серин-карбоксилпептидазы и глутаминовые пептидазы». Журнал биохимии. 151 (1): 13–25. Дои:10.1093 / jb / mvr129. PMID 22016395.
- ^ Роулингс Н.Д., Барретт А.Дж. (февраль 1993 г.). «Эволюционные семейства пептидаз». Биохимический журнал. 290 (Pt 1) (Pt 1): 205–18. Дои:10.1042 / bj2900205. ЧВК 1132403. PMID 8439290.
- ^ а б Ролингс Н.Д., Барретт А.Дж., Бейтман А. (ноябрь 2011 г.). «Аспарагиновые пептидные лиазы: седьмой каталитический тип протеолитических ферментов». Журнал биологической химии. 286 (44): 38321–8. Дои:10.1074 / jbc.M111.260026. ЧВК 3207474. PMID 21832066.
- ^ а б Роулингс Н.Д., Барретт А.Дж., Бейтман А. (январь 2010 г.). «MEROPS: база данных пептидаз». Нуклеиновые кислоты Res. 38 (Выпуск базы данных): D227–33. Дои:10.1093 / nar / gkp971. ЧВК 2808883. PMID 19892822.
- ^ Митчелл Р.С., Кумар В., Аббас А.К., Фаусто Н. (2007). Базовая патология Роббинса (8-е изд.). Филадельфия: Сондерс. п. 122. ISBN 978-1-4160-2973-1.
- ^ Родригес Дж., Гупта Н., Смит Р. Д., Певзнер П. А. (январь 2008 г.). «Режет ли трипсин раньше, чем пролин?». Журнал протеомных исследований. 7 (1): 300–5. Дои:10.1021 / pr0705035. PMID 18067249.
- ^ Ренике К., Спадаччини Р., Такси С. (24.06.2013). «Протеаза вируса травления табака с повышенной устойчивостью к субстрату в положении P1 '». PLOS One. 8 (6): e67915. Дои:10.1371 / journal.pone.0067915. ЧВК 3691164. PMID 23826349.
- ^ ван дер Хорн Р.А. (2008). «Протеазы растений: от фенотипов к молекулярным механизмам» (PDF). Ежегодный обзор биологии растений. 59: 191–223. Дои:10.1146 / annurev.arplant.59.032607.092835. HDL:11858 / 00-001M-0000-0012-37C7-9. PMID 18257708.
- ^ Зелиско А., Яковски Г. (октябрь 2004 г.). «Зависимая от старения деградация Lhcb3 опосредуется тилакоидной мембрано-связанной протеазой». Журнал физиологии растений. 161 (10): 1157–70. Дои:10.1016 / j.jplph.2004.01.006. PMID 15535125.
- ^ Симс Г.К. (2006). «Азотное голодание способствует биоразложению N-гетероциклических соединений в почве». Биология и биохимия почвы. 38 (8): 2478–2480. Дои:10.1016 / j.soilbio.2006.01.006.
- ^ Симс Г.К., Вандер М.М. (2002). «Протеолитическая активность при ограничении содержания азота или серы». Appl. Почва Ecol. 568: 1–5.
- ^ Тонг Л. (2002). «Вирусные протеазы». Химические обзоры. 102 (12): 4609–4626. Дои:10.1021 / cr010184f. PMID 12475203.
- ^ Скоренский М., Сеньчик М. (2013). «Вирусные протеазы как мишени для дизайна лекарств». Текущий фармацевтический дизайн. 19 (6): 1126–53. Дои:10.2174/13816128130613. PMID 23016690.
- ^ Йилмаз Н.К., Swanstrom R, Schiffer CA (июль 2016 г.). «Улучшение ингибиторов вирусной протеазы для борьбы с лекарственной устойчивостью». Тенденции в микробиологии. 24 (7): 547–557. Дои:10.1016 / j.tim.2016.03.010. ЧВК 4912444. PMID 27090931.
- ^ Барретт А.Дж., Роулингс Н.Д., Весснерд Дж.Ф. (2004). Справочник протеолитических ферментов (2-е изд.). Лондон, Великобритания: Elsevier Academic Press. ISBN 978-0-12-079610-6.
- ^ Хупер Н.М., изд. (2002). Протеазы в биологии и медицине. Лондон: Портленд Пресс. ISBN 978-1-85578-147-4.
- ^ Feijoo-Siota L, Villa TG (28 сентября 2010 г.). "Природные и созданные с помощью биотехнологии растительные протеазы промышленного применения". Пищевые и биотехнологические технологии. 4 (6): 1066–1088. Дои:10.1007 / s11947-010-0431-4.
- ^ Southan C (июль 2001 г.). «Геномный взгляд на протеазы человека как мишени для лекарств». Открытие наркотиков сегодня. 6 (13): 681–688. Дои:10.1016 / с 1359-6446 (01) 01793-7. PMID 11427378.
- ^ Puente XS, López-Otín C (апрель 2004 г.). «Геномный анализ протеаз и ингибиторов протеаз крыс». Геномные исследования. 14 (4): 609–22. Дои:10.1101 / гр.1946304. ЧВК 383305. PMID 15060002.
внешняя ссылка
| Библиотечные ресурсы о Протеаза |
- Международное общество протеолиза
- MEROPS - база данных пептидаз
- Список ингибиторов протеаз
- Прогнозирующее воздействие протеазы
- Список протеаз и их особенности (смотрите также [1] )
- Протеолиз MAP от Центра протеолитических путей
- База данных Proteolysis Cut Site - тщательно отобранные экспертные комментарии пользователей
- Графический интерфейс сайтов, вырезанных Protease
- База данных протеаз TopFIND, охватывающая сайты разрезов, субстраты и концы белков
- Протеазы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
