Катаболизм белков - Protein catabolism
В молекулярная биология, катаболизм белков это распад белки в аминокислоты и просто производные соединения, за транспорт в камеру через плазматическая мембрана и в конечном итоге для полимеризация в новые белки с помощью рибонуклеиновых кислот (РНК ) и рибосомы. Катаболизм белков, то есть распад макромолекулы, по сути пищеварение процесс.
Катаболизм белков чаще всего осуществляется неспецифическими эндо- и экзо-протеазы. Однако специфические протеазы используются для расщепления белков для регуляции и торговля белком целей. Одним из примеров является подкласс протеолитических ферменты называется олигопептидаза.
Аминокислоты, образующиеся в результате катаболизма, могут быть напрямую переработаны с образованием новых белков, преобразованы в другие аминокислоты или могут подвергаться катаболизм аминокислот превращаться в другие соединения через Цикл Кребса.[1]
Цель
Основная причина катаболизма белков заключается в том, что организмы могут преобразовывать белки в форму энергии, которую организм может использовать. Чтобы повторно использовать свои белки, бактерии или почвенные микроорганизмы посредством катаболизма белков расщепляют свои белки на отдельные аминокислоты и используются для образования бактериальных белков или окисляются для получения энергии. Чтобы преобразовать в энергию, как только белки расщепляются, они обычно дезаминированный (удаление аминогруппы), чтобы их можно было преобразовать в Цикл Кребса / лимонной кислоты (TCA). При переходе в цикл лимонной кислоты исходные белки будут преобразованы в полезную энергию для организма.[1]
Существуют также другие процессы преобразования аминокислот в пригодные для использования молекулы для вступления в цикл TCA, такие как трансаминирование (перенос аминогруппы), декарбоксилирование (удаление карбоксильной группы) и дегидрирование (удаление водорода).[1]
Белки перевариваются в кишечнике с образованием аминокислот. Белки непрерывно расщепляются и реформируются в зависимости от текущих потребностей организма. У белков разные период полураспада:[2] у некоторых невероятно короткий период полураспада, у других - более длинный. Те, у кого короткий период полураспада, в основном используются в метаболических путях или процессах, потому что они помогают клетке постоянно и быстро приспосабливаться к изменениям, которые происходят из-за этих процессов.[3][4]
Деградация белков
Распад белков происходит внутри клеток, поскольку аминокислоты должны пройти через определенные мембраны, прежде чем их можно будет использовать для различных процессов. Этот первый шаг к катаболизму белка - это расщепление белка на аминокислоты путем расщепления их пептидных связей, также известных как протеолиз. В пептидные связи разбиты протеасома, который способен гидролизовать пептидные связи, используя энергию АТФ. Этому процессу дополнительно способствует использование ферментов, называемых протеазы. Протеазы помогают отщеплять оставшиеся пептидные остатки с образованием отдельных аминокислот, готовых к преобразованию в пригодные для использования молекулы для гликолиза или цикла TCA, для производства энергии для организмов или для использования для создания новых белков.[3]
Различные типы протеаз помогают расщеплять белки в разных форматах. Есть серин, аспартат, металлопротеазы, и многие другие классы. Все используют разные механизмы для расщепления пептидных связей, чтобы начать деградацию белка. Например, сериновые протеазы, Такие как трипсин, участвуют в нуклеофильной атаке гидроксильного кислорода серина на карбонильный углерод пептидной связи, чтобы разорвать эту связь. Создается промежуточное соединение ацил-фермент, и механизм продолжает гидролизовать другие оставшиеся связи.[5] С другой стороны, металлопротеазы, такие как протеазы цинка, включают металлы для разрыва связей. В случае цинка его активный центр включает ион цинка, воду и гистидины (которые являются лиганды к иону цинка). Цинковая протеаза также участвует в нуклеофильной атаке, но на карбонильный углерод, используя атом кислорода воды. Основание активного центра помогает этому процессу, забирая протон из этой воды.[6]
У некоторых организмов, таких как бактерии, белки должны подвергнуться протеолизу, прежде чем аминокислоты могут быть повторно полимеризованы в новые белки, поскольку исходные белки не могут проходить через бактериальную плазматическую мембрану, поскольку они слишком велики. После того, как белки расщепляются на аминокислоты в результате протеолиза, эти аминокислоты смогут проходить через мембраны бактерий и снова собираться вместе с образованием новых белков, необходимых бактериям для функционирования.[1]
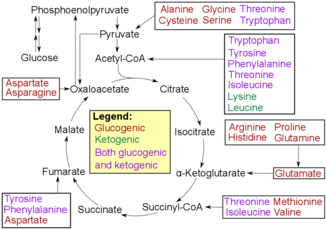
Аминокислотная деградация
Окислительное дезаминирование - это первый шаг к расщеплению аминокислот, чтобы они могли быть преобразованы в сахара. Процесс начинается с удаления аминогруппы аминокислот. Аминогруппа превращается в аммоний, поскольку он теряется и позже подвергается цикл мочевины превращаться в мочевину в печени. Затем он попадает в кровоток, где попадает в почки, которые выделяют мочевину в виде мочи.[7][8] Оставшаяся часть аминокислоты окисляется, что приводит к альфа-кетокислота. Затем альфа-кетокислота перейдет в цикл TCA, чтобы производить энергию. Кислота также может попадать гликолиз, где он будет преобразован в пируват. Затем пируват превращается в ацетил-КоА так что он может войти в цикл TCA и преобразовать исходные молекулы пирувата в АТФ или полезную энергию для организма.[9]
Трансаминирование приводит к тому же конечному результату, что и дезаминирование: оставшаяся кислота подвергается либо гликолизу, либо циклу TCA для производства энергии, которую организм будет использовать для различных целей. Этот процесс передает аминогруппу вместо потери аминогруппы, которая превращается в аммоний. Аминогруппа переходит в альфа-кетоглутарат, так что его можно преобразовать в глутамат. Затем глутамат переносит аминогруппу на оксалоацетат. Этот перенос таков, что оксалоацетат может быть преобразован в аспартат или другие аминокислоты. В конце концов, этот продукт также подвергнется окислительному дезаминированию, чтобы снова произвести альфа-кетоглутарат, альфа-кетокислоту, которая будет проходить цикл TCA, и аммоний, который в конечном итоге подвергнется циклу мочевины.[3]
Трансаминазы представляют собой ферменты, которые помогают катализировать реакции, происходящие при переаминировании. Они помогают катализировать реакцию в момент, когда аминогруппа переносится с исходной аминокислоты, такой как глутамат, на альфа-кетоглутарат, и удерживают ее, чтобы передать ее другой альфа-кетокислоты.[3]
Факторы, определяющие общую ставку
Некоторые ключевые факторы, определяющие общую скорость, включают период полувыведения белка, pH и температуру.
Период полувыведения белка помогает определить общую скорость, поскольку он обозначает первый шаг катаболизма белка. В зависимости от того, короткий или длинный этот шаг, повлияет на остальной метаболический процесс. Один из ключевых компонентов в определении периода полужизни белка основан на N-конец правило. Это означает, что аминокислота, присутствующая в N-конец белка помогает определить период полураспада белка.[10]
Изменения pH и температуры молекулярной среды также могут помочь определить общую скорость. Процесс, который расщепляет пептидные связи белка, протеолиз, чувствителен к изменениям pH и температуры. При низком pH и высоких температурах протеолиз может начаться даже без фермента. Это поможет ускорить общую скорость, поскольку дает те же результаты, что и добавление фермента, но без необходимости использования фермента.[11]
Смотрите также
Рекомендации
- ^ а б c d Бауман, Роберт В .; Мачунис-Масуока, Элизабет; Тизард, Ян Р. (2004-01-01). Микробиология. Пирсон / Бенджамин Каммингс. ISBN 9780805376524.
- ^ Чжоу, Пэнбо (2004-01-01). «Определение периода полужизни белка». В Диксоне, RobertC .; Менденхолл, МайклД. (ред.). Протоколы передачи сигналов. Методы молекулярной биологии. 284. Humana Press. С. 67–77. Дои:10.1385/1-59259-816-1:067. ISBN 9781588292452. PMID 15173609.
- ^ а б c d Майлз, Брайант (9 апреля 2003 г.). «Катаболизм белков» (PDF). Архивировано из оригинал (PDF) 12 августа 2014 г.
- ^ Бойковска, Каролина; Сантони де Сио, Франческа; Барде, Изабель; Оффнер, Сандра; Верп, Соня; Хейнис, Кристиан; Джонссон, Кай; Троно, Дидье (2011-06-24). «Измерение периода полужизни белка in vivo». Химия и биология. 18 (6): 805–815. Дои:10.1016 / j.chembiol.2011.03.014. PMID 21700215.
- ^ Воет, Д. (01.01.2004). Биохимия Д. Воэта 3-я (3-е изд.). Вайли.
- ^ Эрез, Элинор; Фасс, Дебора; Биби, Эйтан (2009). «Как внутримембранные протеазы скрывают гидролитические реакции в мембране». Природа. 459 (7245): 371–378. Дои:10.1038 / природа08146. PMID 19458713. S2CID 205217365.
- ^ «26.9: Катаболизм белков». Химия LibreTexts. 2014-06-19. Получено 2016-10-25.
- ^ «Окислительное дезаминирование». chemistry.elmhurst.edu. Получено 2016-10-25.
- ^ «ГЛИКОЛИЗ И ЦИКЛ КРЕБСА». homepage.smc.edu. Получено 2016-11-08.
- ^ Тасаки, Такафуми; Sriram, Shashikanth M .; Пак, Кён Су; Квон, Ён Тэ (2012-06-04). "Путь правила N-конца". Ежегодный обзор биохимии. 81 (1): 261–289. Дои:10.1146 / annurev-biochem-051710-093308. ISSN 0066-4154. ЧВК 3610525. PMID 22524314.
- ^ de Giori, G.S .; Вальдес, Г.Ф. де; Ольгадо, А.П. де Руис; Оливер, Г. (1985). «Влияние pH и температуры на протеолитическую активность молочнокислых бактерий». Журнал молочной науки. 68 (9): 2160–2164. Дои:10.3168 / jds.s0022-0302 (85) 81085-7.
