Цикл мочевины - Urea cycle
В цикл мочевины (также известный как орнитиновый цикл) представляет собой цикл биохимический реакции, которые вызывают мочевина (NH2)2CO из аммиак (NH3). Этот цикл происходит в уреотелический организмы. Цикл мочевины превращает высокотоксичный аммиак в мочевину для экскреции.[1] Этот цикл был первым открытым метаболическим циклом (Ганс Кребс и Курт Хенселейт, 1932), за пять лет до открытия Цикл TCA. Более подробно этот цикл был описан позже Ратнером и Коэном. Цикл мочевины происходит в основном в печень и, в меньшей степени, в почки.
Функция
Катаболизм аминокислот приводит к отходам аммиака. Всем животным нужен способ выведения этого продукта из организма. Наиболее водные организмы, или же аммонотелик организмы выделяют аммиак, не превращая его.[1] Организмы, которые не могут легко и безопасно удалить азот, поскольку аммиак превращает его в менее токсичное вещество, такое как мочевина через цикл мочевины, который происходит в основном в печени. Вырабатываемая печенью мочевина попадает в кровоток, куда он направляется в почки и в конечном итоге выводится из организма моча. Цикл мочевины важен для этих организмов, потому что, если азот или аммиак не удаляются из организма, это может быть очень вредным.[2] У видов, включая птицы и большинство насекомые аммиак превращается в мочевая кислота или его урат соль, которая выделяется в твердая форма.
Реакции
Весь процесс преобразует две аминогруппы, одну из NH+
4 и один из Аспартат, и атом углерода из HCO−
3, к относительно нетоксичному продукту экскреции мочевина.[3] Это происходит за счет четырех «высокоэнергетических» фосфат связи (3 АТФ гидролизуются до 2 ADP и один AMP ). Превращение аммиака в мочевину происходит в пять основных этапов. Первый необходим для того, чтобы аммиак вступил в цикл, а следующие четыре являются частью самого цикла. Чтобы войти в цикл, аммиак превращается в карбамоилфосфат. Цикл мочевины состоит из четырех ферментативных реакций: одна митохондриальный и три цитозольный.[1][4] Это использует 6 ферментов.[3][4][5]
| Шаг | Реагенты | Товары | Катализируется | Место расположения |
|---|---|---|---|---|
| 1 | NH3 + HCO− 3 + 2АТФ | карбамоилфосфат + 2ADP + пя | CPS1 | митохондрии |
| 2 | карбамоилфосфат + орнитин | цитруллин + Pя | Внебиржевой, цинк, биотин | митохондрии |
| 3 | цитруллин + аспартат + АТФ | аргининосукцинат + AMP + PPя | ЖОПА | цитозоль |
| 4 | аргининосукцинат | аргинин + фумарат | ASL | цитозоль |
| 5 | аргинин + H2О | орнитин + мочевина | ARG1, марганец | цитозоль |
- Реакции цикла мочевины
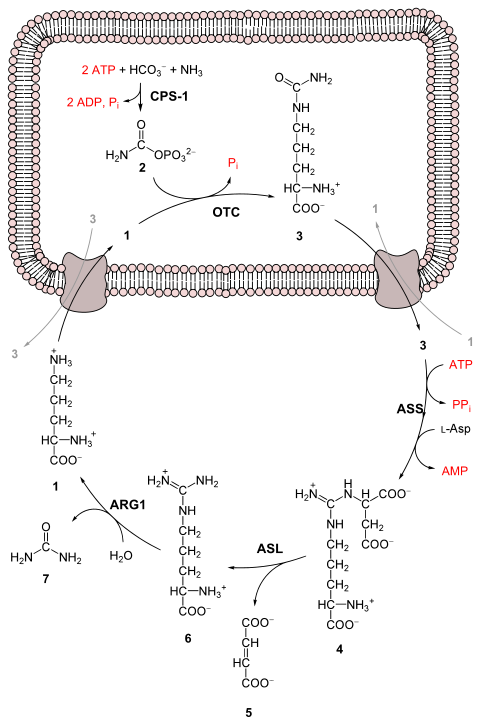
1 L-орнитин
2 карбамоилфосфат
3 L-цитруллин
4 аргининосукцинат
5 фумарат
6 L-аргинин
7 мочевина
L-Asp L-аспартат
CPS-1 карбамоилфосфатсинтетаза I
Внебиржевой Орнитин-транскарбамоилаза
ЖОПА аргининосукцинатсинтетаза
ASL аргининосукцинатлиаза
ARG1 аргиназа 1
Первая реакция: вход в цикл мочевины
Перед началом цикла карбамида аммиак превращается в карбамоилфосфат. Реакция катализируется карбамоилфосфатсинтетаза I и требует использования двух АТФ молекулы.[1] Затем карбамоилфосфат входит в цикл мочевины.
Этапы цикла мочевины
- Карбамоилфосфат превращается в цитруллин. С катализом орнитин-транскарбамоилаза карбамоилфосфатная группа отдается орнитину и высвобождает фосфатную группу.[1]
- А реакция конденсации происходит между аминогруппой аспартата и карбонильной группой цитруллина с образованием аргининосукцинат. Эта реакция является АТФ-зависимой и катализируется аргининосукцинатсинтетаза.[1]
- Аргининосукцинат расщепляется аргининосукциназа формировать аргинин и фумарат.[1]
- Аргинин расщепляется аргиназа с образованием мочевины и орнитина. Затем орнитин транспортируется обратно в митохондрии, чтобы снова начать цикл мочевины.[1][4]
Общее уравнение реакции
В первой реакции NH+
4 + HCO−
3 эквивалентно NH3 + CO2 + ЧАС2О.
Таким образом, общее уравнение цикла мочевины:
Поскольку фумарат получается путем удаления NH3 из аспартата (по реакциям 3 и 4) и PPя + H2O → 2 Pя, уравнение можно упростить следующим образом:
Обратите внимание, что реакции, связанные с циклом мочевины, также вызывают производство 2 НАДН, поэтому общая реакция выделяет немного больше энергии, чем потребляет. НАДН производится двумя способами:
- Одна молекула НАДН производится ферментом глутаматдегидрогеназа в превращении глутамата в аммоний и α-кетоглутарат. Глутамат является нетоксичным носителем аминогрупп. Это обеспечивает ион аммония, используемый в первоначальном синтезе карбамоилфосфата.
- Фумарат, высвобождаемый в цитозоль, гидратируется до малат цитозольным фумараза. Затем этот малат окисляется до оксалоацетат цитозольным малатдегидрогеназа, генерируя восстановленный НАДН в цитозоле. Оксалоацетат является одной из кетокислот, предпочитаемых трансаминазы, и поэтому будет переработан в аспартат, поддерживая поток азота в цикл мочевины.
Мы можем резюмировать это, объединив реакции:
- CO2 + глутамат + аспартат + 3 АТФ + 2 НАД++ 3 часа2O → мочевина + α-кетоглутарат + оксалоацетат + 2 ADP + 2 Pя + AMP + PPя + 2 НАД
Два полученных НАДН могут обеспечить энергию для образования 5 АТФ (цитозольный НАДН обеспечивает 2,5 АТФ с челноком малат-аспартат в клетке печени человека), чистое производство двух высокоэнергетических фосфатных связей для цикла мочевины. Однако если глюконеогенез происходит в цитозоле, последний восстанавливающий эквивалент используется для реверсирования GAPDH шаг вместо генерации АТФ.
Судьба оксалоацетата - либо производить аспартат путем трансаминирования, либо превращаться в фосфоенолпируват, который является подложкой для глюконеогенез.
Продукты цикла мочевины
Как указано выше, многие позвоночные животные используют цикл мочевины для создания мочевины из аммония, чтобы аммоний не повреждает организм. Хотя это полезно, цикл мочевины имеет и другие эффекты. Например: потребление двух АТФ, производство мочевины, образование H +, объединение HCO3- и NH4 + в формы, в которых он может быть регенерирован, и, наконец, потребление NH4 +.[6]
Регулирование
N-Ацетилглутаминовая кислота
Синтез карбамоилфосфата и цикл мочевины зависят от присутствия N-ацетилглутаминовая кислота (NAcGlu), который аллостерически активирует CPS1. NAcGlu является облигатным активатором карбамоилфосфатсинтетазы.[7] Синтез NAcGlu с помощью N-ацетилглутаматсинтаза (NAGS) стимулируется как Arg, аллостерическим стимулятором NAGS, так и Glu, продуктом реакций трансаминирования и одним из субстратов NAGS, оба из которых повышаются в свободном состоянии. аминокислоты возвышаются. Таким образом, Glu является не только субстратом для NAGS, но и активатором цикла мочевины.
Концентрации субстрата
Остальные ферменты цикла контролируются концентрацией их субстратов. Таким образом, наследственная недостаточность ферментов цикла, кроме ARG1 не приводят к значительному снижению выработки мочевины (если какой-либо фермент цикла полностью отсутствует, смерть наступает вскоре после рождения). Скорее, субстрат дефицитного фермента накапливается, увеличивая скорость реакции дефицита до нормальной.
Однако аномальное накопление субстрата не обходится без затрат. Концентрация субстрата повышается на всем протяжении цикла до NH+
4, в результате чего гипераммониемия (повышенный [NH+
4]п).
Хотя основная причина NH+
4 токсичность полностью не изучена, высокая [NH+
4] создает огромную нагрузку на NH+
4-система очистки, особенно в мозг (симптомы недостаточности ферментов цикла мочевины включают Интеллектуальная недееспособность и летаргия ). Эта клиринговая система включает GLUD1 и GLUL, которые уменьшают 2-оксоглутарат (2OG) и Glu бассейны. Мозг наиболее чувствителен к истощению этих бассейнов. Истощение 2OG снижает скорость TCAC, тогда как Glu одновременно нейротрансмиттер и предшественник ГАМК, еще один нейротрансмиттер. [1](стр.734)
Связь с циклом лимонной кислоты
Цикл мочевины и цикл лимонной кислоты являются независимыми циклами, но связаны между собой. Один из атомов азота в цикле мочевины получается в результате переаминирования оксалоацетата в аспартат.[8] Фумарат, полученный на третьей стадии, также является промежуточным продуктом в цикле лимонной кислоты и возвращается в этот цикл.[8]
Нарушения цикла мочевины
Нарушения цикла мочевины встречаются редко и затрагивают примерно одного из 35000 человек в Соединенные Штаты.[9] Генетические дефекты в ферментах, участвующих в цикле, может возникнуть, что обычно проявляется в течение нескольких дней после рождения.[2] Недавно родившийся ребенок обычно испытывает различные приступы рвота и периоды летаргия.[2] В конечном итоге младенец может кома и развивать повреждение мозга.[2] Новорожденные с UCD подвергаются гораздо более высокому риску осложнений или смерти из-за несвоевременной скрининговые тесты и неправильно диагностированный случаи. Наиболее частый ошибочный диагноз: неонатальный сепсис. Признаки UCD могут появиться в течение первых 2-3 дней жизни, но существующий метод получения подтверждения результатами тестов может занять слишком много времени.[10] Это потенциально может вызвать такие осложнения, как кому или смерть.[10]
Нарушения цикла мочевины также могут быть диагностированы у взрослых, и симптомы могут включать: бред эпизоды летаргия, и симптомы, похожие на Инсульт.[11] Помимо этих симптомов, если цикл мочевины начинает нарушаться в печень, пациент может получить цирроз.[12] Это также может привести к саркопения (потеря мышечной массы).[12] Мутации приводят к дефициту различных ферментов и транспортеров, участвующих в цикле мочевины, и вызывают нарушения цикла мочевины.[1] Если люди с дефектом любого из шести ферментов, используемых в цикле, принимают внутрь аминокислоты сверх того, что необходимо для минимальных суточных потребностей, полученный аммиак не сможет быть преобразован в мочевину. Эти люди могут испытать гипераммониемия, или создание промежуточного цикла.
Индивидуальные расстройства
- Дефицит N-ацетилглутаматсинтазы (NAGS)
- Дефицит карбамоилфосфатсинтетазы (CPS)
- Дефицит орнитин-транскарбамоилазы (ОТС)
- Цитруллинемия I типа (Дефицит синтазы аргининоянтарной кислоты)
- Аргинино-янтарная ацидурия (Дефицит лиазы аргинино янтарной кислоты)
- Аргининемия (Дефицит аргиназы)
- Гиперорнитинемия, гипераммониемия, синдром гомоцитруллинурии (ГГГ) (Дефицит митохондриального транспортера орнитина)[5][13]
Все дефекты цикла мочевины, кроме безрецептурного дефицита, передаются по наследству аутосомно-рецессивный манера. Дефицит ОТС передается по наследству как Х-сцепленный рецессивный расстройство, хотя у некоторых женщин могут проявляться симптомы. Большинство нарушений цикла мочевины связаны с гипераммониемия однако аргининемия и некоторые формы аргинино-янтарной ацидурии не проявляются при повышенном уровне аммиака.
Дополнительные изображения

Цикл мочевины.

Цветной цикл мочевины.
Рекомендации
- ^ а б c d е ж грамм час я Кокс, Майкл (01.01.2013). Принципы биохимии Ленингера. Фримен. ISBN 9781429234146. OCLC 901647690.
- ^ а б c d Тимочко, Джон Л .; Берг, Джереми М .; Страйер, Люберт (2013). БИОХИМИЯ Краткий курс. W.H. Фримен и компания, Нью-Йорк. п. 529. ISBN 978-1-4292-8360-1.
- ^ а б Мяу, Николас Ах; Папа, Мария Белен; Гропман, Андреа Л. (2015-01-01), Розенберг, Роджер Н .; Паскуаль, Хуан М. (ред.), "Глава 57 - Расстройства цикла мочевины", Молекулярные и генетические основы неврологических и психических заболеваний Розенберга (пятое издание), Бостон: Academic Press, стр. 633–647, Дои:10.1016 / b978-0-12-410529-4.00057-7, ISBN 978-0-12-410529-4, получено 2020-11-10
- ^ а б c Уокер, Валери (2014-01-01), Маковски, Грегори С. (ред.), «Глава третья - Метаболизм аммиака и гипераммонемические расстройства», Достижения в клинической химии, Эльзевьер, 67, стр. 73–150, Дои:10.1016 / bs.acc.2014.09.002, получено 2020-11-10
- ^ а б Перл, Филлип Л. (2017-01-01), Свайман, Кеннет Ф .; Ашвал, Стивен; Ферриеро, Донна М .; Щор, Нина Ф. (ред.), «76 - Унаследованные метаболические эпилепсии», Детская неврология Сваймана (шестое издание), Elsevier, стр. 594–599, Дои:10.1016 / b978-0-323-37101-8.00076-х, ISBN 978-0-323-37101-8, получено 2020-11-10
- ^ Аткинсон, Дэниел (20 сентября 1991 г.). «Функциональная роль мочевины у позвоночных». Физиологическая зоология (2-е изд.). Лос-Анджелес: Издательство Чикагского университета. 65 (2): 243–267. Дои:10.1086 / Physzool.65.2.30158252. JSTOR 30158252.
- ^ Kaplan Medical USMLE Step 1 Лекционные заметки по биохимии и медицинской генетике, 2010 г., стр. 261
- ^ а б Шамбо, Г. Э. (1977-12-01). «Биосинтез мочевины I. Цикл мочевины и связь с циклом лимонной кислоты». Американский журнал клинического питания. 30 (12): 2083–2087. Дои:10.1093 / ajcn / 30.12.2083. ISSN 0002-9165. PMID 337792.
- ^ Summar, Marshall L .; Кёлькер, Стефан; Фриденберг, Дебра; Ле Монс, Синтия; Хаберле, Йоханнес; Ли, Хе-Сын; Кирмс, Брайан (2013). «Частота нарушений цикла мочевины». Молекулярная генетика и метаболизм. 110 (1–2): 179–180. Дои:10.1016 / j.ymgme.2013.07.008. ISSN 1096-7192. ЧВК 4364413. PMID 23972786.
- ^ а б Мерритт, Дж. Л., Броуди, Л. Л., Пино, Г., и Ринальдо, П. (2018). Скрининг новорожденных на нарушения проксимального цикла мочевины: текущие данные, подтверждающие рекомендации по скринингу новорожденных. Молекулярная генетика и метаболизм, 124 (2), 109–113. Дои: 10.1016 / j.ymgme.2018.04.006
- ^ Джадд, Сандра (2010). Справочник по генетическим заболеваниям. Омниграфика. п. 225. ISBN 978-0-7808-1076-1.
- ^ а б Цю, Цзя (9 июля 2013 г.). «Гипераммонемия при циррозе вызывает регуляцию транскрипции миостатина с помощью механизма, опосредованного NF-κB». Труды Национальной академии наук Соединенных Штатов Америки. Национальная академия наук. 110 (45): 18162–18167. Bibcode:2013PNAS..11018162Q. Дои:10.1073 / pnas.1317049110. JSTOR 23754730. ЧВК 3831479. PMID 24145431.
- ^ Smith, L.D .; Гарг, У. (01.01.2017), Гарг, Уттам; Смит, Лори Д. (ред.), «Глава 5 - Цикл мочевины и другие нарушения гипераммониемии», Биомаркеры врожденных ошибок метаболизма, Сан-Диего: Elsevier, стр. 103–123, Дои:10.1016 / b978-0-12-802896-4.00004-3, ISBN 978-0-12-802896-4, получено 2020-11-10
внешняя ссылка
- Химическая логика цикла мочевины
- Основы нейрохимии - аминокислотные нарушения
| |||||||||||||||||