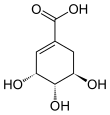
Шикимовая кислота - Shikimic acid
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК (3р,4S,5р) -3,4,5-тригидроксициклогекс-1-ен-1-карбоновая кислота | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.004.850 | ||
| Номер ЕС |
| ||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Характеристики | |||
| C7ЧАС10О5 | |||
| Молярная масса | 174,15 г / моль | ||
| Температура плавления | От 185 до 187 ° C (от 365 до 369 ° F; от 458 до 460 K) | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Шикимовая кислота, более известный как его анионный форма шикимат, это циклогексен, а циклитол и циклогексанкарбоновая кислота. Это важный биохимический метаболит в растениях и микроорганизмах. Его название происходит от японского цветка шикими (シ キ ミ, то Японский звездчатый анис, Иллициум анисатум), из которого он был впервые выделен в 1885 г. Йохан Фредрик Эйкман.[1] Выяснение его структуры было сделано почти 50 лет спустя.[2]
Характеристики
Он появляется в список канцерогенов группы 3 Международного агентства по изучению рака. Группа 3 означает, что агент не может быть классифицирован по его канцерогенности для человека. Тем не менее, рекомендуется жарить листья древовидного папоротника. тупица (свернутые листья молодого древовидного папоротника в порядке Cyatheales, заготавливают для использования в качестве овоща). Эти листья съедобны, но сначала их нужно обжарить, чтобы удалить шикимовую кислоту.[3]
Шикимовая кислота также является гликозид часть некоторых гидролизуемые танины. Кислота хорошо растворяется в воде и не растворяется в неполярных растворителях, поэтому шикимовая кислота активна только против Грамположительные бактерии, из-за внешнего клеточная мембрана непроницаемость Грамотрицательные.[4]
Биосинтез
Фосфоенолпируват и эритрозо-4-фосфат реагировать на форму 3-дезокси-D-арабиногептулозонат-7-фосфат (DAHP) в реакции, катализируемой ферментом DAHP-синтаза. DAHP затем преобразуется в 3-дегидрохинат (DHQ) в реакции, катализируемой ДГК-синтаза. Хотя эта реакция требует никотинамид аденин динуклеотид (НАД) в качестве кофактора, ферментный механизм регенерирует его, в результате чего нет чистого использования НАД.
 Биосинтез 3-дегидрохината из фосфоенолпирувата и эритрозо-4-фосфата
Биосинтез 3-дегидрохината из фосфоенолпирувата и эритрозо-4-фосфата
ДГК обезвоживается до 3-дегидрошикимовая кислота ферментом 3-дегидрохинатдегидратаза, которая восстанавливается до шикимовой кислоты ферментом шикимат дегидрогеназа, который использует никотинамидадениндинуклеотидфосфат (НАДФН) в качестве кофактора.
 Биосинтез шикимовой кислоты из 3-дегидрохината
Биосинтез шикимовой кислоты из 3-дегидрохината
Путь Шикимата
Биосинтез ароматических аминокислот
Путь шикимата - это семиэтапный метаболический путь, используемый бактерии, грибы, водоросли, паразиты и растения для биосинтеза ароматические аминокислоты (фенилаланин, тирозин, и триптофан ). Этот путь не встречается у животных; следовательно, фенилаланин и триптофан представляют собой незаменимые аминокислоты которые должны быть получены из рациона животного (животные могут синтезировать тирозин из фенилаланина и, следовательно, не является незаменимой аминокислотой, за исключением люди, неспособные гидроксилировать фенилаланин до тирозина ).
Семь ферментов, участвующих в пути шикимата: DAHP-синтаза, 3-дегидрохинатсинтаза, 3-дегидрохинатдегидратаза, шикимат дегидрогеназа, шикимат киназа, ВПСП-синтаза, и хоризмат-синтаза. Путь начинается с двух субстраты, фосфоенолпируват и эритрозо-4-фосфат и заканчивается хоризматировать, субстрат для трех ароматических аминокислот. Пятый фермент вовлечен шикимат киназа, фермент, который катализирует АТФ -зависимый фосфорилирование из шикимат формировать шикимат-3-фосфат (показано на рисунке ниже).[5] Затем шикимат-3-фосфат соединяется с фосфоенолпируват давать 5-енолпирувилшикимат-3-фосфат через фермент 5-энолпирувилшикимат-3-фосфат (EPSP) синтаза.
Затем 5-енолпирувилшикимат-3-фосфат превращается в хоризматировать по хоризмат-синтаза.
Префеновая кислота затем синтезируется Перестановка Клейзена из хоризматировать к хоризмат мутаза.[6][7]
Префенат окислительно декарбоксилированный с сохранением гидроксил группа, чтобы дать п-гидроксифенилпируват, который является трансаминированный с помощью глутамат в качестве источника азота для получения тирозин и α-кетоглутарат.
Отправная точка в биосинтезе некоторых фенольных соединений
Фенилаланин и тирозин прекурсоры, используемые в биосинтез фенилпропаноидов. Затем фенилпропаноиды используются для получения флавоноиды, кумарины, дубильные вещества и лигнин. Первый задействованный фермент - это фенилаланин аммиак-лиаза (PAL), который преобразует L-фенилаланин к транс-коричная кислота и аммиак.
Биосинтез галловой кислоты
Галловая кислота сформирован из 3-дегидрошикимат под действием фермента шикимат дегидрогеназа производить 3,5-дидегидрошикимат. Это последнее соединение спонтанно перестраивается в галловую кислоту.[8]
Другие соединения
Шикимовая кислота является предшественником:
- индол, производные индола и ароматическая аминокислота триптофан и производные триптофана, такие как психоделическое соединение диметилтриптамин
- много алкалоиды и другие ароматические метаболиты
Микоспориноподобные аминокислоты
Микоспориноподобные аминокислоты представляют собой небольшие вторичные метаболиты, вырабатываемые организмами, которые живут в среде с большим количеством солнечного света, обычно в морской среде.
Использует
В фармацевтической промышленности шикимовая кислота из Китая звездчатый анис (Illicium verum) используется в качестве основного материала для производства осельтамивир (Тамифлю ). Хотя шикимовая кислота присутствует в большинстве автотрофный организмов, это промежуточный продукт биосинтеза, обычно обнаруживаемый в очень низких концентрациях. Низкий выход шикимовой кислоты из китайского аниса звездчатого является причиной нехватки озельтамивира в 2005 году. Шикимовую кислоту также можно извлечь из семян сладкой жевательной резинки (Liquidambar styraciflua ) фрукты,[2] который в изобилии встречается в Северной Америке, его урожайность составляет около 1,5%. Например, для четырнадцати упаковок Тамифлю необходимо 4 кг семян сладкой жевательной резинки. Для сравнения, звездчатый анис дает от 3% до 7% шикимовой кислоты. Биосинтетические пути в Кишечная палочка были недавно усовершенствованы, чтобы позволить организму накапливать достаточно материала для коммерческого использования.[9][10][11] Исследование 2010 г., опубликованное Университет штата Мэн показали, что шикимовая кислота также может быть легко извлечена из игл нескольких видов сосна дерево.[12]
Защита групп чаще используются в небольших лабораториях и на начальных этапах разработки, чем в процессах промышленного производства, поскольку их использование добавляет к процессу дополнительные этапы и материальные затраты. Однако наличие дешевой хиральный строительный блок может преодолеть эти дополнительные затраты, например, шикимовая кислота для осельтамивир.
Аминосикимовая кислота также является альтернативой шикимовой кислоте в качестве исходного материала для синтеза осельтамивира.
Мишень для лекарств
Шикимат можно использовать для синтеза (6S) -6-фторошикимовая кислота,[13] антибиотик, подавляющий ароматический биосинтетический путь.[14]
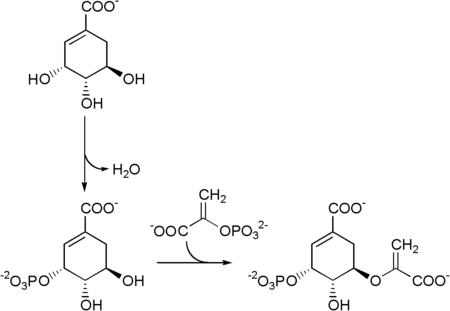
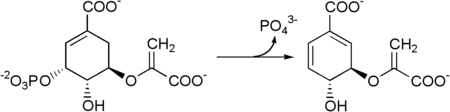
Глифосат, активный ингредиент гербицида Округлять, убивает растения, нарушая путь шикимата в растениях. Более конкретно, глифосат ингибирует фермент 5-энолпирувилшикимат-3-фосфатсинтаза (EPSPS). "Сводка новостей готова" генетически модифицированные культуры преодолеть это торможение.[нужна цитата ]
Смотрите также
- Аминосикиматный путь, новый вариант пути шикимата
Рекомендации
- ^ Эйкман, Дж. Ф. (1881). "Ботанические отношения Иллициум религиозный Sieb., Иллициум анисатум Lour ". Американский фармацевтический журнал. 53 (8).
- ^ а б Enrich, L.B .; Scheuermann, M. L .; Mohadjer, A .; Matthias, K. R .; Eller, C.F .; Newman, M. S .; Fujinaka, M .; Пун, Т. (2008). "Liquidambar styraciflua: возобновляемый источник шикимовой кислоты ». Буквы Тетраэдра. 49 (16): 2503–2505. Дои:10.1016 / j.tetlet.2008.02.140.
- ^ Evans, I.A .; Осман М.А. (26 июля 1974 г.). «Канцерогенность папоротника и шикимовой кислоты». Природа. 250 (5464): 348–9. Bibcode:1974Натура.250..348E. Дои:10.1038 / 250348a0. PMID 4211848.
- ^ Хай-Юнг, Чанг (2009). «Оценка биологической активности экстрактов звездчатого аниса» (PDF). ocean.kisti.re.kr. Получено 2019-06-18.
- ^ Herrmann, K. M .; Уивер, Л. М. (1999). «Путь Шикимэ». Ежегодный обзор физиологии растений и молекулярной биологии растений. 50: 473–503. Дои:10.1146 / annurev.arplant.50.1.473. PMID 15012217.
- ^ Гериш, Х. (1978). «О механизме хоризматмутазной реакции». Биохимия. 17 (18): 3700–3705. Дои:10.1021 / bi00611a004. PMID 100134.
- ^ Kast, P .; Tewari, Y.B .; Wiest, O .; Hilvert, D .; Хоук, К.; Голдберг, Роберт Н. (1997). «Термодинамика превращения хоризма в префенат: экспериментальные результаты и теоретические прогнозы». Журнал физической химии B. 101 (50): 10976–10982. Дои:10.1021 / jp972501l.
- ^ «Путь галловой кислоты». metacyc.org.
- ^ Брэдли, Д. (декабрь 2005 г.). «Звездная роль бактерий в борьбе с пандемией гриппа?». Обзоры природы Drug Discovery. 4 (12): 945–946. Дои:10.1038 / nrd1917. PMID 16370070.
- ^ Krämer, M .; Bongaerts, J .; Bovenberg, R .; Кремер, С .; Müller, U .; Орф, С .; Wubbolts, M .; Рэйвен, Л. (2003). «Метаболическая инженерия для микробиологического производства шикимовой кислоты». Метаболическая инженерия. 5 (4): 277–283. Дои:10.1016 / j.ymben.2003.09.001. PMID 14642355.
- ^ Johansson, L .; Линдског, А .; Silfversparre, G .; Cimander, C .; Nielsen, K. F .; Лиден, Г. (2005). «Производство шикимовой кислоты модифицированным штаммом Кишечная палочка (W3110.shik1) в условиях ограниченного количества фосфатов и углерода ". Биотехнологии и биоинженерия. 92 (5): 541–552. Дои:10.1002 / бит.20546. PMID 16240440.
- ^ «Хвоя сосны мэн дает ценный материал Тамифлю». Boston.com. 7 ноября 2010 г.
- ^ (PDF) https://web.archive.org/web/20160304001748/http://jiang.tju.edu.cn/pdfs/6flufull.pdf. Архивировано из оригинал (PDF) 4 марта 2016 г. Отсутствует или пусто
| название =(помощь) - ^ "(6S) -6-Фторошикимовая кислота, антибактериальный агент, действующий на ароматический биосинтетический путь » (PDF).
Книги
- Хаслам, Э. (1974). Путь Шикимате (1-е изд.).
- Хаслам, Э. (1993). Шикимовая кислота.
внешняя ссылка
- «Биосинтез шикимата и хоризматов». Департамент химии Лондонского университета королевы Марии.