Цитозоль - Википедия - Cytosol

| Клеточная биология | |
|---|---|
| В животная клетка | |
 Компоненты типичной животной клетки:
|
В цитозоль, также известный как внутриклеточная жидкость (ICF) или же цитоплазматический матрикс, или же грунтовая плазма,[2] жидкость находится внутри клетки.[3] Он разделен на отсеки мембранами. Например, митохондриальный матрикс отделяет митохондрия во многие отсеки.
в эукариотическая клетка цитозоль окружен клеточная мембрана и является частью цитоплазма, который также включает митохондрии, пластиды, и другие органеллы (но не их внутренние жидкости и структуры); то ядро клетки отдельный. Таким образом, цитозоль представляет собой жидкую матрицу вокруг органелл. В прокариоты, большинство химических реакций метаболизм происходят в цитозоле, а некоторые - в мембранах или в периплазматическое пространство. У эукариот пока многие метаболические пути все еще встречаются в цитозоле, другие - внутри органелл.
Цитозоль представляет собой сложную смесь веществ, растворенных в воде. Хотя вода составляет большую часть цитозоля, ее структура и свойства внутри клеток изучены недостаточно. Концентрации ионы Такие как натрий и калий в цитозоле отличаются от внеклеточной жидкости; эти различия в уровнях ионов важны в таких процессах, как осморегуляция, клеточная сигнализация, и генерация потенциалы действия в возбудимых клетках, таких как эндокринные, нервные и мышечные клетки. Цитозоль также содержит большое количество макромолекулы, которые могут изменить поведение молекул через макромолекулярное скопление.
Хотя когда-то считалось, что это простой раствор молекул, цитозоль имеет несколько уровней организации. К ним относятся градиенты концентрации малых молекул, таких как кальций, крупные комплексы ферменты которые действуют вместе и принимают участие в метаболические пути, и белковые комплексы Такие как протеасомы и карбоксисомы которые охватывают и разделяют части цитозоля.
Определение
Термин «цитозоль» был впервые введен в 1965 г. Х. А. Ларди и первоначально относился к жидкости, которая была произведена путем разрушения клеток и осаждения всех нерастворимых компонентов посредством ультрацентрифугирование.[4][5] Такой растворимый клеточный экстракт не идентичен растворимой части цитоплазмы клетки и обычно называется цитоплазматической фракцией.[6]
Период, термин цитозоль теперь используется для обозначения жидкой фазы цитоплазмы в интактной клетке.[6] Это исключает любую часть цитоплазмы, которая содержится в органеллах.[7] Из-за возможности путаницы между использованием слова «цитозоль» для обозначения экстрактов клеток и растворимой части цитоплазмы в интактных клетках фраза «водная цитоплазма» была использована для описания жидкого содержимого цитоплазмы. живых клеток.[5]
До этого другие условия, включая гиалоплазма,[8] использовались для клеточной жидкости, не всегда как синонимы, так как ее природа была не очень ясна (см. протоплазма ).[6]
Свойства и состав
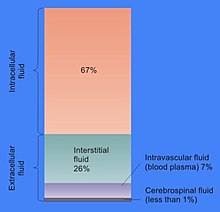
Доля цитозоля в объеме клетки варьируется: например, в то время как этот отсек формирует основную часть клеточной структуры в бактерии,[9] в клетках растений основным отделом является большой центральный вакуоль.[10] Цитозоль состоит в основном из воды, растворенных ионов, небольших молекул и крупных водорастворимых молекул (например, белков). Большинство этих небелковых молекул имеют молекулярная масса менее 300Да.[11] Эта смесь малых молекул чрезвычайно сложна, поскольку множество молекул, участвующих в метаболизме ( метаболиты ) огромен. Например, в растениях может образовываться до 200 000 различных небольших молекул, хотя не все они будут присутствовать в одном и том же виде или в одной клетке.[12] Оценки количества метаболитов в отдельных клетках, таких как Кишечная палочка и пекарские дрожжи предсказывают, что сделано менее 1000.[13][14]
Вода
Большая часть цитозоля воды, что составляет около 70% от общего объема типичной ячейки.[15] В pH внутриклеточной жидкости - 7,4.[16] в то время как человеческий цитозольный pH колеблется в пределах 7,0–7,4 и обычно выше, если клетка растет.[17] В вязкость цитоплазмы примерно такой же, как чистая вода, хотя распространение малых молекул через эту жидкость примерно в четыре раза медленнее, чем в чистой воде, в основном из-за столкновений с большим количеством макромолекулы в цитозоле.[18] Исследования в рассольная креветка исследовали, как вода влияет на функции клеток; они увидели, что уменьшение количества воды в клетке на 20% подавляет метаболизм, при этом метаболизм постепенно снижается по мере высыхания клетки и прекращается вся метаболическая активность, когда уровень воды достигает 70% ниже нормы.[5]
Хотя вода жизненно важна для жизни, структура этой воды в цитозоле до конца не изучена, в основном потому, что такие методы, как спектроскопия ядерного магнитного резонанса дают только информацию о средней структуре воды и не могут измерять локальные изменения в микроскопическом масштабе. Даже структура чистой воды изучена плохо из-за способности воды образовывать такие структуры, как кластеры воды через водородные связи.[19]
Классический взгляд на воду в клетках состоит в том, что около 5% этой воды прочно связано растворенными веществами или макромолекулами в виде воды сольватация, в то время как большинство имеет ту же структуру, что и чистая вода.[5] Эта сольватационная вода не активна в осмос и может иметь разные свойства растворителя, так что одни растворенные молекулы исключаются, а другие становятся концентрированными.[20][21] Однако другие утверждают, что эффекты высоких концентраций макромолекул в клетках распространяются на весь цитозоль и что вода в клетках ведет себя совершенно иначе, чем вода в разбавленных растворах.[22] Эти идеи включают предположение, что клетки содержат зоны с низкой и высокой плотностью воды, которые могут иметь широкое влияние на структуры и функции других частей клетки.[19][23] Однако использование передовых методов ядерного магнитного резонанса для прямого измерения подвижности воды в живых клетках противоречит этой идее, поскольку предполагает, что 85% клеточной воды действует как чистая вода, а остальная часть менее подвижна и, вероятно, связана с макромолекулами. .[24]
Ионы
Концентрации других ионы в цитозоле сильно отличаются от таковых в внеклеточной жидкости и цитозоль также содержит гораздо большее количество заряженных макромолекул, таких как белки и нуклеиновые кислоты, чем за пределами клеточной структуры.
| Ион | Концентрация (миллимолярный) | |
|---|---|---|
| В цитозоле | В плазме | |
| Калий | 139–150[25][26] | 4 |
| Натрий | 12 | 145 |
| Хлористый | 4 | 116 |
| Бикарбонат | 12 | 29 |
| Аминокислоты в белках | 138 | 9 |
| Магний | 0.8 | 1.5 |
| Кальций | <0.0002 | 1.8 |
В отличие от внеклеточной жидкости, цитозоль имеет высокую концентрацию калий ионов и низкая концентрация натрий ионы.[27] Эта разница в концентрациях ионов критична для осморегуляция, поскольку если бы уровни ионов внутри клетки были такими же, как и снаружи, вода постоянно поступала бы осмос - поскольку уровни макромолекулы внутри клеток выше, чем их уровни снаружи. Вместо этого ионы натрия удаляются, а ионы калия поглощаются Na⁺ / K⁺-АТФаза, ионы калия затем стекают вниз своего градиента концентрации через ионные каналы отбора калия, эта потеря положительного заряда создает отрицательный мембранный потенциал. Чтобы сбалансировать это разность потенциалов отрицательные ионы хлора также выходят из клетки через селективные хлоридные каналы. Потеря ионов натрия и хлора компенсирует осмотический эффект более высокой концентрации органических молекул внутри клетки.[27]
Клетки могут справляться с еще большими осмотическими изменениями за счет накопления осмопротекторы Такие как бетаины или же трегалоза в их цитозоле.[27] Некоторые из этих молекул могут позволить клеткам выжить, будучи полностью высушенными, и позволяют организму войти в состояние анабиоза, называемое криптобиоз.[28] В этом состоянии цитозоль и осмопротекторы превращаются в стеклообразное твердое вещество, которое помогает стабилизировать белки и клеточные мембраны от разрушающего воздействия высыхания.[29]
Низкая концентрация кальций в цитозоле позволяет ионам кальция действовать как второй посланник в кальциевая сигнализация. Здесь такой сигнал, как гормон или потенциал действия открывается кальциевый канал так что кальций хлынет в цитозоль.[30] Это внезапное увеличение цитозольного кальция активирует другие сигнальные молекулы, такие как кальмодулин и протеинкиназа C.[31] Другие ионы, такие как хлорид и калий, также могут выполнять сигнальные функции в цитозоле, но они недостаточно изучены.[32]
Макромолекулы
Молекулы белков, которые не связываются с клеточные мембраны или цитоскелет растворяются в цитозоле. Количество белка в клетках чрезвычайно велико и приближается к 200 мг / мл, занимая около 20–30% объема цитозоля.[1] Однако сложно точно измерить, сколько белка растворено в цитозоле в интактных клетках, поскольку некоторые белки, по-видимому, слабо связаны с мембранами или органеллами целых клеток и выделяются в раствор при лизис клеток.[5] Действительно, в экспериментах, где плазматическая мембрана клеток была осторожно разрушена с использованием сапонин, не повреждая другие клеточные мембраны, высвобождается только около четверти клеточного белка. Эти клетки также были способны синтезировать белки, если им дали АТФ и аминокислоты, что означает, что многие ферменты в цитозоле связаны с цитоскелетом.[33] Однако идея о том, что большинство белков в клетках прочно связаны в сеть, называемую микротрабекулярная решетка сейчас рассматривается как маловероятный.[34]
У прокариот цитозоль содержит клеточные геном внутри структуры, известной как нуклеоид.[35] Это неправильная масса ДНК и связанные белки, которые контролируют транскрипция и репликация бактериального хромосома и плазмиды. У эукариот геном находится внутри ядро клетки, который отделен от цитозоля ядерные поры которые блокируют свободную диффузию любой молекулы размером более 10нанометры в диаметре.[36]
Эта высокая концентрация макромолекул в цитозоле вызывает эффект, называемый макромолекулярное скопление, когда эффективная концентрация других макромолекул увеличивается, так как они имеют меньший объем для перемещения. Этот эффект вытеснения может привести к большим изменениям как в тарифы и положение химическое равновесие реакций в цитозоле.[1] Это особенно важно из-за его способности изменять константы диссоциации благоприятствуя ассоциации макромолекул, например, когда несколько белков объединяются, чтобы сформировать белковые комплексы, или когда ДНК-связывающие белки привязать к своим целям в геном.[37]
Организация
Хотя компоненты цитозоля не разделены на области клеточными мембранами, эти компоненты не всегда смешиваются случайным образом, и несколько уровней организации могут локализовать определенные молекулы в определенных местах внутри цитозоля.[38]
Градиенты концентрации
Хотя маленькие молекулы размытый быстро в цитозоле, градиенты концентрации все еще могут возникать в этом отсеке. Хорошо изученным примером этого являются «кальциевые искры», которые возникают в течение короткого периода времени в районе открытого кальциевый канал.[39] Это примерно 2микрометры в диаметре и длиться всего несколько миллисекунды, хотя несколько искр могут сливаться, образуя большие градиенты, называемые «кальциевыми волнами».[40] Градиенты концентрации других малых молекул, таких как кислород и аденозинтрифосфат может производиться в ячейках вокруг кластеров митохондрии, хотя они менее изучены.[41][42]
Белковые комплексы
Белки могут связываться с образованием белковые комплексы, они часто содержат набор белков со схожими функциями, например ферменты, которые выполняют несколько этапов одного и того же метаболического пути.[43] Эта организация может разрешить канал субстрата, то есть когда продукт одного фермента передается непосредственно следующему ферменту в пути, не попадая в раствор.[44] Каналирование может сделать путь более быстрым и эффективным, чем если бы ферменты были случайным образом распределены в цитозоле, а также может предотвратить высвобождение нестабильных промежуточных продуктов реакции.[45] Хотя большое количество метаболических путей включает ферменты, которые тесно связаны друг с другом, другие могут включать более слабо связанные комплексы, которые очень трудно изучать вне клетки.[46][47] Следовательно, важность этих комплексов для метаболизма в целом остается неясной.

Белковые отсеки
Некоторые белковые комплексы содержат большую центральную полость, изолированную от остальной части цитозоля. Одним из примеров такого закрытого отсека является протеасома.[48] Здесь набор субъединиц образует полый ствол, содержащий протеазы которые разрушают цитозольные белки. Поскольку они могли бы повредить, если бы они свободно смешивались с остальной частью цитозоля, ствол закрывается набором регуляторных белков, которые распознают белки с сигналом, направляющим их на деградацию (a убиквитин tag) и подавать их в протеолитическую полость.[49]
Еще один большой класс белковых компартментов - это бактериальные микрокомпартменты, которые состоят из белковой оболочки, которая инкапсулирует различные ферменты.[50] Эти отсеки обычно составляют около 100–200 нанометры поперек и сделаны из взаимосвязанных белков.[51] Хорошо понятный пример - карбоксисомный, который содержит ферменты, участвующие в фиксация углерода Такие как RuBisCO.[52]
Биомолекулярные конденсаты
Органеллы, не связанные с мембраной, могут образовываться как биомолекулярные конденсаты, возникающие в результате кластеризации, олигомеризация, или же полимеризация из макромолекулы водить коллоидный фазовое разделение цитоплазмы или ядра.
Цитоскелетный рассев
Хотя цитоскелет не является частью цитозоля, наличие этой сети нитей ограничивает диффузию крупных частиц в клетке. Например, в нескольких исследованиях частицы трассера размером более 25нанометры (размером с рибосома )[53] были исключены из частей цитозоля по краям клетки и рядом с ядром.[54][55] Эти «исключающие отсеки» могут содержать гораздо более плотную сетку из актин волокон, чем остаток цитозоля. Эти микродомены могут влиять на распределение больших структур, таких как рибосомы и органеллы внутри цитозоля, исключая их из одних областей и концентрируя их в других.[56]
Функция
Цитозоль не выполняет единственной функции и вместо этого является участком множества клеточных процессов. Примеры этих процессов включают: преобразование сигнала от клеточной мембраны к участкам внутри клетки, таким как ядро клетки,[57] или органеллы.[58] Этот отсек также является местом многих процессов цитокинез, после выхода из строя ядерная мембрана в митоз.[59] Другой важной функцией цитозоля является транспортировка метаболитов от места их производства к месту их использования. Это относительно просто для водорастворимых молекул, таких как аминокислоты, которые могут быстро диффундировать через цитозоль.[18] Тем не мение, гидрофобный молекулы, такие как жирные кислоты или же стеролы, могут транспортироваться через цитозоль с помощью специфических связывающих белков, которые перемещают эти молекулы между клеточными мембранами.[60][61] Молекулы, попавшие в клетку эндоцитоз или на пути к секретный также может транспортироваться через цитозоль внутри пузырьки,[62] которые представляют собой маленькие сферы липидов, которые перемещаются вдоль цитоскелета посредством моторные белки.[63]
Цитозоль является местом наибольшего метаболизма прокариот,[9] и большая часть метаболизма эукариот. Например, у млекопитающих около половины белков в клетке локализованы в цитозоле.[64] Наиболее полные данные доступны по дрожжам, где метаболические реконструкции показывают, что большинство метаболических процессов и метаболитов происходит в цитозоле.[65] Основные метаболические пути, которые происходят в цитозоле у животных: биосинтез белка, то пентозофосфатный путь, гликолиз и глюконеогенез.[66] Локализация путей может быть другой у других организмов, например, синтез жирных кислот происходит в хлоропласты в растениях[67][68] И в апикопласты в апикомплекс.[69]
Рекомендации
- ^ а б c Эллис Р.Дж. (октябрь 2001 г.). «Макромолекулярная скученность: очевидно, но недооценивается». Trends Biochem. Наука. 26 (10): 597–604. Дои:10.1016 / S0968-0004 (01) 01938-7. PMID 11590012.
- ^ Каммак, Ричард КаммакРичард; Этвуд, Тереза ЭтвудТереза; Кэмпбелл, Питер КэмпбеллПитер; Приход, Ховард ПэришХовард; Смит, Энтони Смит Энтони; Велла, Фрэнк ВеллаФрэнк; Стирлинг, Джон Стирлинг-Джон (2006). Каммак, Ричард; Этвуд, Тереза; Кэмпбелл, Питер; Пэриш, Ховард; Смит, Энтони; Велла, Франк; Стирлинг, Джон (ред.). «Цитоплазматическая матрица». Оксфордский словарь биохимии и молекулярной биологии. Издательство Оксфордского университета. Дои:10.1093 / acref / 9780198529170.001.0001. ISBN 9780198529170.
- ^ Браун, Томас А. (2011). Физиология быстрого обзора. Elsevier Health Sciences. п. 2. ISBN 978-0323072601.
- ^ Lardy, H. A. 1965. О направлении реакций окисления-восстановления пиридиновых нуклеотидов в глюконеогенезе и липогенезе. В: Контроль энергетического обменапод редакцией Б. Чанса, Р. Истабрука и Дж. Р. Уильямсона. Нью-Йорк: Academic, 1965, стр. 245, [1].
- ^ а б c d е Клегг Джеймс С. (1984). «Свойства и метаболизм водной цитоплазмы и ее границ». Являюсь. J. Physiol. 246 (2 Pt 2): R133–51. Дои:10.1152 / ajpregu.1984.246.2.R133. PMID 6364846.
- ^ а б c Каммак, Ричард; Тереза Этвуд; Attwood, Teresa K .; Кэмпбелл, Питер Скотт; Parish, Howard I .; Смит, Тони; Велла, Франк; Стирлинг, Джон (2006). Оксфордский словарь биохимии и молекулярной биологии. Оксфорд [Оксфордшир]: Издательство Оксфордского университета. ISBN 0-19-852917-1. OCLC 225587597.
- ^ а б Лодиш, Харви Ф. (1999). Молекулярная клеточная биология. Нью-Йорк: Книги Scientific American. ISBN 0-7167-3136-3. OCLC 174431482.
- ^ Ханштейн, Дж. (1880). Das Protoplasma. Гейдельберг. п. 24.
- ^ а б Хопперт М, Майер Ф (1999). «Принципы макромолекулярной организации и функции клеток у бактерий и архей». Cell Biochem. Биофизы. 31 (3): 247–84. Дои:10.1007 / BF02738242. PMID 10736750. S2CID 21004307.
- ^ Баушер К.Г., Тобин А.К. (апрель 2001 г.). «Компартмент метаболизма в митохондриях и пластидах». J. Exp. Бот. 52 (356): 513–27. Дои:10.1093 / jexbot / 52.356.513. PMID 11373301.
- ^ Гудакр Р., Вайдьянатан С., Данн В. Б., Харриган Г. Г., Келл Д. Б. (май 2004 г.). «Метаболомика в цифрах: получение и понимание глобальных данных о метаболитах» (PDF). Тенденции биотехнологии. 22 (5): 245–52. Дои:10.1016 / j.tibtech.2004.03.007. PMID 15109811. Архивировано из оригинал (PDF) 17 декабря 2008 г.
- ^ Weckwerth W (2003). «Метаболомика в системной биологии». Анну Рев Завод Биол. 54: 669–89. Дои:10.1146 / annurev.arplant.54.031902.135014. PMID 14503007. S2CID 1197884.
- ^ Рид JL, Vo TD, Schilling CH, Palsson BO (2003). «Расширенная модель в масштабе генома Escherichia coli K-12 (iJR904 GSM / GPR)». Геном Биол. 4 (9): R54. Дои:10.1186 / gb-2003-4-9-r54. ЧВК 193654. PMID 12952533.
- ^ Förster J, Famili I, Fu P, Palsson BØ, Nielsen J (февраль 2003 г.). «Реконструкция в масштабе генома метаболической сети Saccharomyces cerevisiae». Genome Res. 13 (2): 244–53. Дои:10.1101 / гр.234503. ЧВК 420374. PMID 12566402.
- ^ Луби-Фелпс К (2000). «Цитоархитектура и физические свойства цитоплазмы: объем, вязкость, диффузия, площадь внутриклеточной поверхности» (PDF). Int. Преподобный Цитол. Международный обзор цитологии. 192: 189–221. Дои:10.1016 / S0074-7696 (08) 60527-6. ISBN 978-0-12-364596-8. PMID 10553280. Архивировано из оригинал (PDF) 19 июля 2011 г.
- ^ Роос А., Бор WF (апрель 1981 г.). «Внутриклеточный pH». Physiol. Rev. 61 (2): 296–434. Дои:10.1152 / Physrev.1981.61.2.296. PMID 7012859.
- ^ Яркий, G R; Фишер, GW; Rogowska, J; Тейлор, DL (1987). «Визуализирующая микроскопия с соотношением флуоресценции: временные и пространственные измерения цитоплазматического pH». Журнал клеточной биологии. 104 (4): 1019–1033. Дои:10.1083 / jcb.104.4.1019. ЧВК 2114443. PMID 3558476.
- ^ а б Веркман А.С. (январь 2002 г.). «Диффузия растворенных веществ и макромолекул в водных компартментах клетки». Trends Biochem. Наука. 27 (1): 27–33. Дои:10.1016 / S0968-0004 (01) 02003-5. PMID 11796221.
- ^ а б Виггинс PM (1 декабря 1990 г.). «Роль воды в некоторых биологических процессах». Microbiol. Rev. 54 (4): 432–49. Дои:10.1128 / MMBR.54.4.432-449.1990. ЧВК 372788. PMID 2087221.
- ^ Fulton AB (сентябрь 1982 г.). «Насколько переполнена цитоплазма?». Клетка. 30 (2): 345–7. Дои:10.1016/0092-8674(82)90231-8. PMID 6754085. S2CID 6370250.
- ^ Гарлид К.Д. (2000). «Состояние воды в биологических системах». Int. Преподобный Цитол. Международный обзор цитологии. 192: 281–302. Дои:10.1016 / S0074-7696 (08) 60530-6. ISBN 978-0-12-364596-8. PMID 10553283.
- ^ Чаплин М. (ноябрь 2006 г.). «Неужели мы недооцениваем важность воды в клеточной биологии?». Nat. Преподобный Мол. Cell Biol. 7 (11): 861–6. Дои:10.1038 / nrm2021. PMID 16955076. S2CID 42919563.
- ^ Виггинс PM (июнь 1996 г.). «Вода высокой и низкой плотности и покоящиеся, активные и трансформированные клетки». Cell Biol. Int. 20 (6): 429–35. Дои:10.1006 / cbir.1996.0054. PMID 8963257. S2CID 42866068.
- ^ Persson E, Halle B (апрель 2008 г.). «Динамика клеточной воды во многих временных масштабах». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 105 (17): 6266–71. Bibcode:2008ПНАС..105.6266П. Дои:10.1073 / pnas.0709585105. ЧВК 2359779. PMID 18436650.
- ^ Тьер, С. О. (25 апреля 1986 г.). «Физиология калия». Американский журнал медицины. 80 (4A): 3–7. Дои:10.1016/0002-9343(86)90334-7. PMID 3706350.
- ^ Лот, Кристофер Дж. (2012). Принципы физиологии почек, 5-е издание. Springer. п. 12.
- ^ а б c Lang F (октябрь 2007 г.). «Механизмы и значение регуляции клеточного объема». J Am Coll Nutr. 26 (5 Прил.): 613S – 623S. Дои:10.1080/07315724.2007.10719667. PMID 17921474. S2CID 1798009.
- ^ Sussich F, Skopec C, Brady J, Cesàro A (август 2001 г.). «Обратимое обезвоживание трегалозы и ангидробиоз: от растворенного состояния к экзотическому кристаллу?». Carbohydr. Res. 334 (3): 165–76. Дои:10.1016 / S0008-6215 (01) 00189-6. PMID 11513823.
- ^ Кроу Дж. Х., Карпентер Дж. Ф., Кроу Л. М. (1998). «Роль витрификации при ангидробиозе». Анну. Преподобный Physiol. 60: 73–103. Дои:10.1146 / annurev.physiol.60.1.73. PMID 9558455.
- ^ Берридж MJ (1 марта 1997 г.). «Элементарные и глобальные аспекты кальциевой сигнализации». J. Physiol. 499 (Чт 2): 291–306. Дои:10.1113 / jphysiol.1997.sp021927. ЧВК 1159305. PMID 9080360.
- ^ Киккава У, Кисимото А, Нисизука Й (1989). «Семейство протеинкиназ С: гетерогенность и ее последствия». Анну. Преподобный Biochem. 58: 31–44. Дои:10.1146 / annurev.bi.58.070189.000335. PMID 2549852.
- ^ Орлов С.Н., Хамет П. (апрель 2006 г.). «Внутриклеточные одновалентные ионы как вторичные мессенджеры». J. Membr. Биол. 210 (3): 161–72. Дои:10.1007 / s00232-006-0857-9. PMID 16909338. S2CID 26068558.
- ^ Хаддер А., Натансон Л., Deutscher MP (декабрь 2003 г.). «Организация цитоплазмы млекопитающих». Мол. Клетка. Биол. 23 (24): 9318–26. Дои:10.1128 / MCB.23.24.9318-9326.2003. ЧВК 309675. PMID 14645541.
- ^ Хойзер Дж (2002). «Что случилось с« микротрабекулярной концепцией »?». Биологическая ячейка. 94 (9): 561–96. Дои:10.1016 / S0248-4900 (02) 00013-8. PMID 12732437. S2CID 45792524.
- ^ Танбихлер М., Ван С., Шапиро Л. (2005). «Бактериальный нуклеоид: высокоорганизованная и динамичная структура». J Cell Biochem. 96 (3): 506–21. Дои:10.1002 / jcb.20519. PMID 15988757. S2CID 25355087.
- ^ Петерс Р. (2006). Введение в ядерно-цитоплазматический транспорт: молекулы и механизмы. Методы Мол. Биол. Методы молекулярной биологии ™. 322. С. 235–58. Дои:10.1007/978-1-59745-000-3_17. ISBN 978-1-58829-362-6. PMID 16739728.
- ^ Чжоу Х.Х., Ривас Г., Минтон А.П. (2008). «Макромолекулярное скопление и ограничение: биохимические, биофизические и потенциальные физиологические последствия». Анну Рев Биофиз. 37: 375–97. Дои:10.1146 / annurev.biophys.37.032807.125817. ЧВК 2826134. PMID 18573087.
- ^ Норрис V, ден Blaauwen T, Cabin-Flaman A (март 2007 г.). «Функциональная таксономия бактериальных гиперструктур». Microbiol. Мол. Биол. Rev. 71 (1): 230–53. Дои:10.1128 / MMBR.00035-06. ЧВК 1847379. PMID 17347523.
- ^ Ван С.К., Вэй Ц., Чжао Г. (апрель 2004 г.). «Визуализация микродомена Ca2 + в мышечных клетках». Circ. Res. 94 (8): 1011–22. Дои:10.1161 / 01.RES.0000125883.68447.A1. PMID 15117829.
- ^ Яффе Л.Ф. (ноябрь 1993 г.). «Классы и механизмы кальциевых волн». Клеточный кальций. 14 (10): 736–45. Дои:10.1016 / 0143-4160 (93) 90099-Р. PMID 8131190.
- ^ Ав, T.Y. (2000). «Внутриклеточная компартментация органелл и градиенты низкомолекулярных видов». Инт Рев Цитол. Международный обзор цитологии. 192: 223–53. Дои:10.1016 / S0074-7696 (08) 60528-8. ISBN 978-0-12-364596-8. PMID 10553281.
- ^ Вайс Дж. Н., Корхе П. (20 июля 2001 г.). «Цитоплазма: больше не смешанный мешок». Circ. Res. 89 (2): 108–10. Дои:10.1161 / res.89.2.108. PMID 11463714.
- ^ Srere PA (1987). «Комплексы последовательных метаболических ферментов». Анну. Преподобный Biochem. 56: 89–124. Дои:10.1146 / annurev.bi.56.070187.000513. PMID 2441660.
- ^ Перхам Р.Н. (2000). «Качающиеся рычаги и качающиеся домены в многофункциональных ферментах: каталитические машины для многоступенчатых реакций». Анну. Преподобный Biochem. 69: 961–1004. Дои:10.1146 / annurev.biochem.69.1.961. PMID 10966480.
- ^ Хуанг X, Холден HM, Raushel FM (2001). «Каналирование субстратов и промежуточных продуктов в ферментативно-катализируемых реакциях». Анну. Преподобный Biochem. 70: 149–80. Дои:10.1146 / annurev.biochem.70.1.149. PMID 11395405. S2CID 16722363.
- ^ Моубрей Дж., Моисей В. (июнь 1976 г.). «Предварительная идентификация в Escherichia coli мультиферментного комплекса с гликолитической активностью». Евро. J. Biochem. 66 (1): 25–36. Дои:10.1111 / j.1432-1033.1976.tb10421.x. PMID 133800.
- ^ Шривастава Д.К., Бернхард С.А. (ноябрь 1986 г.). «Перенос метаболитов через фермент-ферментные комплексы». Наука. 234 (4780): 1081–6. Bibcode:1986Научный ... 234.1081С. Дои:10.1126 / science.3775377. PMID 3775377.
- ^ Гролл М., Клаузен Т. (декабрь 2003 г.). «Молекулярные шредеры: как протеасомы выполняют свою роль». Curr. Мнение. Struct. Биол. 13 (6): 665–73. Дои:10.1016 / j.sbi.2003.10.005. PMID 14675543.
- ^ Нанди Д., Тахилиани П., Кумар А., Чанду Д. (март 2006 г.). «Убиквитин-протеасомная система» (PDF). Дж. Биоски. 31 (1): 137–55. Дои:10.1007 / BF02705243. PMID 16595883. S2CID 21603835.
- ^ Бобик, Т.А. (2007). «Бактериальные микрокомпартменты» (PDF). Микроб. Am Soc Microbiol. 2: 25–31. Архивировано из оригинал (PDF) на 2008-08-02.
- ^ Йейтс Т.О., Керфельд, Калифорния, Хайнхорст С., Кэннон Г.С., Шивели Дж. М. (август 2008 г.). «Белковые органеллы в бактериях: карбоксисомы и родственные микрокомпартменты». Nat. Rev. Microbiol. 6 (9): 681–691. Дои:10.1038 / nrmicro1913. PMID 18679172. S2CID 22666203.
- ^ Барсук MR, Price GD (февраль 2003 г.). "CO2 механизмы концентрации в цианобактериях: молекулярные компоненты, их разнообразие и эволюция ». J. Exp. Бот. 54 (383): 609–22. Дои:10.1093 / jxb / erg076. PMID 12554704.
- ^ Кейт JH (ноябрь 2001 г.). «Построение рентгеновских кристаллографических карт электронной плотности рибосомы низкого разрешения». Методы. 25 (3): 303–8. Дои:10.1006 / мет.2001.1242. PMID 11860284.
- ^ Прованс Д.В., Макдауэл А., Марко М., Луби-Фелпс К. (1 октября 1993 г.). «Цитоархитектура безразмерных компартментов в живых клетках». J. Cell Sci. 106 (2): 565–77. PMID 7980739.
- ^ Луби-Фелпс К., Castle PE, Тейлор Д.Л., Ланни Ф. (июль 1987 г.). «Затруднение диффузии инертных индикаторных частиц в цитоплазме клеток 3Т3 мыши». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 84 (14): 4910–3. Bibcode:1987PNAS ... 84.4910L. Дои:10.1073 / pnas.84.14.4910. ЧВК 305216. PMID 3474634.
- ^ Луби-Фелпс К. (июнь 1993 г.). «Влияние цитоархитектуры на транспорт и локализацию белковых синтетических машин». J. Cell. Биохим. 52 (2): 140–7. Дои:10.1002 / jcb.240520205. PMID 8366131. S2CID 12063324.
- ^ Холоденко Б.Н. (июнь 2003 г.). «Четырехмерная организация сигнальных каскадов протеинкиназ: роль диффузии, эндоцитоза и молекулярных моторов». J. Exp. Биол. 206 (Pt 12): 2073–82. Дои:10.1242 / jeb.00298. PMID 12756289.
- ^ Пезареши П., Шнайдер А., Кляйне Т., Лейстер Д. (декабрь 2007 г.). «Межорганочное общение». Curr. Мнение. Биол растений. 10 (6): 600–6. Дои:10.1016 / j.pbi.2007.07.007. PMID 17719262.
- ^ Winey M, Mamay CL, O'Toole ET (июнь 1995 г.). «Трехмерный ультраструктурный анализ митотического веретена Saccharomyces cerevisiae». J. Cell Biol. 129 (6): 1601–15. Дои:10.1083 / jcb.129.6.1601. ЧВК 2291174. PMID 7790357.
- ^ Вайзигер Р.А. (октябрь 2002 г.). «Белки, связывающие цитозольные жирные кислоты, катализируют две отдельные стадии внутриклеточного транспорта своих лигандов». Мол. Клетка. Биохим. 239 (1–2): 35–43. Дои:10.1023 / А: 1020550405578. PMID 12479566. S2CID 9608133.
- ^ Максфилд FR, Мондал М (июнь 2006 г.). «Транспортировка стеролов и липидов в клетках млекопитающих». Biochem. Soc. Транс. 34 (Pt 3): 335–9. Дои:10.1042 / BST0340335. PMID 16709155.
- ^ Pelham HR (август 1999 г.). «Крооновская лекция 1999 года. Внутриклеточный мембранный трафик: сортировка белков». Филос. Пер. R. Soc. Лондон. B Biol. Наука. 354 (1388): 1471–8. Дои:10.1098 / rstb.1999.0491. ЧВК 1692657. PMID 10515003.
- ^ Камаль А., Гольдштейн Л.С. (февраль 2002 г.). «Принципы прикрепления грузов к моторным белкам цитоплазмы». Curr. Мнение. Cell Biol. 14 (1): 63–8. Дои:10.1016 / S0955-0674 (01) 00295-2. PMID 11792546.
- ^ Foster LJ, de Hoog CL, Zhang Y (апрель 2006 г.). «Карта органелл млекопитающих по профилированию корреляции белков». Клетка. 125 (1): 187–99. Дои:10.1016 / j.cell.2006.03.022. PMID 16615899. S2CID 32197.
- ^ Herrgård, MJ; Swainston, N; Добсон, П; Данн, ВБ; Арга, Кентукки; Арвас, М; Blüthgen, N; Боргер, S; Costenoble, R; и другие. (Октябрь 2008 г.). «Консенсусная реконструкция метаболической сети дрожжей, полученная на основе подхода сообщества к системной биологии». Природа Биотехнологии. 26 (10): 1155–60. Дои:10.1038 / nbt1492. ЧВК 4018421. PMID 18846089.
- ^ Страйер, Люберт; Берг, Джереми Марк; Тимочко, Джон Л. (2002). Биохимия. Сан-Франциско: W.H. Фримен. ISBN 0-7167-4684-0. OCLC 179705944.
- ^ Ольрогге Дж., Поллард М., Бао Икс (декабрь 2000 г.). «Синтез жирных кислот: из CO2 функциональной геномике ». Biochem. Soc. Транс. 28 (6): 567–73. Дои:10.1042 / BST0280567. PMID 11171129.
- ^ Ольрогге Дж. Б., Кун Д. Н., Штумпф П. К. (март 1979 г.). «Субклеточная локализация белка-носителя ацила в протопластах листьев Spinacia oleracea». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 76 (3): 1194–8. Bibcode:1979PNAS ... 76.1194O. Дои:10.1073 / pnas.76.3.1194. ЧВК 383216. PMID 286305.
- ^ Компакт-диск Goodman, McFadden GI (январь 2007 г.). «Биосинтез жирных кислот как лекарственная мишень у апикомплексных паразитов». Curr Drug Targets. 8 (1): 15–30. Дои:10.2174/138945007779315579. PMID 17266528. S2CID 2565225.
дальнейшее чтение
- Уитли, Денис Н .; Поллак, Джеральд Х .; Кэмерон, Иван Л. (2006). Вода и клетка. Берлин: Springer. ISBN 1-4020-4926-9. OCLC 71298997.
