Метаболизм - Metabolism
| Часть серии по |
| Биохимия |
|---|
 |
| Ключевые компоненты |
| История биохимии |
| Глоссарии |
| Порталы: Биохимия |
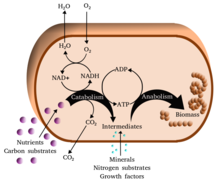

Метаболизм (/мəˈтæбəлɪzəм/, из Греческий: μεταβολή метаболе, "изменение") - набор жизнь -обеспечение химические реакции в организмы. Три основные цели метаболизма: преобразование пищи в энергия запускать клеточные процессы; преобразование продуктов питания / топлива в строительные блоки для белки, липиды, нуклеиновые кислоты, и немного углеводы; и устранение метаболические отходы. Эти фермент Катализируемые реакции позволяют организмам расти и воспроизводиться, поддерживать свои структуры и реагировать на окружающую среду. (Слово метаболизм может также относиться к сумме всех химических реакций, происходящих в живых организмах, включая пищеварение и перенос веществ в разные клетки и между ними, и в этом случае описанный выше набор реакций внутри клеток называется промежуточным метаболизмом или промежуточным метаболизмом).
Метаболические реакции можно разделить на следующие категории: катаболический - в разрушение соединений (например, расщепление глюкозы до пирувата путем клеточное дыхание ); или же анаболический - в наращивание (синтез ) соединений (таких как белки, углеводы, липиды и нуклеиновые кислоты). Обычно катаболизм высвобождает энергию, а анаболизм потребляет энергию.
Химические реакции метаболизма организованы в метаболические пути, в котором одно химическое вещество превращается через серию шагов в другое химическое вещество, при этом каждому шагу способствует определенный фермент. Ферменты имеют решающее значение для метаболизма, потому что они позволяют организмам вызывать желательные реакции, требующие энергия что не произойдет само по себе, связь их к спонтанные реакции которые высвобождают энергию. Ферменты действуют как катализаторы - они позволяют реакции протекать быстрее - и они также позволяют регулирование скорости метаболической реакции, например, в ответ на изменения в клетки окружающей среде или сигналы из других ячеек.
Метаболическая система конкретного организма определяет, какие вещества он найдет питательный и который ядовитый. Например, некоторые прокариоты использовать сероводород как питательное вещество, но этот газ ядовит для животных.[1] В базальная скорость метаболизма организма - это мера количества энергии, потребляемой всеми этими химическими реакциями.
Поразительной особенностью метаболизма является сходство основных метаболических путей у совершенно разных видов.[2] Например, набор карбоновые кислоты которые наиболее известны как промежуточные звенья в цикл лимонной кислоты присутствуют во всех известных организмах и встречаются у таких разнообразных видов, как одноклеточный бактерия кишечная палочка и огромный многоклеточные организмы подобно слоны.[3] Эти сходства в метаболических путях, вероятно, связаны с их ранним появлением у эволюционная история, и их удержание из-за их эффективность.[4][5] Метаболизм раковых клеток также отличается от метаболизма нормальных клеток, и эти различия можно использовать для поиска целей терапевтического вмешательства при раке.[6]
Ключевые биохимические вещества

Большинство структур, из которых состоят животные, растения и микробы, состоят из четырех основных классов молекула: аминокислоты, углеводы , нуклеиновая кислота и липиды (часто называют жиры ). Поскольку эти молекулы жизненно важны, метаболические реакции либо сосредоточены на создании этих молекул во время строительства клеток и тканей, либо на их расщеплении и использовании в качестве источника энергии при их переваривании. Эти биохимические вещества можно соединить вместе, чтобы получить полимеры Такие как ДНК и белки, существенный макромолекулы жизни.[7]
| Тип молекулы | Имя мономер формы | Имя полимер формы | Примеры полимерных форм |
|---|---|---|---|
| Аминокислоты | Аминокислоты | Белки (из полипептидов) | Волокнистые белки и глобулярные белки |
| Углеводы | Моносахариды | Полисахариды | Крахмал, гликоген и целлюлоза |
| Нуклеиновые кислоты | Нуклеотиды | Полинуклеотиды | ДНК и РНК |
Аминокислоты и белки
Белки сделаны из аминокислоты расположены в линейную цепочку, соединенную пептидные связи. Многие белки ферменты который катализировать химические реакции в обмене веществ. Другие белки выполняют структурные или механические функции, например те, которые образуют цитоскелет, система строительные леса который поддерживает форму клетки.[8] Белки также важны для клеточная сигнализация, иммунные ответы, клеточная адгезия, активный транспорт через мембраны, и клеточный цикл.[9] Аминокислоты также способствуют клеточному энергетическому метаболизму, обеспечивая источник углерода для входа в цикл лимонной кислоты (цикл трикарбоновых кислот ),[10] особенно когда первичный источник энергии, такой как глюкоза, является дефицитным или когда клетки подвергаются метаболическому стрессу.[11]
Липиды
Липиды являются самой разнообразной группой биохимических веществ. Их основное структурное использование - как часть биологические мембраны как внутренние, так и внешние, такие как клеточная мембрана, или как источник энергии.[9] Липиды обычно определяются как гидрофобный или же амфипатический биологические молекулы, но растворятся в органические растворители Такие как алкоголь, бензол или же хлороформ.[12] В жиры представляют собой большую группу соединений, содержащих жирные кислоты и глицерин; молекула глицерина, присоединенная к трем жирным кислотам сложные эфиры называется триацилглицерид.[13] Существует несколько вариантов этой базовой структуры, включая такие магистрали, как сфингозин в сфингомиелин, и гидрофильный такие группы как фосфат как в фосфолипиды. Стероиды Такие как стерол являются еще одним важным классом липидов.[14]
Углеводы

Углеводы находятся альдегиды или же кетоны, со многими гидроксил присоединенные группы, которые могут существовать как прямые цепи или кольца. Углеводы - это самые распространенные биологические молекулы, которые выполняют множество функций, таких как хранение и транспортировка энергия (крахмал, гликоген ) и конструктивные элементы (целлюлоза в растениях, хитин у животных).[9] Основные углеводные единицы называются моносахариды и включать галактоза, фруктоза, и, самое главное глюкоза. Моносахариды могут быть связаны вместе, чтобы образовать полисахариды практически безграничными способами.[15]
Нуклеотиды
Две нуклеиновые кислоты, ДНК и РНК, являются полимерами нуклеотиды. Каждый нуклеотид состоит из фосфата, присоединенного к рибоза или же дезоксирибоза сахарная группа, которая присоединена к азотистая основа. Нуклеиновые кислоты имеют решающее значение для хранения и использования генетической информации, а также ее интерпретации с помощью процессов транскрипция и биосинтез белка.[9] Эта информация защищена Ремонт ДНК механизмы и распространяется через Репликация ДНК. Много вирусы есть Геном РНК, Такие как ВИЧ, который использует обратная транскрипция для создания шаблона ДНК из его вирусного генома РНК.[16] РНК в рибозимы Такие как сплайсосомы и рибосомы похож на ферменты, поскольку он может катализировать химические реакции. Индивидуальный нуклеозиды сделаны путем прикрепления азотистое основание к рибоза сахар. Эти базы гетероциклический кольца, содержащие азот, классифицируются как пурины или же пиримидины. Нуклеотиды также действуют как коферменты в реакциях метаболической передачи группы.[17]
Коферменты

Метаболизм включает в себя широкий спектр химических реакций, но большинство из них относятся к нескольким основным типам реакций, которые включают передачу функциональные группы атомов и их связей внутри молекул.[18] Эта общая химия позволяет клеткам использовать небольшой набор промежуточных продуктов метаболизма для переноса химических групп между различными реакциями.[17] Эти промежуточные звенья групповой передачи называются коферменты. Каждый класс реакций передачи группы осуществляется определенным коферментом, которым является субстрат для набора ферментов, которые его производят, и набора ферментов, которые его потребляют. Таким образом, эти коферменты непрерывно производятся, потребляются, а затем перерабатываются.[19]
Один центральный кофермент аденозинтрифосфат (АТФ), универсальная энергетическая валюта клеток. Этот нуклеотид используется для передачи химической энергии между различными химическими реакциями. В клетках содержится лишь небольшое количество АТФ, но, поскольку он постоянно регенерируется, человеческое тело может использовать примерно его собственный вес в АТФ в день.[19] АТФ действует как мост между катаболизм и анаболизм. Катаболизм расщепляет молекулы, а анаболизм объединяет их. Катаболические реакции производят АТФ, а анаболические реакции потребляют его. Он также служит переносчиком фосфатных групп в фосфорилирование реакции.[20]
А витамин это органическое соединение, необходимое в небольших количествах, которое невозможно произвести в клетках. В питание человека, большинство витаминов после модификации действуют как коферменты; например, все водорастворимые витамины фосфорилируются или связываются с нуклеотидами, когда они используются в клетках.[21] Никотинамид аденин динуклеотид (НАД+), производное витамина B3 (ниацин ), является важным коферментом, который действует как акцептор водорода. Сотни отдельных видов дегидрогеназы удаляют электроны со своих подложек и уменьшать НАД+ в НАДН. Эта восстановленная форма кофермента затем является субстратом для любого из редуктазы в клетке, что необходимо уменьшить их субстраты.[22] Никотинамидадениндинуклеотид существует в клетке в двух родственных формах: НАДН и НАДФН. НАД+/ Форма НАДН более важна в катаболических реакциях, в то время как НАДФ+/ НАДФН используется в анаболических реакциях.[23]

Минералы и кофакторы
Неорганические элементы играют решающую роль в метаболизме; некоторые из них в изобилии (например, натрий и калий ), в то время как другие работают при минимальных концентрациях. Около 99% веса человека состоит из элементов. углерод, азот, кальций, натрий, хлор, калий, водород, фосфор, кислород и сера. Органические соединения (белки, липиды и углеводы) содержат большую часть углерода и азота; большая часть кислорода и водорода присутствует в виде воды.[24]
Обильные неорганические элементы действуют как электролиты. Наиболее важные ионы: натрий, калий, кальций, магний, хлористый, фосфат и органический ион бикарбонат. Поддержание точных ионные градиенты через клеточные мембраны поддерживает осмотическое давление и pH.[25] Ионы также важны для нерв и мышца функция, как потенциалы действия в этих тканях производятся обменом электролитов между внеклеточной жидкости и клеточная жидкость, цитозоль.[26] Электролиты проникают в клетки и покидают их через белки в клеточной мембране, называемые ионные каналы. Например, сокращение мышц зависит от движения кальция, натрия и калия по ионным каналам в клеточной мембране и Т-канальцы.[27]
Переходные металлы обычно присутствуют как микроэлементы в организмах, с цинк и утюг будучи самым многочисленным из них.[28] Эти металлы используются в некоторых белках как кофакторы и необходимы для активности ферментов, таких как каталаза и белки-переносчики кислорода, такие как гемоглобин[29] Металлические кофакторы прочно связаны со специфическими участками белков; хотя кофакторы ферментов можно модифицировать во время катализа, они всегда возвращаются в исходное состояние к концу катализируемой реакции. Металлические микроэлементы поглощаются организмами специфическими переносчиками и связываются с запасными белками, такими как ферритин или же металлотионеин когда не используется.[30][31]
Катаболизм
Катаболизм представляет собой набор метаболических процессов, которые разрушают большие молекулы. К ним относятся расщепление и окисление молекул пищи. Целью катаболических реакций является обеспечение энергии и компонентов, необходимых для анаболических реакций, которые создают молекулы.[32] Точная природа этих катаболических реакций различается от организма к организму, и организмы можно классифицировать на основе их источников энергии и углерода (их основные группы питания ), как показано в таблице ниже. Органические молекулы используются в качестве источника энергии. органотрофы, пока литотрофы использовать неорганические субстраты и фототрофы захватить солнечный свет как химическая энергия.[33] Однако все эти различные формы метаболизма зависят от редокс реакции, которые включают перенос электронов от восстановленных донорных молекул, таких как Органические молекулы, воды, аммиак, сероводород или же ионы двухвалентного железа к акцепторным молекулам, таким как кислород, нитрат или же сульфат. У животных эти реакции включают сложные Органические молекулы которые распадаются на более простые молекулы, такие как углекислый газ и вода. В фотосинтетический организмы, такие как растения и цианобактерии эти реакции переноса электрона не выделяют энергию, а используются как способ хранения энергии, поглощенной солнечным светом.[34]
| Энергетический ресурс | Солнечный свет | Фото- | -троф | ||
| Предварительно сформированные молекулы | химио- | ||||
| Электронный донор | органическое соединение | органо- | |||
| неорганическое соединение | лито- | ||||
| Источник углерода | органическое соединение | гетеро- | |||
| неорганическое соединение | авто- | ||||
Наиболее распространенный набор катаболических реакций у животных можно разделить на три основных этапа. На первом этапе большие органические молекулы, такие как белки, полисахариды или же липиды, перевариваются на более мелкие компоненты вне клеток. Затем эти более мелкие молекулы захватываются клетками и превращаются в более мелкие молекулы, обычно ацетилкофермент А (ацетил-КоА), который выделяет немного энергии. Наконец, ацетильная группа КоА окисляется до воды и диоксида углерода в цикл лимонной кислоты и электронная транспортная цепь, высвобождая энергию, которая сохраняется за счет восстановления кофермента никотинамид аденин динуклеотид (НАД+) в НАДН.[32]
Пищеварение
Макромолекулы не могут напрямую обрабатываться клетками. Макромолекулы необходимо разбить на более мелкие единицы, прежде чем они могут быть использованы в клеточном метаболизме. Для переваривания этих полимеров использовались различные классы ферментов. Эти пищеварительные ферменты включают протеазы которые переваривают белки в аминокислоты, а также гликозидгидролазы которые переваривают полисахариды в простые сахара, известные как моносахариды[36]
Микробы просто выделяют пищеварительные ферменты в окружающую среду,[37][38] в то время как животные секретируют эти ферменты только из специализированных клеток в своих кишки, в том числе желудок и поджелудочная железа, и слюнные железы.[39] Аминокислоты или сахара, выделяемые этими внеклеточными ферментами, затем закачиваются в клетки посредством активный транспорт белки.[40][41]
Энергия из органических соединений
Катаболизм углеводов - это расщепление углеводов на более мелкие единицы. Углеводы обычно попадают в клетки после того, как они переварены. моносахариды.[42] Попав внутрь, главный путь поломки - гликолиз, где сахара, такие как глюкоза и фруктоза преобразованы в пируват и образуется некоторое количество АТФ.[43] Пируват является промежуточным звеном в нескольких метаболических путях, но большая часть преобразуется в ацетил-КоА через аэробный (кислородный) гликолиз и подается в цикл лимонной кислоты. Хотя в цикле лимонной кислоты вырабатывается еще немного АТФ, наиболее важным продуктом является НАДН, который производится из НАД.+ поскольку ацетил-КоА окисляется. Это окисление высвобождает углекислый газ как отходы производства. В анаэробных условиях гликолиз производит лактат, через фермент лактатдегидрогеназа повторное окисление НАДН до НАД + для повторного использования в гликолизе.[44] Альтернативный способ расщепления глюкозы - это пентозофосфатный путь, который снижает кофермент НАДФН и производит пентоза сахара, такие как рибоза, сахарный компонент нуклеиновые кислоты.
Жиры катаболизируются гидролиз к свободным жирным кислотам и глицерину. Глицерин вступает в гликолиз, а жирные кислоты расщепляются бета-окисление для высвобождения ацетил-КоА, который затем подается в цикл лимонной кислоты. Жирные кислоты выделяют больше энергии при окислении, чем углеводы, потому что углеводы содержат больше кислорода в своей структуре. Некоторые бактерии также расщепляют стероиды в процессе, аналогичном бета-окислению, и этот процесс распада включает высвобождение значительных количеств ацетил-КоА, пропионил-КоА и пирувата, которые все могут использоваться клеткой для получения энергии. М. туберкулез также может расти на липиде холестерин в качестве единственного источника углерода, и гены, участвующие в пути (ах) использования холестерина, были признаны важными на различных этапах жизненного цикла инфекции М. туберкулез.[45]
Аминокислоты либо используются для синтеза белков и других биомолекул, либо окисляются до мочевина и диоксид углерода как источник энергии.[46] Путь окисления начинается с удаления аминогруппы трансаминаза. Аминогруппа поступает в цикл мочевины, оставляя деаминированный углеродный скелет в виде кетокислота. Некоторые из этих кетокислот являются промежуточными продуктами цикла лимонной кислоты, например дезаминирование глутамат образует α-кетоглутарат.[47] В глюкогенные аминокислоты также может быть преобразован в глюкозу через глюконеогенез (обсуждается ниже).[48]
Преобразования энергии
Окислительного фосфорилирования
При окислительном фосфорилировании электроны, удаленные из органических молекул в таких областях, как кислотный цикл протагона, передаются кислороду, а высвобождаемая энергия используется для производства АТФ. Это делается в эукариоты серией белков в мембранах митохондрий, называемых электронная транспортная цепь. В прокариоты эти белки находятся в клеточном внутренняя мембрана.[49] Эти белки используют энергию, выделяемую при прохождении электронов из уменьшенный молекулы, такие как НАДН, на кислород накачать протоны через мембрану.[50]

Выкачивание протонов из митохондрий создает протон разница концентраций через мембрану и создает электрохимический градиент.[51] Эта сила заставляет протоны возвращаться в митохондрии через основу фермента, называемого АТФ-синтаза. Поток протонов заставляет субъединицу стебля вращаться, вызывая активный сайт домена синтазы для изменения формы и фосфорилирования аденозиндифосфат - превращая его в АТФ.[19]
Энергия из неорганических соединений
Хемолитотрофия это тип метаболизма, обнаруженный в прокариоты где энергия получается за счет окисления неорганические соединения. Эти организмы могут использовать водород,[52] уменьшенный сера соединения (такие как сульфид, сероводород и тиосульфат ),[1] двухвалентное железо (FeII)[53] или же аммиак[54] как источники восстанавливающей силы, и они получают энергию от окисления этих соединений акцепторами электронов, такими как кислород или же нитрит.[55] Эти микробные процессы важны в глобальном биогеохимические циклы Такие как ацетогенез, нитрификация и денитрификация и имеют решающее значение для плодородие почвы.[56][57]
Энергия света
Энергия солнечного света улавливается растения, цианобактерии, пурпурные бактерии, зеленые серные бактерии и немного протисты. Этот процесс часто сочетается с преобразованием диоксида углерода в органические соединения в рамках фотосинтеза, который обсуждается ниже. Однако системы захвата энергии и фиксации углерода могут работать у прокариот по отдельности, поскольку пурпурные бактерии и зеленые серные бактерии могут использовать солнечный свет в качестве источника энергии, переключаясь между фиксацией углерода и ферментацией органических соединений.[58][59]
У многих организмов улавливание солнечной энергии в принципе аналогично окислительному фосфорилированию, поскольку оно включает накопление энергии в виде градиента концентрации протонов. Эта движущая сила протона затем управляет синтезом АТФ.[60] Электроны, необходимые для управления этой цепочкой переноса электронов, поступают от собирающих свет белков, называемых фотосинтетические реакционные центры. В зависимости от природы реакционных центров реакционные центры подразделяются на два типа. фотосинтетический пигмент В настоящее время большинство фотосинтезирующих бактерий имеют только один тип, а растения и цианобактерии - два.[61]
У растений, водорослей и цианобактерий фотосистема II использует световую энергию для удаления электронов из воды, выделяя кислород как отходы. Затем электроны текут в комплекс цитохрома b6f, который использует свою энергию для накачки протонов через тилакоид мембрана в хлоропласт.[34] Эти протоны движутся обратно через мембрану, как и раньше, управляя АТФ-синтазой. Затем электроны проходят через фотосистема I и затем может быть использован для восстановления кофермента НАДФ+.[62]fЭтот коэнзим можно использовать в Цикл Кальвина, который обсуждается ниже, или перерабатывается для дальнейшего образования АТФ.
Анаболизм
Анаболизм представляет собой набор конструктивных метаболических процессов, в которых энергия, выделяемая при катаболизме, используется для синтеза сложных молекул. В общем, сложные молекулы, из которых состоят клеточные структуры, строятся постепенно из небольших и простых предшественников. Анаболизм включает три основных этапа. Во-первых, производство прекурсоров, таких как аминокислоты, моносахариды, изопреноиды и нуклеотиды, во-вторых, их активация в реактивные формы с использованием энергии АТФ, и, в-третьих, сборка этих предшественников в сложные молекулы, такие как белки, полисахариды, липиды и нуклеиновые кислоты.[63]
Анаболизм у организмов может быть различным в зависимости от источника сконструированных молекул в их клетках. Автотрофы такие как растения, могут создавать сложные органические молекулы в клетках, такие как полисахариды и белки, из простых молекул, таких как углекислый газ и вода. Гетеротрофы с другой стороны, для производства этих сложных молекул требуется источник более сложных веществ, таких как моносахариды и аминокислоты. Организмы могут быть дополнительно классифицированы по конечному источнику их энергии: фотоавтотрофы и фотогетеротрофы получают энергию от света, тогда как хемоавтотрофы и хемогетеротрофы получают энергию от реакций неорганического окисления.[63]
Фиксация углерода

Фотосинтез - это синтез углеводов из солнечного света и углекислый газ (CO2). У растений, цианобактерий и водорослей кислородный фотосинтез расщепляет воду, а кислород образуется в качестве побочного продукта. В этом процессе используются АТФ и НАДФН, производимые фотосинтетические реакционные центры, как описано выше, для преобразования CO2 в глицерат 3-фосфат, который затем может быть преобразован в глюкозу. Эта реакция фиксации углерода осуществляется ферментом RuBisCO как часть Цикл Кальвина-Бенсона.[64] У растений происходит три типа фотосинтеза: Фиксация углерода C3, Фиксация углерода C4 и CAM фотосинтез. Они различаются маршрутом, по которому углекислый газ попадает в цикл Кальвина, при этом растения C3 фиксируют CO.2 непосредственно, в то время как фотосинтез C4 и CAM включает CO2 в другие соединения в первую очередь в качестве приспособлений для работы в условиях интенсивного солнечного света и засухи.[65]
В фотосинтезе прокариоты механизмы фиксации углерода более разнообразны. Здесь углекислый газ можно зафиксировать с помощью цикла Кальвина - Бенсона, а обращенная лимонная кислота цикл,[66] или карбоксилирование ацетил-КоА.[67][68] Прокариотический хемоавтотрофы также исправить CO2 через цикл Кальвина-Бенсона, но использовать энергию неорганических соединений для запуска реакции.[69]
Углеводы и гликаны
При углеводном анаболизме простые органические кислоты могут превращаться в моносахариды Такие как глюкоза а затем используется для сборки полисахариды Такие как крахмал. Поколение глюкоза из таких соединений, как пируват, лактат, глицерин, глицерат 3-фосфат и аминокислоты называется глюконеогенез. Глюконеогенез превращает пируват в глюкозо-6-фосфат через ряд промежуточных звеньев, многие из которых используются совместно с гликолиз.[43] Однако этот путь не просто гликолиз работают в обратном порядке, так как несколько стадий катализируются негликолитическими ферментами. Это важно, поскольку позволяет регулировать образование и распад глюкозы по отдельности и предотвращает одновременное функционирование обоих путей в организме. бесполезный цикл.[70][71]
Хотя жир - распространенный способ сохранения энергии, в позвоночные такие как люди жирные кислоты в этих магазинах невозможно преобразовать в глюкозу через глюконеогенез поскольку эти организмы не могут превращать ацетил-КоА в пируват; у растений есть необходимый ферментативный аппарат, а у животных его нет.[72] В результате после длительного голодания позвоночные животные должны производить кетоновые тела из жирных кислот для замены глюкозы в тканях, таких как мозг, которые не могут метаболизировать жирные кислоты.[73] У других организмов, таких как растения и бактерии, эта метаболическая проблема решается с помощью глиоксилатный цикл, что обходит декарбоксилирование стадии цикла лимонной кислоты и позволяет превращать ацетил-КоА в оксалоацетат, где его можно использовать для производства глюкозы.[72][74] Помимо жира, глюкоза хранится в большинстве тканей в качестве энергетического ресурса, доступного в тканях через гликогенез, который обычно использовался для поддержания уровня глюкозы в крови.[75]
Полисахариды и гликаны производятся путем последовательного добавления моносахаридов путем гликозилтрансфераза от реактивного донора сахара-фосфата, такого как уридиндифосфат глюкоза (UDP-Glc) к акцептору гидроксил группа по растущему полисахариду. Как и любой гидроксил группы на кольце субстрата могут быть акцепторами, полученные полисахариды могут иметь прямую или разветвленную структуру.[76] Полученные полисахариды могут сами выполнять структурные или метаболические функции или переноситься на липиды и белки с помощью ферментов, называемых олигосахарилтрансферазы.[77][78]
Жирные кислоты, изопреноиды и стерол

Жирные кислоты производятся синтазы жирных кислот которые полимеризуются, а затем восстанавливают звенья ацетил-КоА. Ацильные цепи в жирных кислотах расширяются за счет цикла реакций, которые добавляют ацильную группу, восстанавливают ее до спирта, обезвоживать это к алкен группу, а затем снова уменьшите ее до алкан группа. Ферменты биосинтеза жирных кислот делятся на две группы: у животных и грибов все эти реакции синтазы жирных кислот осуществляются с помощью одного многофункционального белка типа I,[79] пока на заводе пластиды и бактерии, отдельные ферменты типа II, выполняют каждый этап этого пути.[80][81]
Терпены и изопреноиды представляют собой большой класс липидов, которые включают каротиноиды и образуют самый большой класс растений натуральные продукты.[82] Эти соединения производятся путем сборки и модификации изопрен единиц, пожертвованных из реактивных прекурсоров изопентенилпирофосфат и диметилаллил пирофосфат.[83] Эти предшественники могут быть изготовлены по-разному. У животных и архей мевалонатный путь производит эти соединения из ацетил-КоА,[84] в то время как у растений и бактерий немевалонатный путь использует пируват и глицеральдегид-3-фосфат в качестве подложек.[83][85] Одной из важных реакций, в которых используются эти активированные доноры изопрена, является биосинтез стеролов. Здесь изопреновые единицы соединяются вместе, чтобы сделать сквален а затем сложили и сформировали набор колец, чтобы сделать ланостерин.[86] Затем ланостерин может быть преобразован в другой стерол, такой как холестерин и эргостерин.[86][87]
Белки
Организмы различаются по способности синтезировать 20 распространенных аминокислот. Большинство бактерий и растений могут синтезировать все двадцать, но млекопитающие могут синтезировать только одиннадцать заменимых аминокислот, так что девять незаменимые аминокислоты должен быть получен из пищи.[9] Некоторые простые паразиты, например, бактерии Mycoplasma pneumoniae, лишены синтеза всех аминокислот и берут свои аминокислоты непосредственно у хозяина.[88] Все аминокислоты синтезируются из промежуточных продуктов в гликолизе, цикле лимонной кислоты или пентозофосфатном пути. Азот предоставляется глутамат и глутамин. Несенсорный синтез аминокислот зависит от образования соответствующей альфа-кетокислоты, которая затем трансаминированный с образованием аминокислоты.[89]
Аминокислоты превращаются в белки, соединяясь в цепочку пептидные связи. Каждый отдельный белок имеет уникальную последовательность аминокислотных остатков: это его первичная структура. Подобно тому, как буквы алфавита можно комбинировать, чтобы образовать почти бесконечное множество слов, аминокислоты могут быть связаны в различных последовательностях, образуя огромное разнообразие белков. Белки состоят из аминокислот, которые были активированы прикреплением к переносить РНК молекула через сложный эфир связь. Этот аминоацил-тРНК прекурсор производится в АТФ -зависимая реакция, осуществляемая аминоацил тРНК синтетаза.[90] Эта аминоацил-тРНК затем является субстратом для рибосома, который присоединяет аминокислоту к удлиненной цепи белка, используя информацию о последовательности в информационная РНК.[91]
Синтез и утилизация нуклеотидов
Нуклеотиды состоят из аминокислот, двуокиси углерода и муравьиная кислота в путях, требующих большого количества метаболической энергии.[92] Следовательно, у большинства организмов есть эффективные системы для спасения предварительно образованных нуклеотидов.[92][93] Пурины синтезируются как нуклеозиды (базы прикреплены к рибоза ).[94] Обе аденин и гуанин сделаны из предшественника нуклеозида инозин монофосфат, который синтезируется с использованием атомов из аминокислот глицин, глутамин, и аспарагиновая кислота, а также форматировать переведен из кофермент тетрагидрофолат. Пиримидины, с другой стороны, синтезируются из базовых ругать, который образуется из глутамина и аспартата.[95]
Ксенобиотики и окислительно-восстановительный метаболизм
Все организмы постоянно подвергаются воздействию соединений, которые они не могут использовать в качестве продуктов питания и могут быть вредными, если накапливаются в клетках, поскольку не имеют метаболической функции. Эти потенциально опасные соединения называются ксенобиотики.[96] Ксенобиотики, такие как синтетические наркотики, природные яды и антибиотики детоксифицируются набором ферментов, метаболизирующих ксенобиотики. У людей к ним относятся: оксидазы цитохрома P450,[97] UDP-глюкуронозилтрансферазы,[98] и глутатион S-трансферазы.[99] Эта система ферментов действует в три этапа, сначала окисляя ксенобиотик (фаза I), а затем конъюгируя водорастворимые группы с молекулой (фаза II). Затем модифицированный водорастворимый ксенобиотик может быть откачан из клеток и в многоклеточных организмах может подвергнуться дальнейшему метаболизму перед выведением из организма (фаза III). В экология, эти реакции особенно важны для микробных биоразложение загрязняющих веществ и биоремедиация загрязненных земель и разливов нефти.[100] Многие из этих микробных реакций характерны для многоклеточных организмов, но из-за невероятного разнообразия типов микробов эти организмы могут иметь дело с гораздо более широким спектром ксенобиотиков, чем многоклеточные организмы, и могут даже разлагаться. стойкие органические загрязнители Такие как хлорорганические соединения соединения.[101]
Связанная проблема для аэробные организмы является окислительный стресс.[102] Здесь процессы, включающие окислительного фосфорилирования и формирование дисульфидные связи в течение сворачивание белка производить активные формы кислорода Такие как пероксид водорода.[103] Эти разрушающие окислители удаляются антиоксидант метаболиты, такие как глутатион и ферменты, такие как каталазы и пероксидазы.[104][105]
Термодинамика живых организмов
Живые организмы должны подчиняться законы термодинамики, которые описывают перенос тепла и работай. В второй закон термодинамики заявляет, что в любом закрытая система, количество энтропия (беспорядок) не может уменьшиться. Хотя удивительная сложность живых организмов, кажется, противоречит этому закону, жизнь возможна, как и все организмы. открытые системы которые обмениваются материей и энергией со своим окружением. Таким образом, живые системы не в равновесие, но вместо этого диссипативные системы которые поддерживают свое состояние высокой сложности, вызывая большее увеличение энтропии окружающей среды.[106] Метаболизм клетки достигает этого путем связывания спонтанные процессы катаболизма к неспонтанным процессам анаболизма. В термодинамический термины, метаболизм поддерживает порядок, создавая беспорядок.[107]
Регулирование и контроль
Поскольку среда обитания большинства организмов постоянно меняется, реакции метаболизма должны быть точными. регулируемый для поддержания постоянного набора условий в ячейках, условие, называемое гомеостаз.[108][109] Метаболическая регуляция также позволяет организмам реагировать на сигналы и активно взаимодействовать со своей средой.[110] Две тесно связанные концепции важны для понимания того, как контролируются метаболические пути. Во-первых, регулирование фермента в метаболическом пути - это то, как его активность увеличивается и уменьшается в ответ на сигналы. Во-вторых, контроль Этот фермент оказывает влияние, которое эти изменения в его активности оказывают на общую скорость пути ( поток через тропинку).[111] Например, фермент может проявлять большие изменения в активности (т.е. он сильно регулируется), но если эти изменения мало влияют на ход метаболического пути, то этот фермент не участвует в контроле этого пути.[112]
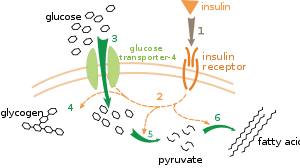
Есть несколько уровней регуляции метаболизма. При внутренней регуляции метаболический путь саморегулируется, чтобы реагировать на изменения уровней субстратов или продуктов; например, уменьшение количества продукта может увеличить поток через путь, чтобы компенсировать.[111] Этот тип регулирования часто включает аллостерическая регуляция активности нескольких ферментов пути.[113] Внешний контроль включает в себя клетку многоклеточного организма, изменяющую свой метаболизм в ответ на сигналы от других клеток. Эти сигналы обычно имеют форму водорастворимых мессенджеров, таких как гормоны и факторы роста и обнаруживаются специфическими рецепторы на поверхности клетки.[114] Эти сигналы затем передаются внутри ячейки посредством системы вторичных сообщений это часто вовлекало фосфорилирование белков.[115]
Очень хорошо понятный пример внешнего контроля - регуляция метаболизма глюкозы гормоном. инсулин.[116] Инсулин вырабатывается в ответ на повышение уровень глюкозы в крови. Связывание гормона с рецепторы инсулина на клетки затем активирует каскад протеинкиназы которые заставляют клетки поглощать глюкозу и превращать ее в запасные молекулы, такие как жирные кислоты и гликоген.[117] Метаболизм гликогена контролируется активностью фосфорилаза, фермент, расщепляющий гликоген, и гликогенсинтаза, фермент, который его делает. Эти ферменты регулируются реципрокным образом, при этом фосфорилирование ингибирует гликогенсинтазу, но активирует фосфорилазу. Инсулин вызывает синтез гликогена, активируя протеинфосфатазы и вызывая снижение фосфорилирования этих ферментов.[118]
Эволюция
Описанные выше центральные пути метаболизма, такие как гликолиз и цикл лимонной кислоты, присутствуют во всех три домена живых существ и присутствовали в последний универсальный общий предок.[3][119] Эта универсальная наследственная ячейка была прокариотический и, вероятно, метаноген которые имели обширный аминокислотный, нуклеотидный, углеводный и липидный обмен.[120][121] Сохранение этих древних путей в дальнейшем эволюция могут быть результатом того, что эти реакции были оптимальным решением их конкретных метаболических проблем с такими путями, как гликолиз и цикл лимонной кислоты, производящие их конечные продукты высокоэффективно и за минимальное количество этапов.[4][5] Первые пути метаболизма на основе ферментов могли быть частью пурин метаболизм нуклеотидов, в то время как предыдущие метаболические пути были частью древних Мир РНК.[122]
Было предложено множество моделей для описания механизмов, с помощью которых развиваются новые метаболические пути. К ним относятся последовательное добавление новых ферментов к короткому наследственному пути, дублирование, а затем расхождение целых путей, а также привлечение ранее существовавших ферментов и их сборка в новый путь реакции.[123] Относительная важность этих механизмов неясна, но геномные исследования показали, что ферменты в пути, вероятно, имеют общее происхождение, что позволяет предположить, что многие пути эволюционировали поэтапно с новыми функциями, созданными из уже существующих этапов. в пути.[124] Альтернативная модель исходит из исследований, которые отслеживают эволюцию структур белков в метаболических сетях, это предполагает, что ферменты повсеместно задействуются, заимствуя ферменты для выполнения аналогичных функций в различных метаболических путях (что очевидно на примере База данных MANET )[125] Эти процессы набора приводят к эволюционной ферментативной мозаике.[126] Третья возможность заключается в том, что некоторые части метаболизма могут существовать в виде «модулей», которые можно повторно использовать в различных путях и выполнять аналогичные функции на разных молекулах.[127]
Помимо эволюции новых метаболических путей, эволюция также может вызвать потерю метаболических функций. Например, в некоторых паразиты метаболические процессы, которые не являются необходимыми для выживания, теряются, и вместо этого преформированные аминокислоты, нуклеотиды и углеводы могут быть удалены из хозяин.[128] Аналогичное снижение метаболических возможностей наблюдается у эндосимбиотический организмы.[129]
Расследование и манипуляции

Классически метаболизм изучается редукционист подход, который фокусируется на одном метаболическом пути. Особенно ценно использование радиоактивные индикаторы на уровне всего организма, тканей и клеток, которые определяют пути от прекурсоров к конечным продуктам, идентифицируя радиоактивно меченные промежуточные продукты и продукты.[130] Ферменты, которые катализируют эти химические реакции, затем могут быть очищенный и их кинетика и ответы на ингибиторы исследованы. Параллельный подход заключается в идентификации небольших молекул в клетке или ткани; полный набор этих молекул называется метаболом. В целом, эти исследования дают хорошее представление о структуре и функциях простых метаболических путей, но неадекватны при применении к более сложным системам, таким как метаболизм целой клетки.[131]
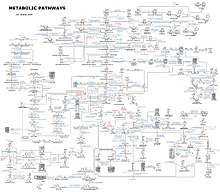
Представление о сложности метаболические сети в клетках, которые содержат тысячи различных ферментов, показано справа на рисунке, показывающем взаимодействия между 43 белками и 40 метаболитами: последовательности геномов предоставляют списки, содержащие до 26 500 генов.[132] Однако теперь можно использовать эти геномные данные для реконструкции полных сетей биохимических реакций и получения большего количества целостный математические модели, которые могут объяснять и предсказывать их поведение.[133] Эти модели особенно эффективны, когда они используются для интеграции данных о путях и метаболитах, полученных с помощью классических методов, с данными о экспрессия гена из протеомный и Микрочип ДНК исследования.[134] Используя эти методы, теперь создана модель метаболизма человека, которая будет определять будущие открытия лекарств и биохимические исследования.[135] Эти модели сейчас используются в сетевой анализ, чтобы классифицировать болезни человека по группам, которые имеют общие белки или метаболиты.[136][137]
Бактериальные метаболические сети - яркий пример галстук-бабочка[138][139][140] организация, архитектура, способная вводить широкий спектр питательных веществ и производить большое количество продуктов и сложных макромолекул с использованием относительно небольшого количества промежуточных общих валют.
Основное технологическое применение этой информации: метаболическая инженерия. Здесь такие организмы, как дрожжи, растения или бактерии генетически модифицированы, чтобы сделать их более полезными в биотехнология и помочь производству наркотики Такие как антибиотики или промышленные химикаты, такие как 1,3-пропандиол и шикимовая кислота.[141] Эти генетические модификации обычно направлены на уменьшение количества энергии, используемой для производства продукта, повышение урожайности и сокращение образования отходов.[142]
История
Период, термин метаболизм происходит от Французский "метаболизм" или Древнегреческий μεταβολή - «Metabole» для «изменения», которое происходит от μεταβάλλ - «Metaballein» означает «Изменять»[143]
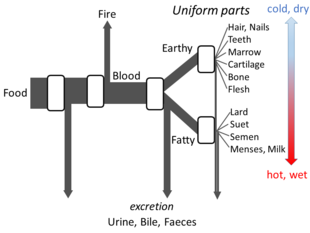
Греческая философия
Аристотель с Части животных излагает достаточно деталей его взгляды на метаболизм для создания модели открытого потока. Он считал, что на каждой стадии процесса материалы из пищи трансформируются, а тепло выделяется в виде классический элемент пожара и выделения остаточных материалов в виде мочи, желчи или фекалий.[144]
Исламская медицина
Ибн ан-Нафис описал метаболизм в своей работе 1260 г. Аль-Рисала аль-Камилия фил Сира ан-Набавийя (Трактат Камиля о биографии Пророка), который включал следующую фразу: «И тело, и его части находятся в непрерывном состоянии растворения и питания, поэтому они неизбежно претерпевают постоянные изменения».[145]
Применение научного метода
История научного изучения метаболизма насчитывает несколько веков и перешла от изучения животных целиком в ранних исследованиях к изучению индивидуальных метаболических реакций в современной биохимии. Первый контролируемый эксперименты в метаболизме человека были опубликованы Санторио Санторио в 1614 г. в своей книге Ars de statica medicina.[146] Он описал, как взвешивался до и после еды, спать, работа, секс, голодание, питье и выделение. Он обнаружил, что большая часть еды, которую он принимал, была потеряна из-за того, что он называл "бесчувственный пот ".

В этих ранних исследованиях механизмы этих метаболических процессов не были идентифицированы, и жизненная сила считалось, что он оживляет живую ткань.[147] В 19 веке при изучении ферментация сахара в алкоголь к дрожжи, Луи Пастер пришел к выводу, что ферментация катализируется веществами в дрожжевых клетках, которые он назвал «ферментами». Он писал, что «алкогольное брожение - это действие, связанное с жизнью и организацией дрожжевых клеток, а не со смертью или разложением клеток».[148] Это открытие вместе с публикацией Фридрих Вёлер в 1828 году о химическом синтезе мочевина,[149] и примечателен тем, что является первым органическим соединением, полученным из полностью неорганических предшественников. Это доказало, что органические соединения и химические реакции, обнаруживаемые в клетках, в принципе ничем не отличаются от любой другой области химии.
Это было открытие ферменты в начале 20 века Эдуард Бюхнер это отделило изучение химических реакций метаболизма от биологических исследований клеток и положило начало биохимия.[150] Масса биохимических знаний быстро росла в начале 20 века. Один из самых плодовитых современных биохимиков был Ганс Кребс кто внес огромный вклад в изучение обмена веществ.[151] Он открыл цикл мочевины и позже, работая с Ханс Корнберг, цикл лимонной кислоты и цикл глиоксилата.[152][74] Современным биохимическим исследованиям в значительной степени способствовала разработка новых методов, таких как хроматография, дифракция рентгеновских лучей, ЯМР-спектроскопия, радиоизотопное мечение, электронная микроскопия и молекулярная динамика симуляции. Эти методы позволили открыть и детально проанализировать многие молекулы и метаболические пути в клетках.
Смотрите также
- Антропогенный метаболизм
- Антиметаболит
- Базальная скорость метаболизма
- Калориметрия - Измерение термодинамического состояния
- Изотермическая микрокалориметрия
- Врожденные нарушения обмена веществ
- Гипотеза железо-серного мира - Гипотетический сценарий происхождения жизни, теория "сначала метаболизм" происхождение жизни
- Нарушение обмена веществ
- Микрофизиометрия
- Основные группы питания
- Респирометрия - Оценка скорости метаболизма путем измерения производства тепла
- Поток метаболизма
- Обмен серы
- Термический эффект пищи
- Городской метаболизм
- Водный обмен
- Переполнение метаболизма
- Reactome - База данных биологических путей
- КЕГГ
Рекомендации
- ^ а б Фридрих C (1998). Физиология и генетика сероокисляющих бактерий. Adv Microb Physiol. Успехи микробной физиологии. 39. С. 235–89. Дои:10.1016 / S0065-2911 (08) 60018-1. ISBN 978-0-12-027739-1. PMID 9328649.
- ^ Pace NR (январь 2001 г.). «Универсальный характер биохимии». Труды Национальной академии наук Соединенных Штатов Америки. 98 (3): 805–8. Bibcode:2001ПНАС ... 98..805П. Дои:10.1073 / пнас.98.3.805. ЧВК 33372. PMID 11158550.
- ^ а б Смит Э., Моровиц Х. Дж. (Сентябрь 2004 г.). «Универсальность в промежуточном метаболизме». Труды Национальной академии наук Соединенных Штатов Америки. 101 (36): 13168–73. Bibcode:2004ПНАС..10113168С. Дои:10.1073 / pnas.0404922101. ЧВК 516543. PMID 15340153.
- ^ а б Эбенхох О., Генрих Р. (январь 2001 г.). «Эволюционная оптимизация метаболических путей. Теоретическая реконструкция стехиометрии систем продуцирования АТФ и НАДН». Вестник математической биологии. 63 (1): 21–55. Дои:10.1006 / bulm.2000.0197. PMID 11146883. S2CID 44260374.
- ^ а б Мелендес-Хевиа Е., Уодделл Т.Г., Кастанте М. (сентябрь 1996 г.). «Загадка цикла лимонной кислоты Кребса: сборка частей химически осуществимых реакций и оппортунизм в дизайне метаболических путей в ходе эволюции». Журнал молекулярной эволюции. 43 (3): 293–303. Bibcode:1996JMolE..43..293M. Дои:10.1007 / BF02338838. PMID 8703096. S2CID 19107073.
- ^ Vander Heiden MG, DeBerardinis RJ (февраль 2017 г.). «Понимание взаимосвязей между метаболизмом и биологией рака». Клетка. 168 (4): 657–669. Дои:10.1016 / j.cell.2016.12.039. ЧВК 5329766. PMID 28187287.
- ^ Купер GM (2000). «Молекулярный состав клеток». Клетка: молекулярный подход. 2-е издание.
- ^ Мичи КА, Лёве Дж (2006). «Динамические нити цитоскелета бактерий». Ежегодный обзор биохимии. 75: 467–92. Дои:10.1146 / annurev.biochem.75.103004.142452. PMID 16756499. S2CID 4550126.
- ^ а б c d е Нельсон Д.Л., Кокс М.М. (2005). Принципы биохимии Ленингера. Нью-Йорк: У. Х. Фриман и компания. п.841. ISBN 978-0-7167-4339-2.
- ^ Келлехер Дж. К., Брайан Б. М., Маллет Р. Т., Холлеран А. Л., Мерфи А. Н., Фискум Г. (сентябрь 1987 г.). «Анализ метаболизма цикла трикарбоновых кислот в клетках гепатомы путем сравнения соотношений 14CO2». Биохимический журнал. 246 (3): 633–9. Дои:10.1042 / bj2460633. ЧВК 1148327. PMID 3120698.
- ^ Хотерсалл Дж. С., Ахмед А. (2013). «Метаболическая судьба повышенного поглощения аминокислот дрожжами после катаболической дерепрессии». Журнал аминокислот. 2013: 461901. Дои:10.1155/2013/461901. ЧВК 3575661. PMID 23431419.
- ^ Fahy E, Subramaniam S, Brown HA, Glass CK, Merrill AH, Murphy RC и др. (Май 2005 г.). «Комплексная система классификации липидов». Журнал липидных исследований. 46 (5): 839–61. Дои:10.1194 / мл. E400004-JLR200. PMID 15722563.
- ^ «Липидная номенклатура Lip-1 & Lip-2». www.qmul.ac.uk. Получено 6 июн 2020.
- ^ Берг Дж. М., Тимочко Дж. Л., Гатто Дж. Дж., Страйер Л. (8 апреля 2015 г.). Биохимия (8-е изд.). Нью-Йорк: У. Х. Фриман. п. 362. ISBN 978-1-4641-2610-9. OCLC 913469736.
- ^ Раман Р., Рагурам С., Венкатараман Дж., Полсон Дж. К., Сасисекхаран Р. (ноябрь 2005 г.). «Гликомика: комплексный системный подход к структурно-функциональным отношениям гликанов». Методы природы. 2 (11): 817–24. Дои:10.1038 / nmeth807. PMID 16278650. S2CID 4644919.
- ^ Сьерра С., Купфер Б., Кайзер Р. (декабрь 2005 г.). «Основы вирусологии ВИЧ-1 и его репликации». Журнал клинической вирусологии. 34 (4): 233–44. Дои:10.1016 / j.jcv.2005.09.004. PMID 16198625.
- ^ а б Виммер MJ, Роуз И.А. (1978). «Механизмы ферментативно-катализируемых реакций передачи группы». Ежегодный обзор биохимии. 47: 1031–78. Дои:10.1146 / annurev.bi.47.070178.005123. PMID 354490.
- ^ Митчелл П. (март 1979 г.). «Девятая лекция сэра Ганса Кребса. Компартментация и коммуникация в живых системах. Лигандная проводимость: общий каталитический принцип в системах химических, осмотических и хемиосмотических реакций». Европейский журнал биохимии. 95 (1): 1–20. Дои:10.1111 / j.1432-1033.1979.tb12934.x. PMID 378655.
- ^ а б c Димрот П., фон Баллмос С., Мейер Т. (март 2006 г.). «Каталитические и механические циклы в F-ATP-синтазах. Четвертое в серии обзоров Cycles». EMBO отчеты. 7 (3): 276–82. Дои:10.1038 / sj.embor.7400646. ЧВК 1456893. PMID 16607397.
- ^ Bonora M, Patergnani S, Rimessi A, De Marchi E, Suski JM, Bononi A и др. (Сентябрь 2012 г.). «Синтез и хранение АТФ». Пуринергическая передача сигналов. 8 (3): 343–57. Дои:10.1007 / s11302-012-9305-8. ЧВК 3360099. PMID 22528680.
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2002). «Витамины часто являются предшественниками коферментов». Биохимия. 5-е издание.
- ^ Поллак Н., Дёлле С., Циглер М. (март 2007 г.). «Способность восстанавливать: пиридиновые нуклеотиды - небольшие молекулы с множеством функций». Биохимический журнал. 402 (2): 205–18. Дои:10.1042 / BJ20061638. ЧВК 1798440. PMID 17295611.
- ^ Фатих Y (2009). Достижения в пищевой биохимии. Бока-Ратон: CRC Press. п. 228. ISBN 978-1-4200-0769-5. OCLC 607553259.
- ^ Хеймсфилд С.Б., Ваки М., Кехайас Дж., Лихтман С., Дилманиан Ф.А., Камен Ю. и др. (Август 1991 г.). «Химический и элементный анализ человека in vivo с использованием улучшенных моделей состава тела». Американский журнал физиологии. 261 (2, часть 1): E190-8. Дои:10.1152 / ajpendo.1991.261.2.E190. PMID 1872381.
- ^ «Электролитный баланс». Анатомия и психология. OpenStax. Получено 23 июн 2020.
- ^ Лодиш Х, Берк А, Зипурски С.Л., Мацудаира П., Балтимор Д., Дарнелл Дж. (2000). «Возможности действия и проведение электрических импульсов». Молекулярная клеточная биология (4-е изд.) - через NCBI.
- ^ Дулханти AF (сентябрь 2006 г.). «Связь возбуждения-сжатия из 1950-х годов в новое тысячелетие». Клиническая и экспериментальная фармакология и физиология. 33 (9): 763–72. Дои:10.1111 / j.1440-1681.2006.04441.x. PMID 16922804. S2CID 37462321.
- ^ Торрес-Ромеро Й.С., Альварес-Санчес М.Э., Фернандес-Мартин К., Альварес-Санчес Л.С., Арана-Аргаес В., Рамирес-Камачо М., Лара-Риегос Дж. (2018).«Отток цинка в Trichomonas vaginalis: идентификация in Silico и анализ экспрессии CDF-подобных генов». В Olivares-Quiroz L, Resendis-Antonio O (ред.). Количественные модели для микроскопических и макроскопических биологических макромолекул и тканей. Чам: Издательство Springer International. С. 149–168. Дои:10.1007/978-3-319-73975-5_8. ISBN 978-3-319-73975-5.
- ^ Крейг Уилл Лос-Анджелес (2019). Производство и технологии. Уолтем Аббатство: Электронные научные ресурсы. С. 190–196. ISBN 9781839472428.
- ^ Казинс Р.Дж., Лиуцци Дж. П., Лихтен Л.А. (август 2006 г.). «Транспортировка, незаконный оборот цинка млекопитающими и сигналы». Журнал биологической химии. 281 (34): 24085–9. Дои:10.1074 / jbc.R600011200. PMID 16793761.
- ^ Данн Л.Л., Сурё Рахманто Й., Ричардсон Д.Р. (февраль 2007 г.). «Поглощение и метаболизм железа в новом тысячелетии». Тенденции в клеточной биологии. 17 (2): 93–100. Дои:10.1016 / j.tcb.2006.12.003. PMID 17194590.
- ^ а б Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Как клетки получают энергию из пищи». Молекулярная биология клетки (4-е изд.) - через NCBI.
- ^ Raven J (3 сентября 2009 г.). «Вклад аноксигенной и кислородной фототрофии и хемолитотрофии в потоки углерода и кислорода в водной среде». Экология водных микробов. 56: 177–192. Дои:10.3354 / ame01315. ISSN 0948-3055.
- ^ а б Нельсон Н., Бен-Шем А. (декабрь 2004 г.). «Сложная архитектура кислородного фотосинтеза». Обзоры природы. Молекулярная клеточная биология. 5 (12): 971–82. Дои:10.1038 / nrm1525. PMID 15573135. S2CID 5686066.
- ^ Мэдиган MT, Мартинко JM (2006). Брок Микробиология (11., überarb. Aufl ed.). Мюнхен: Pearson Studium. С. 604, 621. ISBN 3-8273-7187-2. OCLC 162303067.
- ^ Демирель, Яшар (2016). Энергия: производство, преобразование, хранение, сохранение и связывание (Второе изд.). Линкольн: Спрингер. п. 431. ISBN 978-3-319-29650-0. OCLC 945435943.
- ^ Häse CC, Финкельштейн Р.А. (декабрь 1993 г.). «Бактериальные внеклеточные цинксодержащие металлопротеиназы». Микробиологические обзоры. 57 (4): 823–37. Дои:10.1128 / MMBR.57.4.823-837.1993. ЧВК 372940. PMID 8302217.
- ^ Гупта Р., Гупта Н., Рати П. (июнь 2004 г.). «Бактериальные липазы: обзор производства, очистки и биохимических свойств». Прикладная микробиология и биотехнология. 64 (6): 763–81. Дои:10.1007 / s00253-004-1568-8. PMID 14966663. S2CID 206934353.
- ^ Хойл Т. (1997). «Пищеварительная система: связь теории и практики». Британский журнал медсестер. 6 (22): 1285–91. Дои:10.12968 / bjon.1997.6.22.1285. PMID 9470654.
- ^ Souba WW, Pacitti AJ (1992). «Как аминокислоты попадают в клетки: механизмы, модели, меню и медиаторы». JPEN. Журнал парентерального и энтерального питания. 16 (6): 569–78. Дои:10.1177/0148607192016006569. PMID 1494216.
- ^ Барретт М.П., Уолмсли А.Р., Гулд Г.В. (август 1999 г.). «Структура и функции вспомогательных транспортеров сахара». Текущее мнение в области клеточной биологии. 11 (4): 496–502. Дои:10.1016 / S0955-0674 (99) 80072-6. PMID 10449337.
- ^ Белл Г.И., Бурант С.Ф., Такеда Дж., Гулд Г.В. (сентябрь 1993 г.). «Структура и функции млекопитающих облегчающих переносчиков сахара». Журнал биологической химии. 268 (26): 19161–4. PMID 8366068.
- ^ а б Буше С., Серди С., Кан Ч.Р., Goldfine AB (октябрь 2004 г.). «Клеточная судьба глюкозы и ее значение при диабете 2 типа». Эндокринные обзоры. 25 (5): 807–30. Дои:10.1210 / er.2003-0026. PMID 15466941.
- ^ Alfarouk KO, Verduzco D, Rauch C, Muddathir AK, Adil HH, Elhassan GO и др. (18 декабря 2014 г.). «Гликолиз, метаболизм опухоли, рост и распространение рака. Новая этиопатогенная перспектива на основе pH и терапевтический подход к старому вопросу рака». Онкология. 1 (12): 777–802. Дои:10.18632 / oncoscience.109. ЧВК 4303887. PMID 25621294.
- ^ Випперман М.Ф., Сэмпсон Н.С., Томас С.Т. (2014). «Возбудитель ярости: использование холестерина микобактериями туберкулеза». Критические обзоры в биохимии и молекулярной биологии. 49 (4): 269–93. Дои:10.3109/10409238.2014.895700. ЧВК 4255906. PMID 24611808.
- ^ Саками В., Харрингтон Х (1963). «Аминокислотный метаболизм». Ежегодный обзор биохимии. 32: 355–98. Дои:10.1146 / annurev.bi.32.070163.002035. PMID 14144484.
- ^ Brosnan JT (апрель 2000 г.). «Глутамат на стыке обмена аминокислот и углеводов». Журнал питания. 130 (4S Suppl): 988S – 90S. Дои:10.1093 / jn / 130.4.988S. PMID 10736367.
- ^ Молодой В.Р., Аджами А.М. (сентябрь 2001 г.). «Глютамин: император или его одежда?». Журнал питания. 131 (9 Прил.): 2449S – 59S, обсуждение 2486S – 7S. Дои:10.1093 / jn / 131.9.2449S. PMID 11533293.
- ^ Хослер Дж. П., Фергюсон-Миллер С., Миллс Д. А. (2006). «Передача энергии: перенос протона через дыхательные комплексы». Ежегодный обзор биохимии. 75: 165–87. Дои:10.1146 / annurev.biochem.75.062003.101730. ЧВК 2659341. PMID 16756489.
- ^ Шульц Б.Е., Чан С.И. (2001). «Структуры и стратегии протонной накачки митохондриальных респираторных ферментов» (PDF). Ежегодный обзор биофизики и структуры биомолекул. 30: 23–65. Дои:10.1146 / annurev.biophys.30.1.23. PMID 11340051.
- ^ Капальди Р.А., Аггелер Р. (март 2002 г.). «Механизм АТФ-синтазы F (1) F (0) -типа, биологический вращательный двигатель». Тенденции в биохимических науках. 27 (3): 154–60. Дои:10.1016 / S0968-0004 (01) 02051-5. PMID 11893513.
- ^ Фридрих Б, Шварц Э (1993). «Молекулярная биология использования водорода у аэробных хемолитотрофов». Ежегодный обзор микробиологии. 47: 351–83. Дои:10.1146 / annurev.mi.47.100193.002031. PMID 8257102.
- ^ Вебер К.А., Ахенбах Л.А., Коутс Дж.Д. (октябрь 2006 г.). «Микроорганизмы, перекачивающие железо: анаэробное микробное окисление и восстановление железа». Обзоры природы. Микробиология. 4 (10): 752–64. Дои:10.1038 / nrmicro1490. PMID 16980937. S2CID 8528196.
- ^ Джеттен М.С., Строус М., ван де Пас-Шунен К.Т., Шалк Дж., Ван Донген Ю.Г., ван де Грааф А.А. и др. (Декабрь 1998 г.). «Анаэробное окисление аммония». Обзор микробиологии FEMS. 22 (5): 421–37. Дои:10.1111 / j.1574-6976.1998.tb00379.x. PMID 9990725.
- ^ Саймон Дж (август 2002 г.). «Энзимология и биоэнергетика респираторной аммификации нитрита». Обзор микробиологии FEMS. 26 (3): 285–309. Дои:10.1111 / j.1574-6976.2002.tb00616.x. PMID 12165429.
- ^ Конрад Р. (декабрь 1996 г.). «Почвенные микроорганизмы как регуляторы атмосферных микрогазов (H2, CO, CH4, OCS, N2O и NO)». Микробиологические обзоры. 60 (4): 609–40. Дои:10.1128 / MMBR.60.4.609-640.1996. ЧВК 239458. PMID 8987358.
- ^ Бареа Дж. М., Посо М. Дж., Азкон Р., Азкон-Агилар К. (июль 2005 г.). «Сотрудничество микробов в ризосфере». Журнал экспериментальной ботаники. 56 (417): 1761–78. Дои:10.1093 / jxb / eri197. PMID 15911555.
- ^ van der Meer MT, Schouten S, Bateson MM, Nübel U, Wieland A, Kühl M и др. (Июль 2005 г.). "Изменения в углеродном метаболизме зелеными несероподобными бактериями в щелочных кремнистых микробных матах горячих источников из Йеллоустонского национального парка". Прикладная и экологическая микробиология. 71 (7): 3978–86. Дои:10.1128 / AEM.71.7.3978-3986.2005. ЧВК 1168979. PMID 16000812.
- ^ Тичи MA, Табита FR (ноябрь 2001 г.). «Интерактивный контроль окислительно-восстановительных систем Rhodobacter capsulatus при фототрофном метаболизме». Журнал бактериологии. 183 (21): 6344–54. Дои:10.1128 / JB.183.21.6344-6354.2001. ЧВК 100130. PMID 11591679.
- ^ Альбертс Б., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). «Преобразование энергии: митохондрии и хлоропласты». Молекулярная биология клетки. 4-е издание.
- ^ Аллен Дж. П., Уильямс Дж. С. (октябрь 1998 г.). «Фотосинтетические реакционные центры». Письма FEBS. 438 (1–2): 5–9. Дои:10.1016 / S0014-5793 (98) 01245-9. PMID 9821949. S2CID 21596537.
- ^ Мунекаге Ю., Хашимото М., Мияке С., Томидзава К., Эндо Т., Тасака М., Шиканай Т. (июнь 2004 г.). «Циклический поток электронов вокруг фотосистемы I необходим для фотосинтеза». Природа. 429 (6991): 579–82. Bibcode:2004Натура.429..579M. Дои:10.1038 / природа02598. PMID 15175756. S2CID 4421776.
- ^ а б Мандал А (26 ноября 2009 г.). "Что такое анаболизм?". Новости-Medical.net. Получено 4 июля 2020.
- ^ Мизиорко HM, Лоример GH (1983). «Рибулозо-1,5-бисфосфаткарбоксилаза-оксигеназа». Ежегодный обзор биохимии. 52: 507–35. Дои:10.1146 / annurev.bi.52.070183.002451. PMID 6351728.
- ^ Додд А.Н., Борланд А.М., Хаслам Р.П., Гриффитс Х., Максвелл К. (апрель 2002 г.). «Метаболизм крассуловой кислоты: пластичный, фантастический». Журнал экспериментальной ботаники. 53 (369): 569–80. Дои:10.1093 / jexbot / 53.369.569. PMID 11886877.
- ^ Hügler M, Wirsen CO, Fuchs G, Taylor CD, Sievert SM (май 2005 г.). «Доказательства автотрофной фиксации СО2 через цикл восстановительных трикарбоновых кислот членами эпсилон-подразделения протеобактерий». Журнал бактериологии. 187 (9): 3020–7. Дои:10.1128 / JB.187.9.3020-3027.2005. ЧВК 1082812. PMID 15838028.
- ^ Штраус Г., Фукс Г. (август 1993 г.). «Ферменты нового пути автотрофной фиксации CO2 у фототрофных бактерий Chloroflexus aurantiacus, 3-гидроксипропионатный цикл». Европейский журнал биохимии. 215 (3): 633–43. Дои:10.1111 / j.1432-1033.1993.tb18074.x. PMID 8354269.
- ^ Wood HG (февраль 1991 г.). «Жизнь с CO или CO2 и H2 как источником углерода и энергии». Журнал FASEB. 5 (2): 156–63. Дои:10.1096 / fasebj.5.2.1900793. PMID 1900793. S2CID 45967404.
- ^ Шивели Дж. М., ван Кеулен Г., Мейер В. Г. (1998). «Что-то почти из ничего: фиксация углекислого газа у хемоавтотрофов». Ежегодный обзор микробиологии. 52: 191–230. Дои:10.1146 / annurev.micro.52.1.191. PMID 9891798.
- ^ Boiteux A, Hess B (июнь 1981 г.). «Дизайн гликолиза». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 293 (1063): 5–22. Bibcode:1981РСПТБ.293 .... 5Б. Дои:10.1098 / рстб.1981.0056. PMID 6115423.
- ^ Пилкис С.Дж., Эль-Маграби М.Р., Клаус Т.Х. (июнь 1990 г.). «Фруктоза-2,6-бисфосфат в контроле глюконеогенеза в печени. От метаболитов к молекулярной генетике». Уход за диабетом. 13 (6): 582–99. Дои:10.2337 / diacare.13.6.582. PMID 2162755. S2CID 44741368.
- ^ а б Ensign SA (июль 2006 г.). «Пересмотр глиоксилатного цикла: альтернативные пути ассимиляции ацетата микробами». Молекулярная микробиология. 61 (2): 274–6. Дои:10.1111 / j.1365-2958.2006.05247.x. PMID 16856935. S2CID 39986630.
- ^ Финн П.Ф., Дайс Дж.Ф. (2006). «Протеолитические и липолитические реакции на голодание». Питание. 22 (7–8): 830–44. Дои:10.1016 / j.nut.2006.04.008. PMID 16815497.
- ^ а б Корнберг HL, Кребс HA (май 1957 г.). «Синтез компонентов клетки из C2-звеньев с помощью модифицированного цикла трикарбоновых кислот». Природа. 179 (4568): 988–91. Bibcode:1957 г., природа 179..988 тыс.. Дои:10.1038 / 179988a0. PMID 13430766. S2CID 40858130.
- ^ Эванс Р.Д., Хизер Л.К. (июнь 2016 г.). «Метаболические пути и аномалии». Хирургия (Оксфорд). 34 (6): 266–272. Дои:10.1016 / j.mpsur.2016.03.010. ISSN 0263-9319.
- ^ Freeze HH, Харт GW, Schnaar RL (2015). «Предшественники гликозилирования». В Варки А., Каммингс Р. Д., Эско Дж. Д., Стэнли П. (ред.). Основы гликобиологии (3-е изд.). Колд-Спринг-Харбор (Нью-Йорк): Лаборатория Колд-Спринг-Харбор. Дои:10.1101 / гликобиология.3e.005 (неактивно с 1 ноября 2020 г.). PMID 28876856. Получено 8 июля 2020.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ Опденаккер Г., Радд П.М., Понтинг С.П., Двек Р.А. (ноябрь 1993 г.). «Концепции и принципы гликобиологии». Журнал FASEB. 7 (14): 1330–7. Дои:10.1096 / fasebj.7.14.8224606. PMID 8224606. S2CID 10388991.
- ^ МакКонвилл MJ, Menon AK (2000). «Последние разработки в клеточной биологии и биохимии липидов гликозилфосфатидилинозитола (обзор)». Молекулярная мембранная биология. 17 (1): 1–16. Дои:10.1080/096876800294443. PMID 10824734.
- ^ Чирала С.С., Вакил С.Дж. (ноябрь 2004 г.). «Структура и функция синтазы жирных кислот животных». Липиды. 39 (11): 1045–53. Дои:10.1007 / s11745-004-1329-9. PMID 15726818. S2CID 4043407.
- ^ Белый SW, Чжэн Дж., Чжан Ю.М. (2005). «Структурная биология биосинтеза жирных кислот II типа». Ежегодный обзор биохимии. 74: 791–831. Дои:10.1146 / annurev.biochem.74.082803.133524. PMID 15952903.
- ^ Ольрогге Дж. Б., Яворски Дж. Г. (июнь 1997 г.). «Регулирование синтеза жирных кислот». Ежегодный обзор физиологии растений и молекулярной биологии растений. 48: 109–136. Дои:10.1146 / annurev.arplant.48.1.109. PMID 15012259. S2CID 46348092.
- ^ Дубей В.С., Бхалла Р., Лутра Р. (сентябрь 2003 г.). «Обзор немевалонатного пути биосинтеза терпеноидов в растениях» (PDF). Журнал биологических наук. 28 (5): 637–46. Дои:10.1007 / BF02703339. PMID 14517367. S2CID 27523830. Архивировано из оригинал (PDF) 15 апреля 2007 г.
- ^ а б Кузуяма Т., Сето Х (апрель 2003 г.). «Разнообразие биосинтеза изопреновых единиц». Отчеты о натуральных продуктах. 20 (2): 171–83. Дои:10.1039 / b109860h. PMID 12735695.
- ^ Гроховски Л.Л., Сюй Х., Уайт Р.Х. (май 2006 г.). «Methanocaldococcus jannaschii использует модифицированный мевалонатный путь для биосинтеза изопентенилдифосфата». Журнал бактериологии. 188 (9): 3192–8. Дои:10.1128 / JB.188.9.3192-3198.2006. ЧВК 1447442. PMID 16621811.
- ^ Lichtenthaler HK (июнь 1999 г.). «Путь 1-дезокси-D-ксилулозо-5-фосфата биосинтеза изопреноидов в растениях». Ежегодный обзор физиологии растений и молекулярной биологии растений. 50: 47–65. Дои:10.1146 / annurev.arplant.50.1.47. PMID 15012203.
- ^ а б Schroepfer GJ (1981). «Биосинтез стеролов». Ежегодный обзор биохимии. 50: 585–621. Дои:10.1146 / annurev.bi.50.070181.003101. PMID 7023367.
- ^ Лис Н.Д., Скэггс Б., Кирш Д.Р., Бард М. (март 1995 г.). «Клонирование поздних генов пути биосинтеза эргостерола Saccharomyces cerevisiae - обзор». Липиды. 30 (3): 221–6. Дои:10.1007 / BF02537824. PMID 7791529. S2CID 4019443.
- ^ Himmelreich R, Hilbert H, Plagens H, Pirkl E, Li BC, Herrmann R (ноябрь 1996 г.). «Полный анализ последовательности генома бактерии Mycoplasma pneumoniae». Исследования нуклеиновых кислот. 24 (22): 4420–49. Дои:10.1093 / nar / 24.22.4420. ЧВК 146264. PMID 8948633.
- ^ Guyton AC, Холл JE (2006). Учебник медицинской физиологии. Филадельфия: Эльзевьер. стр.855 –6. ISBN 978-0-7216-0240-0.
- ^ Ибба М., Сёлль Д. (май 2001 г.). «Возрождение синтеза аминоацил-тРНК». EMBO отчеты. 2 (5): 382–7. Дои:10.1093 / embo-reports / kve095. ЧВК 1083889. PMID 11375928. Архивировано из оригинал 1 мая 2011 г.
- ^ Lengyel P, Söll D (июнь 1969). «Механизм биосинтеза белка». Бактериологические обзоры. 33 (2): 264–301. Дои:10.1128 / MMBR.33.2.264-301.1969. ЧВК 378322. PMID 4896351.
- ^ а б Рудольф Ф. Б. (январь 1994 г.). «Биохимия и физиология нуклеотидов». Журнал питания. 124 (1 приложение): 124S – 127S. Дои:10.1093 / jn / 124.suppl_1.124S. PMID 8283301. Зреннер Р., Ститт М., Зонневальд Ю., Болдт Р. (2006). «Биосинтез и деградация пиримидинов и пуринов в растениях». Ежегодный обзор биологии растений. 57: 805–36. Дои:10.1146 / annurev.arplant.57.032905.105421. PMID 16669783.
- ^ Стасолла К., Катахира Р., Торп Т.А., Ашихара Х. (ноябрь 2003 г.). «Пуриновый и пиримидиновый нуклеотидный обмен у высших растений». Журнал физиологии растений. 160 (11): 1271–95. Дои:10.1078/0176-1617-01169. PMID 14658380.
- ^ Дэвис О., Мендес П., Смоллбоун К., Малис Н. (апрель 2012 г.). «Характеристика множества субстрат-специфичных (d) ITP / (d) XTPase и моделирование метаболизма дезаминированных пуриновых нуклеотидов» (PDF). BMB отчеты. 45 (4): 259–64. Дои:10.5483 / BMBRep.2012.45.4.259. PMID 22531138.
- ^ Смит JL (декабрь 1995 г.). «Ферменты нуклеотидного синтеза». Текущее мнение в структурной биологии. 5 (6): 752–7. Дои:10.1016 / 0959-440X (95) 80007-7. PMID 8749362.
- ^ Testa B, Krämer SD (октябрь 2006 г.). «Биохимия метаболизма лекарств - введение: часть 1. Принципы и обзор». Химия и биоразнообразие. 3 (10): 1053–101. Дои:10.1002 / cbdv.200690111. PMID 17193224. S2CID 28872968.
- ^ Danielson PB (декабрь 2002 г.). «Суперсемейство цитохрома P450: биохимия, эволюция и метаболизм лекарств у человека». Текущий метаболизм лекарств. 3 (6): 561–97. Дои:10.2174/1389200023337054. PMID 12369887.
- ^ King CD, Rios GR, Green MD, Tephly TR (сентябрь 2000 г.). «УДФ-глюкуронозилтрансферазы». Текущий метаболизм лекарств. 1 (2): 143–61. Дои:10.2174/1389200003339171. PMID 11465080.
- ^ Шихан Д., Мид Дж., Фоли В.М., Дауд Калифорния (ноябрь 2001 г.). «Структура, функция и эволюция глутатионтрансфераз: значение для классификации представителей древнего суперсемейства ферментов, не относящихся к млекопитающим». Биохимический журнал. 360 (Чт 1): 1–16. Дои:10.1042/0264-6021:3600001. ЧВК 1222196. PMID 11695986.
- ^ Galvão TC, Mohn WW, de Lorenzo V (октябрь 2005 г.). «Изучение генофонда микробной биодеградации и биотрансформации». Тенденции в биотехнологии. 23 (10): 497–506. Дои:10.1016 / j.tibtech.2005.08.002. PMID 16125262.
- ^ Janssen DB, Dinkla IJ, Poelarends GJ, Terpstra P (декабрь 2005 г.). «Бактериальная деградация ксенобиотических соединений: эволюция и распространение новых ферментативных активностей» (PDF). Экологическая микробиология. 7 (12): 1868–82. Дои:10.1111 / j.1462-2920.2005.00966.x. PMID 16309386.
- ^ Дэвис К.Дж. (1995). «Окислительный стресс: парадокс аэробной жизни». Симпозиум Биохимического общества. 61: 1–31. Дои:10.1042 / bss0610001. PMID 8660387.
- ^ Tu BP, Weissman JS (февраль 2004 г.). «Окислительный фолдинг белков у эукариот: механизмы и последствия». Журнал клеточной биологии. 164 (3): 341–6. Дои:10.1083 / jcb.200311055. ЧВК 2172237. PMID 14757749.
- ^ Sies H (март 1997 г.). «Окислительный стресс: оксиданты и антиоксиданты» (PDF). Экспериментальная физиология. 82 (2): 291–5. Дои:10.1113 / expphysiol.1997.sp004024. PMID 9129943. S2CID 20240552. Архивировано из оригинал (PDF) 25 марта 2009 г.. Получено 9 марта 2007.
- ^ Вертуани С., Ангусти А., Манфредини С. (2004). «Сеть антиоксидантов и про-антиоксидантов: обзор». Текущий фармацевтический дизайн. 10 (14): 1677–94. Дои:10.2174/1381612043384655. PMID 15134565. S2CID 43713549.
- ^ фон Штокар У, Лю Дж (август 1999 г.). «Всегда ли микробная жизнь питается отрицательной энтропией? Термодинамический анализ роста микробов». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1412 (3): 191–211. Дои:10.1016 / S0005-2728 (99) 00065-1. PMID 10482783.
- ^ Демирель Ю., Сандлер С.И. (июнь 2002 г.). «Термодинамика и биоэнергетика». Биофизическая химия. 97 (2–3): 87–111. Дои:10.1016 / S0301-4622 (02) 00069-8. PMID 12050002.
- ^ Альберт Р. (ноябрь 2005 г.). «Безмасштабные сети в клеточной биологии». Журнал клеточной науки. 118 (Пт 21): 4947–57. arXiv:q-bio / 0510054. Bibcode:2005q.bio .... 10054A. Дои:10.1242 / jcs.02714. PMID 16254242. S2CID 3001195.
- ^ Бренд MD (январь 1997 г.). «Регуляционный анализ энергетического обмена». Журнал экспериментальной биологии. 200 (Pt 2): 193–202. PMID 9050227.
- ^ Soyer OS, Salathé M, Bonhoeffer S (январь 2006 г.). «Сети передачи сигналов: топология, реакция и биохимические процессы». Журнал теоретической биологии. 238 (2): 416–25. Дои:10.1016 / j.jtbi.2005.05.030. PMID 16045939.
- ^ а б Солтер М., Ноулз Р.Г., Погсон С.И. (1994). «Метаболический контроль». Очерки биохимии. 28: 1–12. PMID 7925313.
- ^ Вестерхофф Х.В., Гроен А.К., Вандерс Р.Дж. (январь 1984 г.). «Современные теории метаболического контроля и их приложения (обзор)». Отчеты по бионауке. 4 (1): 1–22. Дои:10.1007 / BF01120819. PMID 6365197. S2CID 27791605.
- ^ Fell DA, Thomas S (октябрь 1995 г.). «Физиологический контроль метаболического потока: требование для многоузловой модуляции». Биохимический журнал. 311 (Pt 1) (Pt 1): 35–9. Дои:10.1042 / bj3110035. ЧВК 1136115. PMID 7575476.
- ^ Хендриксон WA (ноябрь 2005 г.). «Передача биохимических сигналов через клеточные мембраны». Ежеквартальные обзоры биофизики. 38 (4): 321–30. Дои:10.1017 / S0033583506004136. PMID 16600054.
- ^ Коэн П. (декабрь 2000 г.). «Регуляция функции белков с помощью мультисайтового фосфорилирования - обновление за 25 лет». Тенденции в биохимических науках. 25 (12): 596–601. Дои:10.1016 / S0968-0004 (00) 01712-6. PMID 11116185.
- ^ Линхард Г.Е., Слот JW, Джеймс Д.Э., Мюклер М.М. (январь 1992 г.). «Как клетки усваивают глюкозу». Scientific American. 266 (1): 86–91. Bibcode:1992SciAm.266a..86L. Дои:10.1038 / scientificamerican0192-86. PMID 1734513.
- ^ Roach PJ (март 2002 г.). «Гликоген и его метаболизм». Современная молекулярная медицина. 2 (2): 101–20. Дои:10.2174/1566524024605761. PMID 11949930.
- ^ Ньюгард CB, Брэди MJ, O'Doherty RM, Saltiel AR (декабрь 2000 г.). «Организация утилизации глюкозы: новые роли нацеливающих на гликоген субъединиц протеинфосфатазы-1» (PDF). Сахарный диабет. 49 (12): 1967–77. Дои:10.2337 / диабет.49.12.1967. PMID 11117996.
- ^ Романо А.Х., Конвей Т. (1996). «Эволюция метаболических путей углеводов». Исследования в области микробиологии. 147 (6–7): 448–55. Дои:10.1016/0923-2508(96)83998-2. PMID 9084754.
- ^ Кох А (1998). Как появились бактерии?. Adv Microb Physiol. Успехи микробной физиологии. 40. С. 353–99. Дои:10.1016 / S0065-2911 (08) 60135-6. ISBN 978-0-12-027740-7. PMID 9889982.
- ^ Узунис К., Кирпидес Н. (июль 1996 г.). «Возникновение основных клеточных процессов в эволюции». Письма FEBS. 390 (2): 119–23. Дои:10.1016 / 0014-5793 (96) 00631-X. PMID 8706840. S2CID 39128865.
- ^ Caetano-Anollés G, Kim HS, Mittenthal JE (май 2007 г.). «Происхождение современных метаболических сетей, выведенное из филогеномного анализа белковой архитектуры». Труды Национальной академии наук Соединенных Штатов Америки. 104 (22): 9358–63. Bibcode:2007PNAS..104.9358C. Дои:10.1073 / pnas.0701214104. ЧВК 1890499. PMID 17517598.
- ^ Шмидт С., Сюняев С., Борк П., Дандекар Т. (июнь 2003 г.). «Метаболиты: рука помощи на пути эволюции?». Тенденции в биохимических науках. 28 (6): 336–41. Дои:10.1016 / S0968-0004 (03) 00114-2. PMID 12826406.
- ^ Лайт С., Краулис П. (февраль 2004 г.). «Сетевой анализ эволюции метаболических ферментов у Escherichia coli». BMC Bioinformatics. 5: 15. Дои:10.1186/1471-2105-5-15. ЧВК 394313. PMID 15113413. Алвес Р., Чалейл Р.А., Штернберг М.Дж. (июль 2002 г.). «Эволюция ферментов в метаболизме: сетевая перспектива». Журнал молекулярной биологии. 320 (4): 751–70. Дои:10.1016 / S0022-2836 (02) 00546-6. PMID 12095253.
- ^ Kim HS, Mittenthal JE, Caetano-Anollés G (июль 2006 г.). «MANET: отслеживание эволюции белковой архитектуры в метаболических сетях». BMC Bioinformatics. 7: 351. Дои:10.1186/1471-2105-7-351. ЧВК 1559654. PMID 16854231.
- ^ Тайхманн С.А., Райсон С.К., Торнтон Дж. М., Райли М., Гоф Дж., Чотия С. (декабрь 2001 г.). «Метаболизм малых молекул: ферментная мозаика». Тенденции в биотехнологии. 19 (12): 482–6. Дои:10.1016 / S0167-7799 (01) 01813-3. PMID 11711174.
- ^ Спирин В., Гельфанд М.С., Миронов А.А., Мирный Л.А. (июнь 2006 г.). «Метаболическая сеть в эволюционном контексте: многомасштабная структура и модульность». Труды Национальной академии наук Соединенных Штатов Америки. 103 (23): 8774–9. Bibcode:2006ПНАС..103.8774С. Дои:10.1073 / pnas.0510258103. ЧВК 1482654. PMID 16731630.
- ^ Лоуренс Дж. Г. (декабрь 2005 г.). «Общие темы в геномных стратегиях патогенов». Текущее мнение в области генетики и развития. 15 (6): 584–8. Дои:10.1016 / j.gde.2005.09.007. PMID 16188434. Вернегрин Дж. Дж. (Декабрь 2005 г.). «Хорошо это или плохо: геномные последствия внутриклеточного мутуализма и паразитизма». Текущее мнение в области генетики и развития. 15 (6): 572–83. Дои:10.1016 / j.gde.2005.09.013. PMID 16230003.
- ^ Пал С., Папп Б., Леркер М.Дж., Чермели П., Оливер С.Г., Херст Л.Д. (март 2006 г.). «Шанс и необходимость в эволюции минимальных метаболических сетей». Природа. 440 (7084): 667–70. Bibcode:2006Натура.440..667П. Дои:10.1038 / природа04568. PMID 16572170. S2CID 4424895.
- ^ Ренни MJ (ноябрь 1999 г.). «Введение в использование индикаторов в питании и обмене веществ». Труды Общества питания. 58 (4): 935–44. Дои:10.1017 / S002966519900124X. PMID 10817161.
- ^ Phair RD (декабрь 1997 г.). «Разработка кинетических моделей в нелинейном мире молекулярной биологии клетки». Метаболизм. 46 (12): 1489–95. Дои:10.1016 / S0026-0495 (97) 90154-2. PMID 9439549.
- ^ Стерк Л., Ромбаутс С., Вандепоэль К., Рузе П., Ван де Пер Y (апрель 2007 г.). «Сколько генов у растений (... и почему они там)?». Текущее мнение в области биологии растений. 10 (2): 199–203. Дои:10.1016 / j.pbi.2007.01.004. PMID 17289424.
- ^ Бородина И., Нильсен Дж. (Июнь 2005 г.). «От геномов к in silico клеткам через метаболические сети». Текущее мнение в области биотехнологии. 16 (3): 350–5. Дои:10.1016 / j.copbio.2005.04.008. PMID 15961036.
- ^ Gianchandani EP, Brautigan DL, Papin JA (май 2006 г.). «Системный анализ характеризует интегрированные функции биохимических сетей». Тенденции в биохимических науках. 31 (5): 284–91. Дои:10.1016 / j.tibs.2006.03.007. PMID 16616498.
- ^ Duarte NC, Becker SA, Jamshidi N, Thiele I., Mo ML, Vo TD и др. (Февраль 2007 г.). «Глобальная реконструкция метаболической сети человека на основе геномных и библиомических данных». Труды Национальной академии наук Соединенных Штатов Америки. 104 (6): 1777–82. Bibcode:2007PNAS..104.1777D. Дои:10.1073 / pnas.0610772104. ЧВК 1794290. PMID 17267599.
- ^ Го К.И., Кусик М.Э., Валле Д., Чайлдс Б., Видал М., Барабаши А.Л. (май 2007 г.). «Сеть болезней человека». Труды Национальной академии наук Соединенных Штатов Америки. 104 (21): 8685–90. Bibcode:2007PNAS..104.8685G. Дои:10.1073 / pnas.0701361104. ЧВК 1885563. PMID 17502601.
- ^ Ли Д.С., Пак Дж., Кей К.А., Кристакис Н.А., Олтвай З.Н., Барабаши А.Л. (июль 2008 г.). «Влияние топологии метаболической сети человека на сопутствующую патологию». Труды Национальной академии наук Соединенных Штатов Америки. 105 (29): 9880–5. Bibcode:2008ПНАС..105.9880Л. Дои:10.1073 / pnas.0802208105. ЧВК 2481357. PMID 18599447.
- ^ Csete M, Doyle J (сентябрь 2004 г.). «Галстуки-бабочки, обмен веществ и болезни». Тенденции в биотехнологии. 22 (9): 446–50. Дои:10.1016 / j.tibtech.2004.07.007. PMID 15331224.
- ^ Ма Х.В., Цзэн А.П. (июль 2003 г.). «Структура связности, гигантский сильный компонент и центральное место в метаболических сетях». Биоинформатика. 19 (11): 1423–30. CiteSeerX 10.1.1.605.8964. Дои:10.1093 / биоинформатика / btg177. PMID 12874056.
- ^ Чжао Дж., Ю Х., Ло Дж. Х., Цао З. В., Ли У. X (август 2006 г.). «Иерархическая модульность вложенных бабочек в метаболических сетях». BMC Bioinformatics. 7: 386. arXiv:q-bio / 0605003. Bibcode:2006q.bio ..... 5003Z. Дои:10.1186/1471-2105-7-386. ЧВК 1560398. PMID 16916470.
- ^ Тайкаер Дж, Нильсен Дж (январь 2003 г.). «Метаболическая инженерия производства бета-лактама». Метаболическая инженерия. 5 (1): 56–69. Дои:10.1016 / S1096-7176 (03) 00003-X. PMID 12749845.González-Pajuelo M, Meynial-Salles I, Mendes F, Andrade JC, Vasconcelos I, Soucaille P (2005). «Метаболическая инженерия Clostridium acetobutylicum для промышленного производства 1,3-пропандиола из глицерина». Метаболическая инженерия. 7 (5–6): 329–36. Дои:10.1016 / j.ymben.2005.06.001. HDL:10400.14/3388. PMID 16095939.Кремер М., Бонгертс Дж., Бовенберг Р., Кремер С., Мюллер Ю., Орф С. и др. (Октябрь 2003 г.). «Метаболическая инженерия для микробиологического производства шикимовой кислоты». Метаболическая инженерия. 5 (4): 277–83. Дои:10.1016 / j.ymben.2003.09.001. PMID 14642355.
- ^ Коффас М., Роберж С., Ли К., Стефанопулос Г. (1999). «Метаболическая инженерия». Ежегодный обзор биомедицинской инженерии. 1: 535–57. Дои:10.1146 / annurev.bioeng.1.1.535. PMID 11701499. S2CID 11814282.
- ^ "метаболизм | Происхождение и значение метаболизма по онлайн-этимологическому словарю". www.etymonline.com. Получено 23 июля 2020.
- ^ Леруа, Арман Мари (2014). Лагуна: как Аристотель изобрел науку. Блумсбери. С. 400–401. ISBN 978-1-4088-3622-4.
- ^ Аль-Руби А.С. (1982). Ибн ан-Нафис как философ. Симпозиум по Ибн ан-Нафису, Вторая международная конференция по исламской медицине. Кувейт: Исламская медицинская организация. (ср. Ибн ан-Нафис как философ, Энциклопедия исламского мира [1])
- ^ Экноян Г (1999). «Санторио Санкториус (1561-1636) - отец-основатель исследований метаболического баланса». Американский журнал нефрологии. 19 (2): 226–33. Дои:10.1159/000013455. PMID 10213823. S2CID 32900603.
- ^ Уильямс HA (1904). Современное развитие химических и биологических наук. История науки: в пяти томах. IV. Нью-Йорк: Харпер и братья. стр. 184–185. Получено 26 марта 2007.
- ^ Манчестер KL (декабрь 1995 г.). «Луи Пастер (1822-1895) - случай и подготовленный ум». Тенденции в биотехнологии. 13 (12): 511–5. Дои:10.1016 / S0167-7799 (00) 89014-9. PMID 8595136.
- ^ Кинне-Саффран Э., Кинне РК (1999). «Витализм и синтез мочевины. От Фридриха Велера до Ганса А. Кребса». Американский журнал нефрологии. 19 (2): 290–4. Дои:10.1159/000013463. PMID 10213830. S2CID 71727190.
- ^ Эдуард Бухнер 1907 Нобелевская лекция в http://nobelprize.org Доступ 20 марта 2007 г.
- ^ Корнберг Х (декабрь 2000 г.). «Кребс и его троица циклов». Обзоры природы. Молекулярная клеточная биология. 1 (3): 225–8. Дои:10.1038/35043073. PMID 11252898. S2CID 28092593.
- ^ Кребс HA, Henseleit K (1932). "Untersuchungen über die Harnstoffbildung im tierkorper". Z. Physiol. Chem. 210 (1–2): 33–66. Дои:10.1515 / bchm2.1932.210.1-2.33.
Кребс HA, Джонсон WA (апрель 1937 г.). «Метаболизм кетоновых кислот в тканях животных». Биохимический журнал. 31 (4): 645–60. Дои:10.1042 / bj0310645. ЧВК 1266984. PMID 16746382.
дальнейшее чтение
| Библиотечные ресурсы о Метаболизм |
Вводный
- Роуз С., Милеусник Р. (1999). Химия жизни. Penguin Press Science. ISBN 0-14-027273-9.
- Шнайдер EC, Sagan D (2005). В прохладу: поток энергии, термодинамика и жизнь. Издательство Чикагского университета. ISBN 0-226-73936-8.
- Переулок N (2004). Кислород: молекула, создавшая мир. США: Издательство Оксфордского университета. ISBN 0-19-860783-0.
Передовой
- Прайс Н., Стивенс Л. (1999). Основы энзимологии: клеточная и молекулярная биология каталитических белков. Издательство Оксфордского университета. ISBN 0-19-850229-X.
- Берг Дж., Тимочко Дж., Страйер Л. (2002). Биохимия. В. Х. Фриман и компания. ISBN 0-7167-4955-6.
- Кокс М., Нельсон Д.Л. (2004). Принципы биохимии Ленингера. Пэлгрейв Макмиллан. ISBN 0-7167-4339-6.
- Брок ТД, Мэдиган MR, Мартинко Дж, Паркер Дж (2002). Биология микроорганизмов Брока. Бенджамин Каммингс. ISBN 0-13-066271-2.
- Да Силва Дж. Дж., Уильямс Р. Дж. (1991). Биологическая химия элементов: неорганическая химия жизни. Кларендон Пресс. ISBN 0-19-855598-9.
- Николлс Д.Г., Фергюсон С.Дж. (2002). Биоэнергетика. Academic Press Inc. ISBN 0-12-518121-3.
- Wood HG (февраль 1991 г.). «Жизнь с CO или CO2 и H2 как источником углерода и энергии». Журнал FASEB. 5 (2): 156–63. Дои:10.1096 / fasebj.5.2.1900793. PMID 1900793. S2CID 45967404.
внешняя ссылка
Общая информация
- Обмен веществ (биология) на Британская энциклопедия
- Биохимия метаболизма
- Sparknotes SAT биохимия Обзор биохимии. Уровень школы.
- Гипертекст по биологии Массачусетского технологического института Руководство по молекулярной биологии для бакалавров.
Метаболизм человека
- Темы медицинской биохимии Руководство по метаболическим путям человека. Уровень школы.
- Страница медицинской биохимии Исчерпывающий ресурс по метаболизму человека.
Базы данных
- Блок-схема метаболических путей в ExPASy
- Таблица метаболических путей IUBMB-Nicholson
- SuperCYP: База данных по метаболизму цитохромов лекарств
Метаболические пути
- Ссылка на метаболизм Путь
- Азотный цикл и фиксация азота на Wayback Machine (индекс архива)



