Синтаза аминолевулиновой кислоты - Aminolevulinic acid synthase
| 5-аминолевулинатсинтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
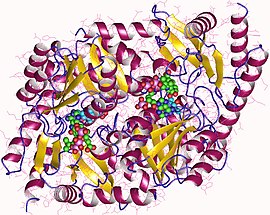 Димер синтазы аминолевулиновой кислоты, Rhodobacter capsulatus | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 2.3.1.37 | ||||||||
| Количество CAS | 9037-14-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Синтаза аминолевулиновой кислоты (АЛК-синтаза, УВЫ, или же синтаза дельта-аминолевулиновой кислоты) представляет собой фермент (EC 2.3.1.37 ), который катализирует синтез δ-аминолевулиновая кислота (ALA) первый общий предшественник в биосинтезе всех тетрапирролы такие как гем, кобаламины и хлорофиллы.[1] Реакция следующая:
- сукцинил-КоА + глицин δ-аминолевулиновая кислота + CoA + CO2
Этот фермент экспрессируется во всех нерастительных эукариотах и протеобактериях α-класса, и реакция, которую он катализирует, иногда называют путем Shemin для образования ALA.[2] Другие организмы производят АЛК с помощью трех ферментных путей, известных как путь С5. АЛК синтезируется путем конденсации глицин и сукцинил-КоА. У людей транскрипция ALA-синтазы строго контролируется присутствием Fe2+ -связывающие элементы для предотвращения накопления промежуточных порфириновых соединений в отсутствие железа. В организме есть две формы синтазы ALA. Одна форма экспрессируется в клетках-предшественниках эритроцитов (ALAS2 ), а другой (ALAS1 ) повсеместно выражается по всему телу. Форма эритроцитов кодируется геном на хромосоме x, тогда как другая форма кодируется геном на хромосоме 3.
Х-сцепленная болезнь сидеробластная анемия вызывается мутациями в гене синтазы ALA на хромосоме X, в то время как неизвестно ни одного заболевания, вызванного мутациями в другом гене. Недавно было показано, что усиление функциональных мутаций в гене эритроид-специфической ALA-синтазы вызывает ранее неизвестную форму порфирии, известную как X-сцепленная доминантная протопорфирия.
Структура и свойства фермента
PLP-зависимые ферменты распространены, потому что они необходимы для преобразования аминокислот в другие ресурсы.[1] ALAS представляет собой гомодимер с субъединицами аналогичного размера, а активные центры, состоящие из боковых цепей аминокислот, таких как аргинин, треонин и лизин, находятся на границе раздела субъединиц.[1] Белок, извлеченный из R. spheroids, содержит 1600 крат и весит около 80 000 дальтон.[3] Ферментативная активность варьируется для разных источников фермента.[3]
Механизм реакции
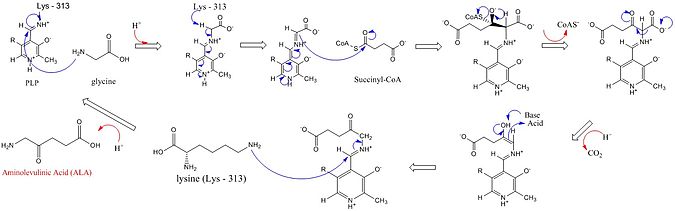
Активные центры ALAS используют три ключевые аминокислотные боковые цепи: Arg-85, Thr-430 и Lys-313. Хотя эти три аминокислоты были идентифицированы, чтобы позволить этой реакции протекать, они были бы неактивны без добавления кофактора пиридоксаль 5’-фосфата (PLP), роль которого в этом синтезе подробно показана на изображении ниже. Прежде чем реакция может начаться, кофактор PLP связывается с боковой цепью лизина с образованием основания Шиффа, которое способствует атаке глицинового субстрата.[4][5][6][7] Лизин действует как общая основа в этом механизме.[1][8] В подробном механизме реакции добавляемые атомы гидроксония происходят из различных остатков, которые предлагают водородные связи для облегчения синтеза ALA.[1]ALA-синтаза устраняет карбоксил группа из глицина и CoA из сукцинил-КоА посредством его простетической группы пиридоксальфосфат (производное витамина b6), образуя δ-аминолевулиновую кислоту (dALA), названную так потому, что амино- группа находится на четвертом атоме углерода в молекуле. Этот механизм реакции особенно уникален по сравнению с другими ферментами, которые используют кофактор PLP, поскольку глицин изначально депротонируется высококонсервативным лизином активного центра, что приводит к конденсации с сукцинил-КоА и потере КоА. Протонирование карбонильной группы промежуточного соединения гистидином в активном центре приводит к потере карбоксильной группы. Последний промежуточный продукт, наконец, репротонируется с образованием ALA. Диссоциация ALA от фермента является лимитирующей стадией ферментативной реакции и, как было показано, зависит от медленного конформационного изменения фермента. Функция пиридоксальфосфат для облегчения удаления водорода за счет использования электрофильного пиридиний кольцо как сток электронов.
Расположение этого фермента в биологических системах указывает на обратную связь, которую он может получить. АЛК-синтаза была обнаружена в бактериях, дрожжах, печени, клетках крови и костном мозге птиц и млекопитающих. Расположение этого фермента в клетках животных находится в митохондриях.[3] Поскольку фермент, по-видимому, расположен рядом с источником сукцинил-КоА, и конец пути гема указывает на то, что начальная и конечная точки биосинтеза гема служат обратной связью для синтазы ALA.[3] ALA-синтаза также ингибируется гемин и глюкоза.[9]

Биологическая функция
ALAS1 и ALAS2 катализируют первую стадию процесса синтеза гема. Это первый необратимый шаг, а также ограничение скорости. Это означает, что начало формирования гема очень преднамеренное и зависит от множества областей обратной связи. Например, два субстрата, оксалоацетат и глицин, в высокой степени продуцируются и используются в других важных биологических процессах, таких как гликолиз и цикл TCA. Изображение ниже иллюстрирует путь синтеза гема и роль, которую играет ALAS.

Актуальность болезни
Дефицит синтазы аминолевулиновой кислоты приводит к потере способности создавать гем, поскольку его задача - катализировать первый шаг в этом процессе. Эти недостатки часто являются результатом генетической мутации, которая может привести к различным заболеваниям. Одно из таких заболеваний - сидеробластная анемия, сцепленная с x, которая приводит к появлению красных кровяных телец в костном мозге.[10] Это заболевание конкретно связано с мутациями в генах, кодирующих ALAS2.[10]
Рекомендации
- ^ а б c d е Хантер, Грегори А .; Феррейра, Глория К. (ноябрь 2011 г.). «Молекулярная энзимология 5-аминолевулинатсинтазы, привратника биосинтеза гема». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1814 (11): 1467–1473. Дои:10.1016 / j.bbapap.2010.12.015. ЧВК 3090494. PMID 21215825.
- ^ Шемин, Давид; Риттенберг, Д. (18 июня 1945 г.). «Использование глицина для синтеза порфирина». Журнал биологической химии. 159: 567–568.
- ^ а б c d Бил, С. И. (июнь 1978 г.). "δ-аминолевулиновая кислота в растениях: ее биосинтез, регуляция и роль в развитии пластид". Ежегодный обзор физиологии растений. 29 (1): 95–120. Дои:10.1146 / annurev.pp.29.060178.000523.
- ^ «АЛК-синтаза». флиппер и нувола. Туринский университет. Получено 10 марта 2016.
- ^ Shoolingin-Jordan, Peter M .; Ад-Дайхан, Суад; Алексеев, Дмитрий; Бакстер, Роберт Л .; Боттомли, Сильвия С .; Кахари, И. Дональд; Рой, Ипсита; Сарвар, Мухаммад; Сойер, Линдси; Ван, Шу-Фен (апрель 2003 г.). «Синтаза 5-аминолевулиновой кислоты: механизм, мутации и медицина». Biochim Biophys Acta. 1647 (1–2): 361–6. Дои:10.1016 / с1570-9639 (03) 00095-5. PMID 12686158.
- ^ CHOI, H (июль 2004 г.). «Клонирование, экспрессия и характеристика синтазы 5-аминолевулиновой кислоты из Rhodopseudomonas palustris KUGB306». Письма о микробиологии FEMS. 236 (2): 175–181. Дои:10.1016 / j.femsle.2004.05.048. PMID 15251194.
- ^ Ferreira, Gloria C .; Neame, Питер Дж .; Дейли, Гарри А. (ноябрь 1993 г.). «Биосинтез гема в системах млекопитающих: доказательства связи основания Шиффа между пиридоксаль-5'-фосфатным кофактором и остатком лизина в 5-аминолевулинатсинтазе». Белковая наука. 2 (11): 1959–1965. Дои:10.1002 / pro.5560021117. ЧВК 2142290. PMID 8268805.
- ^ Хантер, Грегори А .; Феррейра, Глория К. (март 1999 г.). «Лизин-313 5-аминолевулинатсинтазы действует как основное основание во время образования промежуточных продуктов хиноноидной реакции». Биохимия. 38 (12): 3711–3718. Дои:10.1021 / bi982390w. PMID 10090759.
- ^ Досс М., Сиксель-Дитрих Ф, Верспол Ф (1985). ""Эффект глюкозы «и лимитирующая функция уропорфириноген-синтазы на метаболизм порфиринов в культуре гепатоцитов: связь с острыми порфириями печени у человека» (PDF). J Clin Chem Clin Biochem. 23 (9): 505–13. Дои:10.1515 / cclm.1985.23.9.505. PMID 4067519.
- ^ а б Аджиока, Ричард С .; Филлипс, Джон Д .; Кушнер, Джеймс П. (Июль 2006 г.). «Биосинтез гема у млекопитающих». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 1763 (7): 723–736. Дои:10.1016 / j.bbamcr.2006.05.005. PMID 16839620.
внешняя ссылка
- Национальные институты здравоохранения США
- Абу-Фарха М., Найлз Дж., Уиллмор В. (2005). «Эритроид-специфический белок 5-аминолевулинатсинтазы стабилизируется низким содержанием кислорода и протеасомным ингибированием». Биохимическая клетка Биол. 83 (5): 620–30. Дои:10.1139 / o05-045. PMID 16234850.
- Шемин, Д; Риттенберг, Д. (1945). «Использование глицина для синтеза порфирина». J. Biol. Chem. 159: 567–8.
- СИДЕРОБЛАСТИЧЕСКИЕ АНЕМИИ - болезнь с дефектом ALAS-2