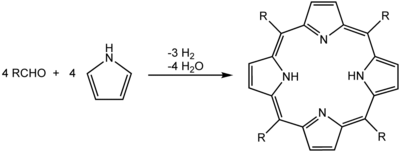
Порфирин - Porphyrin

Порфирины (/ˈпɔːrжərɪп/ ПОР-fər-in ) являются группой гетероциклический макроцикл органические соединения, состоящий из четырех модифицированных пиррол подразделений, связанных между собой α углерод атомы через метин мосты (= CH−). Родителем порфирина является порфин, редкое химическое соединение, представляющее исключительно теоретический интерес. Замещенные порфины называются порфиринами.[1] Имея в общей сложности 26 π-электронов, из которых 18 π-электронов образуют плоский непрерывный цикл, порфириновая кольцевая структура часто описывается как ароматный.[2][3] Одним из результатов большой конъюгированной системы является то, что порфирины обычно сильно поглощают в видимой области электромагнитного спектра, т.е. они сильно окрашены. Название «порфирин» происходит от Греческий слово πορφύρα (порфира), смысл фиолетовый.[4]
Комплексы металлов, полученные из порфиринов, встречаются в природе. Одно из самых известных семейств порфириновых комплексов - это гем, пигмент красный клетки крови, а кофактор белка гемоглобин.
Комплексы порфиринов
- Типичные порфирины и производные
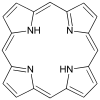
Порфин простейший порфирин, редкое соединение, представляющее теоретический интерес.

Производные протопорфирин IX распространены в природе, предшественники гемы.

Октаэтилпорфирин (ЧАС2OEP) - синтетический аналог протопорфирина IX. В отличие от природных порфириновых лигандов, OEP2− очень симметричен.

Тетрафенилпорфирин (ЧАС2TPP) - еще один синтетический аналог протопорфирина IX. В отличие от природных лигандов порфирина, TPP2− очень симметричен. Другое отличие состоит в том, что его метиновые центры заняты фенильными группами.

Упрощенный вид гем, комплекс протопорфирина IX.
Порфирины - сопряженные кислоты лиганды это связывает металлы формировать комплексы. Металл ион обычно имеет заряд 2+ или 3+. Схематическое уравнение для этих синтезов показано:
- ЧАС2порфирин + [млп]2+ → M (порфиринат) Lп-4 + 4 л + 2 ч+, где M = ион металла и L = лиганд
Порфирин без иона металла в полости является бесплатная база. Некоторые железосодержащие порфирины называются гемами. Гемсодержащий белки, или же гемопротеины, широко встречаются в природе. Гемоглобин и миоглобин два О2 -связывающие белки, содержащие порфирины железа. Разные цитохромы также гемопротеины.
Родственные виды
А бензопорфирин представляет собой порфирин с бензольным кольцом, конденсированным с одним из пиррольных звеньев. например вертепорфин является производным бензопорфирина.[5]
Некоторые другие гетероциклы связаны с порфиринами. К ним относятся Corrins, хлорины, бактериохлорофиллы, и Corphins. Хлорины (2,3-дигидропорфирин) более восстановлены, содержат больше водорода, чем порфирины, т.е. один пиррол превращен в пирролин. Эта структура встречается в хлорофиллы. Замена двух из четырех пирролиновых субъединиц на пирролиновые субъединицы приводит либо к бактериохлорин (как в некоторых фотосинтетический бактерии) или изобактериохлорин, в зависимости от относительного положения восстановленных колец. Некоторые производные порфирина следуют Правило Хюккеля, но большинство этого не делают.[нужна цитата ]
Естественное образование
Геопорфирин, также известный как петропорфирин, представляет собой порфирин геологического происхождения.[6] Они могут возникать в сырая нефть, горючие сланцы, уголь или осадочные породы.[6][7] Абельсонит возможно, единственный минерал геопорфирин, так как порфирины редко встречаются изолированно и образуют кристаллы.[8]
Синтез
Биосинтез
В нефотосинтетических эукариоты такие как животные, насекомые, грибы и простейшие, а также бактерий группы α-протеобактерий, совершенный шаг для порфирина биосинтез это формирование δ-аминолевулиновая кислота (δ-ALA, 5-ALA или dALA) по реакции аминокислота глицин с сукцинил-КоА от цикл лимонной кислоты. В растения, водоросли, бактерии (кроме группы α-протеобактерий) и археи, производится из глютаминовая кислота через глутамил-тРНК и глутамат-1-полуальдегид. Ферменты, участвующие в этом пути: глутамил-тРНК синтетаза, глутамил-тРНК редуктаза, и глутамат-1-полуальдегид 2,1-аминомутаза. Этот путь известен как путь С5 или Била.
Затем две молекулы dALA объединяются порфобилиногенсинтаза давать порфобилиноген (PBG), который содержит пиррольное кольцо. Затем четыре PBG объединяются через дезаминирование в гидроксиметилбилан (HMB), то есть гидролизованный образовывать круговой тетрапиррол уропорфириноген III. Эта молекула претерпевает ряд дальнейших модификаций. Промежуточные продукты используются у разных видов для образования определенных веществ, но у людей основной конечный продукт протопорфирин IX соединяется с железом с образованием гема. Желчные пигменты - это продукты распада гема.
Следующая схема суммирует биосинтез порфиринов со ссылками на номер ЕС и OMIM база данных. В порфирия связанные с дефицитом каждого фермента также показаны:

Лабораторный синтез

Одним из наиболее распространенных синтезов порфиринов является Ротемунд реакция, впервые сообщалось в 1936 г.,[9][10] что также является основой для более поздних методов, описанных Адлером и Лонго.[11] Общая схема представляет собой конденсация и окисление процесс, начиная с пиррола и альдегид.
Изомерные порфирины
Первый синтетический порфирин изомер был описан Emanual Vogel и соавторами в 1986 году. Этот изомер [18] порфирин- (2.0.2.0) назван как порфицен, а центральный N4 Полость образует прямоугольник форма, как показано на рисунке.[12] Порфицены показали интересные фотофизический поведение и нашел универсальный состав по отношению к фотодинамическая терапия.[13] Это вдохновило Фогеля и Sessler взялся за приготовление [18] порфирина- (2.1.0.1) и назвал его Коррфицен или Порфицерин.[14] О третьем порфирине, который представляет собой [18] порфирин- (2.1.1.0), сообщили Калло и Фогель-Сесслер. Фогель и его коллеги сообщили об успешном выделении [18] порфирин- (3.0.1.0) или Изопорфицен.[15] Японский ученый Фурута[16] и польский ученый Латош-Гражинский[17] почти одновременно сообщили о N-смешанные порфирины. Инверсия одной из пиррольных субъединиц в макроциклическом кольце привела к тому, что один из атомов азота оказался лицом к лицу за пределами ядра макроцикла.

Приложения
Фотодинамическая терапия
Порфирины были оценены в контексте фотодинамическая терапия (PDT), поскольку они сильно поглощают свет, который затем преобразуется в энергию и тепло в освещенных областях.[18] Этот метод применялся в дегенерация желтого пятна с помощью вертепорфин.[19]
ФДТ считается неинвазивным лечением рака, включающим взаимодействие между светом определенной частоты, фотосенсибилизатором и кислородом. Это взаимодействие вызывает образование высокореактивных форм кислорода (ROS), обычно синглетного кислорода, а также супероксид-аниона, свободного гидроксильного радикала или перекиси водорода.[20]Эти высокореактивные формы кислорода реагируют с чувствительными клеточными органическими биомолекулами, такими как; липиды, ароматические аминокислоты и гетероциклические основания нуклеиновых кислот для образования окислительных радикалов, которые повреждают клетку, возможно, вызывая апоптоз или даже некроз.[21]
Органическая геохимия
Поле органическая геохимия возникла в результате выделения порфиринов из нефти.[нужна цитата ] Это открытие помогло установить биологическое происхождение нефти. Нефть иногда «снимают отпечатки пальцев», анализируя следовые количества никеля и ванадил порфирины.[нужна цитата ]
Токсикология
Биосинтез гема используется как биомаркер в исследованиях экологической токсикологии. Хотя избыточное производство порфиринов указывает на хлорорганические соединения контакт, вести подавляет АЛК-дегидратаза фермент.[22]
Возможные приложения
Биомиметический катализ
Комплексы металлопорфиринов, хотя и не поступают в продажу, широко изучаются как катализаторы окисления органических соединений. Особой популярностью для таких лабораторных исследований пользуются комплексы мезо-тетрафенилпорфирин и октаэтилпорфирин. Комплексы с Mn, Fe и Co катализируют множество реакций, представляющих потенциальный интерес. органический синтез. Некоторые комплексы имитируют действие различных гем ферменты, такие как цитохром P450, лигнин пероксидаза.[23][24] Металлопорфирины также изучаются как катализаторы расщепления воды с целью генерации молекулярного водорода и кислорода для топливных элементов.[25]
Молекулярная электроника и датчики
Соединения на основе порфиринов представляют интерес как возможные компоненты молекулярная электроника и фотоника.[26] Синтетические порфириновые красители были включены в прототип. сенсибилизированные красителем солнечные элементы.[27][28]
Металлопорфирины были исследованы как сенсоры.[29]
Фталоцианины, которые структурно родственны порфиринам, используются в торговле в качестве красителей и катализаторов, но порфирины - нет.
Супрамолекулярная химия

Порфирины часто используются для создания структур в супрамолекулярная химия. Эти системы используют кислотность металла по Льюису, обычно цинка. Пример комплекса "хозяин – гость", построенного из макроцикл состоит из четырех порфиринов.[31] Свободный от гостей основной порфирин связан с центром за счет координации с его четырехпиридиновыми заместителями.
Теоретический интерес к ароматичности
Макроциклы порфириноидов могут обладать переменной ароматичностью.[32] Ароматический порфирин Хюккеля - это порфицен.[33] антиароматический, Mobious ароматный, известны неароматические порфириноидные макроциклы.[34]
Смотрите также
- Заболевание, связанное с порфирином: порфирия
- Координированный с железом порфирин: гем
- Гемсодержащая группа ферментов: Цитохром P450
- Координированный с магнием порфирин: хлорофилл
- Более короткие аналоги: Corroles, в том числе витамин B12, который согласован с кобальтом
- Корфины, сильно восстановленный порфирин, координированный с никелем, который связывает Кофактор F430 активный сайт в метил-кофермент М редуктаза (MCR)
- Азотзамещенные порфирины: фталоцианин
Галерея

Структура Льюиса для мезо-тетрафенилпорфирин
УФ – видимый считывание для мезо-тетрафенилпорфирин

Светоактивированный порфирин. Одноатомный кислород. Клеточное старение
Рекомендации
- ^ Райати, Саид; Малекмохаммади, Самира (2016). «Каталитическая активность порфирина марганца (III), нанесенного на многостенные углеродные нанотрубки: эффективный, селективный и многоразовый катализатор окисления алкенов и алканов с помощью мочевины и перекиси водорода». Журнал экспериментальной нанонауки. 11 (11): 872. Bibcode:2016JENan..11..872R. Дои:10.1080/17458080.2016.1179802.
- ^ Иванов, Александр С .; Болдырев, Александр I. (2014). «Расшифровка ароматичности порфириноидов с помощью адаптивного распределения естественной плотности». Органическая и биомолекулярная химия. 12 (32): 6145–6150. Дои:10.1039 / C4OB01018C. PMID 25002069.
- ^ Лэш, Тимоти Д. (2011). «Происхождение ароматического характера в порфириноидных системах». Журнал порфиринов и фталоцианинов. 15 (11n12): 1093–1115. Дои:10.1142 / S1088424611004063.
- ^ Харпер, Дуглас; Бульоне, Дрю Кэри. "порфирия (сущ.)". Интернет-словарь этимологии. Получено 14 сентября 2014.
- ^ Scott, L.J .; Гоа, К. Л. (2000). «Вертепорфин». Наркотики и старение. 16 (2): 139–146, обсуждение 146–8. Дои:10.2165/00002512-200016020-00005. PMID 10755329.
- ^ а б Карл М. Кадиш, изд. (1999). Справочник по порфиринам. Эльзевир. п. 381. ISBN 9780123932006.
- ^ Чжан, Бо; Лэш, Тимоти Д. (сентябрь 2003 г.). «Полный синтез порфиринового минерала абельсонита и родственных петропорфиринов с пятичленными экзоциклическими кольцами». Буквы Тетраэдра. 44 (39): 7253. Дои:10.1016 / j.tetlet.2003.08.007.
- ^ Мейсон, Г. М .; Trudell, L.G .; Брантхейвер, Дж. Ф. (1989). «Обзор стратиграфического распространения и диагенетической истории абельсонита». Органическая геохимия. 14 (6): 585. Дои:10.1016/0146-6380(89)90038-7.
- ^ П. Ротемунд (1936). «Новый синтез порфирина. Синтез порфина». Варенье. Chem. Soc. 58 (4): 625–627. Дои:10.1021 / ja01295a027.
- ^ П. Ротемунд (1935). «Образование порфиринов из пиррола и альдегидов». Варенье. Chem. Soc. 57 (10): 2010–2011. Дои:10.1021 / ja01313a510.
- ^ А. Д. Адлер; Ф. Р. Лонго; Дж. Д. Финарелли; Дж. Гольдмахер; Дж. Ассур; Л. Корсаков (1967). "Упрощенный синтез для мезо-тетрафенилпорфин ». J. Org. Chem. 32 (2): 476. Дои:10.1021 / jo01288a053.
- ^ Vogel, E; К6чер, М. (март 1986 г.). «Порфицен - новый изомер порфина». Angewandte Chemie. 25 (3): 257. Дои:10.1002 / anie.198602571.
- ^ ТОМАС Дж., ДАГЕРТИ (2001). «Основные принципы фотодинамической терапии». J. Порфирины Фталоцианины. 5 (2): 105. Дои:10.1002 / jpp.328.
- ^ Проф. Д-р Эмануэль, Фогель; Проф. Доктор Роджер, Гилар (ноябрь 1993 г.). «Новые порфиценовые лиганды: октаэтил- и этиопорфицен (OEPc и EtioPc) - тетра- и пентакоординированные комплексы цинка OEPc». Angewandte Chemie International Edition. 32 (11): 1600. Дои:10.1002 / anie.199316001.
- ^ Фогель, Эмануэль; Шольц, Питер; Демут, Ральф; Эрбен, Кристоф; Брёринг, Мартин; Шмиклер, Ганс; Лекс, Иоганн; Hohlneicher, Георг; Бремм, Доминик; У Юнь-Донг (4 октября 1999 г.). «Изопорфицен: четвертый конституциональный изомер порфирина с ядром N4 - возникновение E / Z-изомерии». Angewandte Chemie International Edition. 38 (19): 2919–2923. Дои:10.1002 / (SICI) 1521-3773 (19991004) 38:19 <2919 :: AID-ANIE2919> 3.0.CO; 2-W. PMID 10540393.
- ^ Хироюки, Фурута (1994). ""N-смешанный порфирин ": новый изомер тетрафенилпорфирина". Варенье. Chem. Soc. 116 (2): 767. Дои:10.1021 / ja00081a047.
- ^ Д-р Лехослав, Латос-Гражинский (18 апреля 1994 г.). «Тетра-п-толилпорфирин с перевернутым пиррольным кольцом: новый изомер порфирина». Angewandte Chemie International Edition. 33 (7): 779. Дои:10.1002 / anie.199407791.
- ^ Джунтини, Франческа; Бойл, Росс; Сибриан-Васкес, Марта; Висенте, М. Граса Х. (2014). «Конъюгаты порфирина для лечения рака». В Кадиш, Карл М .; Смит, Кевин М .; Гилард, Роджер (ред.). Справочник по порфириновым наукам. 27. С. 303–416.
- ^ Вормолд Р., Эванс Дж., Смит Л., Хеншоу К. (2007). «Фотодинамическая терапия при неоваскулярной возрастной дегенерации желтого пятна» (PDF). Кокрановская база данных Syst Rev (3): CD002030. Дои:10.1002 / 14651858.CD002030.pub3. PMID 17636693.
- ^ Прайс М., Терлеки С. Р. и Кессель Д. (2009), Роль перекиси водорода в проапоптотических эффектах фотодинамической терапии. Фотохимия и фотобиология, 85: 1491-1496. DOI: 10.1111 / j.1751-1097.2009.00589.x
- ^ Сингх С., Аггарвал А., Н. В. С. Динеш К. Бхупатираджу, Арианна, Г., Тивари, К., и Дрэйн, К. М. (2015). Гликозилированные порфирины, фталоцианины и другие порфириноиды для диагностики и терапии. Химические обзоры, 115 (18), 10261-10306. DOI: 10.1021 / acs.chemrev.5b00244
- ^ Walker, C.H .; Silby, R.M .; Хопкин, С.П .; Peakall; Д. (2012). Принципы экотоксикологии. Бока-Ратон, Флорида: CRC Press. п. 182. ISBN 978-1-4665-0260-4.
- ^ Хуанг, Xiongyi; Гровс, Джон Т. (2018). «Активация кислорода и радикальные превращения в гемовых белках и металлопорфиринах». Химические обзоры. 118 (5): 2491–2553. Дои:10.1021 / acs.chemrev.7b00373. ЧВК 5855008. PMID 29286645.
- ^ Карл М. Кадиш; Кевин М. Смит; Роджер Гилард, ред. (2012). Справочник по науке о порфиринах с приложениями к химии, физике, материаловедению, инженерии, биологии и медицине. Сингапур: World Scientific. ISBN 9789814335492.
- ^ Чжан, Вэй; Лай, Вэньчжэнь; Цао, Руи (22 февраля 2017 г.). "Энергетические реакции активации малых молекул: восстановление кислорода и реакции выделения водорода и кислорода, катализируемые системами на основе порфирина и коррола". Химические обзоры. 117 (4): 3717–3797. Дои:10.1021 / acs.chemrev.6b00299. ISSN 0009-2665. PMID 28222601.
- ^ Автор Lewtak, Ян П .; Грико, Даниэль Т. (2012). «Синтез π-удлиненных порфиринов посредством внутримолекулярного окислительного связывания». Химические коммуникации. 48 (81): 10069–10086. Дои:10.1039 / c2cc31279d. PMID 22649792.
- ^ Майкл Г. Уолтер; Александр Б. Рудин; Карл С. Вамсер (2010). «Порфирины и фталоцианины в солнечных фотоэлектрических элементах». Журнал порфиринов и фталоцианинов. 14 (9): 759–792. Дои:10.1142 / S1088424610002689.
- ^ Асуани Йелла; Сюань-Вэй Ли; Хой Нок Цао; Ченьи Йи; Аравинд Кумар Чандиран; Md.Khaja Nazeeruddin; Эрик Вей-Гуан Диау; Чен-Ю Йе; Шайк М. Закееруддин; Михаэль Гретцель (2011). «Сенсибилизированные порфирином солнечные элементы с окислительно-восстановительным электролитом на основе кобальта (II / III) превышают 12-процентную эффективность». Наука. 334 (6056): 629–634. Bibcode:2011Научный ... 334..629Y. Дои:10.1126 / science.1209688. PMID 22053043. S2CID 28058582.
- ^ Дин, Юбин; Чжу, Вэй-Хун; Се, Юншу (2017). «Разработка ионных хемосенсоров на основе аналогов порфирина». Химические обзоры. 117 (4): 2203–2256. Дои:10.1021 / acs.chemrev.6b00021. PMID 27078087.
- ^ Фам, Туан Ань; Сун, Фэй; Альберти, Мариза Н .; Нгуен, Мань-Тхыонг; Трапп, Нильс; Тильген, Карло; Дидерих, Франсуа; Штер, Мейке (2015). «Термоиндуцированное образование одномерных координационных полимеров на Au (111): исследование СТМ» (PDF). Chem. Сообщество. 51 (77): 14473–6. Дои:10.1039 / C5CC04940G. PMID 26278062.
- ^ а б Салли Андерсон; Гарри Л. Андерсон; Алан Башалл; Мэри Макпартлин; Джереми К. М. Сандерс (1995). «Сборка и кристаллическая структура фотоактивного массива пяти порфиринов». Энгью. Chem. Int. Эд. Англ. 34 (10): 1096–1099. Дои:10.1002 / anie.199510961.
- ^ Schleyer, Paul v. R .; Ву, Джуди I .; Фернандес, Израиль (3 декабря 2012 г.). «Описание ароматичности порфириноидов». Варенье. Chem. Soc. 135 (1): 315–21. Дои:10.1021 / ja309434t. PMID 23205604.
- ^ Кадиш, Карл М .; Смит, Кевин М .; Гилард, Роджер. Справочник по порфиринам. Академическая пресса. ISBN 0123932009.
- ^ Юн, Зин Сок; Осука, Атсухиро; Ким, Донхо (2009). «Ароматичность Мёбиуса и антиароматичность вспученных порфиринов». Химия природы. 1 (2): 113–22. Дои:10.1038 / nchem.172. PMID 21378823.