Декарбоксилаза уропорфириноген III - Uroporphyrinogen III decarboxylase
Декарбоксилаза уропорфириноген III (уропорфириноген декарбоксилаза, или же UROD) является фермент (EC 4.1.1.37 ), который у человека кодируется UROD ген.[5]
Функция
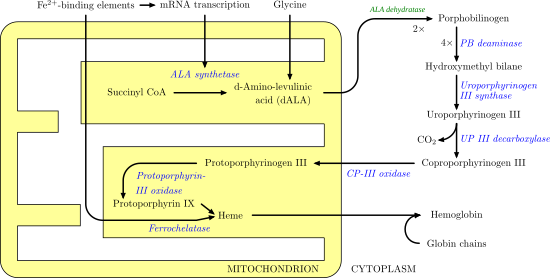
Декарбоксилаза уропорфириноген III - гомодимерный фермент (PDB: 1URO), Который катализирует пятый шаг в гем биосинтез, что соответствует устранению карбоксил группы из четырех ацетат боковые цепи уропорфириноген III уступить копропорфириноген III:
Клиническое значение
Известно, что мутации и дефицит этого фермента вызывают семейные поздняя кожная порфирия и гепатоэритропоэтическая порфирия.[5]
Механизм
Считается, что при низких концентрациях субстрата реакция идет по упорядоченному маршруту с последовательным удалением CO.2 от колец D, A, B и C, тогда как при более высоких уровнях субстрата / фермента, кажется, действует случайный путь. Фермент действует как димер в растворе, и ферменты человека и табака были кристаллизованы и растворены с хорошим разрешением.

UroD считается необычной декарбоксилазой, поскольку она выполняет декарбоксилирование без вмешательства каких-либо кофакторов, в отличие от подавляющего большинства декарбоксилаз. Недавно было предложено, чтобы его механизм происходил через протонирование подложки аргинин остаток.[6] Отчет 2008 года показал, что некаталитическая скорость реакции UroD составляет 10−19 s−1, поэтому при pH 10 ускорение скорости UroD относительно некаталитической скорости, т.е.каталитическая эффективность, является наибольшей для любого известного фермента, 6 x 1024 M−1.[7]

Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000126088 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000028684 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б «Энтрез Ген: уропорфириноген декарбоксилаза UROD».
- ^ Сильва П.Дж., Рамос М.Дж. (2005). «Плотно-функциональное исследование механизмов декарбоксилирования без кофакторов с помощью декарбоксилазы уропорфириноген III». J Phys Chem B. 109 (38): 18195–200. Дои:10.1021 / jp051792s.
- ^ Льюис Калифорния, Вольфенден Р. (ноябрь 2008 г.). «Декарбоксилирование уропорфириногена как эталон каталитического мастерства ферментов». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 105 (45): 17328–33. Дои:10.1073 / pnas.0809838105. ЧВК 2582308. PMID 18988736.
дальнейшее чтение
- Старейшина Г. Х., Ли Дж. Б., Тови Дж. А. (1978). «Снижение активности уропорфириноген декарбоксилазы печени при спорадической поздней кожной порфирии». N. Engl. J. Med. 299 (6): 274–8. Дои:10.1056 / NEJM197808102990603. PMID 661926.
- де Верней Х., Буржуа Ф., де Рой Ф. и др. (1992). «Характеристика новой мутации (R292G) и делеции в локусе декарбоксилазы уропорфириноген человека у двух пациентов с гепатоэритропоэтической порфирией». Гм. Genet. 89 (5): 548–52. Дои:10.1007 / bf00219182. HDL:1765/58484. PMID 1634232.
- Романа М., Грандшамп Б., Дубарт А. и др. (1991). «Идентификация новой мутации, ответственной за гепатоэритропоэтическую порфирию». Евро. J. Clin. Вкладывать деньги. 21 (2): 225–9. Дои:10.1111 / j.1365-2362.1991.tb01814.x. PMID 1905636.
- Гарей Дж. Р., Харрисон Л. М., Франклин К. Ф. и др. (1990). «Уропорфириноген декарбоксилаза: мутация сайта сплайсинга вызывает делецию экзона 6 во многих семьях с поздней кожной порфирией». J. Clin. Вкладывать деньги. 86 (5): 1416–22. Дои:10.1172 / JCI114856. ЧВК 296884. PMID 2243121.
- Гарей Дж. Р., Хансен Дж. Л., Харрисон Л. М. и др. (1989). «Точечная мутация в кодирующей области уропорфириноген декарбоксилазы, ассоциированная с семейной поздней кожной порфирией». Кровь. 73 (4): 892–5. PMID 2920211.
- Roméo PH, Raich N, Dubart A и др. (1986). «Молекулярное клонирование и нуклеотидная последовательность полной кДНК уропорфириноген декарбоксилазы человека». J. Biol. Chem. 261 (21): 9825–31. PMID 3015909.
- Дубарт А., Маттей М.Г., Райх Н. и др. (1986). «Отнесение человеческой уропорфириногендекарбоксилазы (URO-D) к полосе p34 хромосомы 1». Гм. Genet. 73 (3): 277–9. Дои:10.1007 / BF00401245. PMID 3460962.
- Романа М., Дубарт А., Бопен Д. и др. (1987). «Структура гена уропорфириногендекарбоксилазы человека». Нуклеиновые кислоты Res. 15 (18): 7343–56. Дои:10.1093 / nar / 15.18.7343. ЧВК 306252. PMID 3658695.
- де Верней Х., Грандшам Б., Бомон С. и др. (1986). «Структурный мутант декарбоксилазы уропорфириноген (Gly281 ---- Glu) в случае порфирии». Наука. 234 (4777): 732–4. Дои:10.1126 / science.3775362. PMID 3775362.
- Робертс А.Г., старейшина Г.Х., Де Саламанка Р.Э. и др. (1995). «Мутация (G281E) гена уропорфириноген-декарбоксилазы человека вызывает как гепатоэритропоэтическую порфирию, так и явную семейную позднюю кожную порфирию: биохимические и генетические исследования на испанских пациентах». J. Invest. Дерматол. 104 (4): 500–2. Дои:10.1111 / 1523-1747.ep12605953. PMID 7706766.
- Маруяма К., Сугано С. (1994). «Олиго-кэппинг: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Ген. 138 (1–2): 171–4. Дои:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Мегуро К., Фудзита Х., Исида Н. и др. (1994). «Молекулярные дефекты уропорфириноген декарбоксилазы у пациента с легкой гепатоэритропоэтической порфирией». J. Invest. Дерматол. 102 (5): 681–5. Дои:10.1111 / 1523-1747.ep12374134. PMID 8176248.
- Моран-Хименес М.Дж., Гед С., Романа М. и др. (1996). «Уропорфириноген декарбоксилаза: полная последовательность гена человека и молекулярное исследование трех семейств гепатоэритропоэтической порфирии». Являюсь. J. Hum. Genet. 58 (4): 712–21. ЧВК 1914669. PMID 8644733.
- Макманус Дж. Ф., Бегли К. Г., Сасса С., Ратнайк С. (1996). «Пять новых мутаций в гене уропорфириногендекарбоксилазы, выявленные в семьях с кожной порфирией». Кровь. 88 (9): 3589–600. PMID 8896428.
- Судзуки Ю., Ёситомо-Накагава К., Маруяма К. и др. (1997). «Создание и характеристика полноразмерной библиотеки кДНК, обогащенной по 5'-концу». Ген. 200 (1–2): 149–56. Дои:10.1016 / S0378-1119 (97) 00411-3. PMID 9373149.
- Уитби Ф. Г., Филлипс Дж. Д., Кушнер Дж. П., Хилл С. П. (1998). «Кристаллическая структура уропорфириногендекарбоксилазы человека». EMBO J. 17 (9): 2463–71. Дои:10.1093 / emboj / 17.9.2463. ЧВК 1170588. PMID 9564029.
- Мендес М., Соркин Л., Россетти М.В. и др. (1998). «Семейная поздняя кожная порфирия: характеристика семи новых мутаций уропорфириноген-декарбоксилазы и частота общих аллелей гемохроматоза». Являюсь. J. Hum. Genet. 63 (5): 1363–75. Дои:10.1086/302119. ЧВК 1377546. PMID 9792863.
- Ван Х, Лонг Кью, Марти С.Д. и др. (1998). «Модель рыбок данио для гепатоэритропоэтической порфирии». Nat. Genet. 20 (3): 239–43. Дои:10.1038/3041. PMID 9806541.
- Макманус Дж. Ф., Бегли К. Г., Сасса С., Ратнайк С. (1999). «Три новые мутации в гене уропорфириноген-декарбоксилазы в семейной поздней кожной порфирии. Краткое описание мутации № 237. Онлайн». Гм. Мутат. 13 (5): 412–413. Дои:10.1002 / (SICI) 1098-1004 (1999) 13: 5 <412 :: AID-HUMU13> 3.0.CO; 2-N. PMID 10338097.
- Кристиансен Л., Гед С., Хомбрадос И. и др. (1999). «Скрининг мутаций в гене уропорфириногендекарбоксилазы с использованием денатурирующего градиентного гель-электрофореза. Идентификация и характеристика шести новых мутаций, связанных с семейным PCT». Гм. Мутат. 14 (3): 222–32. Дои:10.1002 / (SICI) 1098-1004 (1999) 14: 3 <222 :: AID-HUMU5> 3.0.CO; 2-V. PMID 10477430.
внешняя ссылка
- Обзор всей структурной информации, доступной в PDB за UniProt: P06132 (Уропорфириноген декарбоксилаза) в PDBe-KB.