Ацетат - Acetate
 | |
| Имена | |
|---|---|
| Название ИЮПАК Ацетат | |
| Систематическое название ИЮПАК Ethanoate | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C 2ЧАС 3О− 2 | |
| Конъюгированная кислота | Уксусная кислота |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
An ацетат /ˈæsɪтeɪт/ это поваренная соль образованный комбинацией уксусная кислота с основанием (например, щелочной, землистый, металлический, неметаллических или радикальный основание ). «Ацетат» также описывает сопряженное основание или ион (в частности, отрицательно заряженный ион, называемый анион ) обычно встречается в водный раствор и написано химической формулой C
2ЧАС
3О−
2. Нейтральные молекулы, образованные комбинацией ацетат-иона и положительный ион (называемый катион ) также обычно называют ацетатами (отсюда ацетат свинца, ацетат алюминия, так далее.). Самый простой из них - это ацетат водорода (так называемый уксусная кислота ) с соответствующими солями, сложные эфиры, а многоатомный анион CH
3CO−
2, или же CH
3COO−
.
Большая часть из примерно 5 миллиардов килограммов уксусной кислоты, производимой ежегодно в промышленности, используется в производстве ацетатов, которые обычно имеют форму полимеры. В природе ацетат является наиболее распространенным строительным материалом для биосинтез. Например, жирные кислоты производятся путем соединения двух атомов углерода ацетата с растущей жирной кислотой.[1]
Номенклатура и общая формула
Когда часть поваренная соль, формула ацетат-иона записывается как CH
3CO−
2, C
2ЧАС
3О−
2, или же CH
3COO−
. Химики часто представляют ацетат как OAc.− или, реже, AcO−. Таким образом, HOAc - это символ уксусной кислоты, NaOAc - для ацетат натрия, и EtOAc для этилацетат[2] (поскольку Ac является общим символом для ацетил группа CH3CO[3][4]). символ псевдоэлемента «Ас» также иногда встречается в химических формулах как указывающий на весь ацетат-ион (CH3CO2−).[нужна цитата ] Не следует путать с символом актиний, первый элемент актинид серии; контекст устраняет неоднозначность. Например, формула ацетата натрия может быть сокращена как «NaOAc», а не «NaC».2ЧАС3О2". Также следует проявлять осторожность, чтобы не путать с перуксусная кислота при использовании аббревиатуры OAc; для ясности и во избежание ошибок при переводе следует избегать использования HOAc в литературе, где упоминаются оба соединения.
Хотя его систематическое название является этаноат (/ɪˈθæпoʊ.eɪт/), общее ацетат остается предпочтительное название ИЮПАК.[5]
Соли

Ацетат анион, [CH3COO]−, (или [C2ЧАС3О2]−) один из карбоксилат семья. Это сопряженное основание из уксусная кислота. При pH выше 5,5 уксусная кислота превращается в ацетат:[2]
- CH3COOH ⇌ CH3COO− + H+
Многие соли ацетата являются ионными, на что указывает их склонность хорошо растворяться в воде. Часто встречающийся в домашних условиях ацетат - это ацетат натрия, белое твердое вещество, которое можно приготовить, смешав уксус и бикарбонат натрия («гидрокарбонат соды»):
- CH3COOH + NaHCO3 → CH3COO−Na+ + H2O + CO2
Переходные металлы может образовывать комплекс с ацетатом. Примеры ацетатных комплексов включают ацетат хрома (II) и основной ацетат цинка.
Коммерчески важные ацетатные соли: ацетат алюминия, используется в крашение, ацетат аммония, предшественник ацетамид, и ацетат калия, используется как мочегонное средство. Все три соли бесцветны и хорошо растворяются в воде.[6]
Сложные эфиры
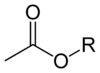
Сложные эфиры ацетата имеют общую формулу CH3CO2R, где R - органиловая группа. Сложные эфиры являются доминирующими формами ацетата на рынке. В отличие от ацетатных солей, ацетатные эфиры часто бывают жидкими, липофильными, а иногда и летучими. Они популярны, потому что имеют безобидный, часто сладкий запах, недорогие и обычно малотоксичные.
Почти половина производимой уксусной кислоты расходуется на производство винилацетат, предшественник поливиниловый спирт, который является составной частью многих краски. Вторая по величине область применения уксусной кислоты приходится на производство ацетат целлюлозы. Фактически, «ацетат» - это жаргон для ацетата целлюлозы, который используется в производстве волокон или различных продуктов, например то ацетатные диски используется в производстве аудиозаписей. Ацетат целлюлозы можно найти во многих бытовых товарах. Многие промышленные растворители ацетаты, в том числе метилацетат, ацетат этила, изопропилацетат, этилгексилацетат. Бутилацетат - это ароматизатор, используемый в пищевых продуктах.[6]
Ацетат в биологии
Ацетат - распространенный анион в биологии. Он в основном используется организмами в виде ацетилкофермент А.[7]
Внутрибрюшинное введение ацетата натрия (20 или 60 мг на кг массы тела) вызывает головную боль у сенсибилизированных крыс, и было высказано предположение, что ацетат, возникающий в результате окисления этиловый спирт является основным фактором, вызывающим похмелье. Повышенный уровень ацетата в сыворотке крови приводит к накоплению аденозин во многих тканях, включая мозг, и введение аденозин антагонист рецепторов кофеин у крыс после того, как было обнаружено, что этанол снижает ноцицептивный поведение.[8][9]
Ферментация ацетил-КоА до ацетата
Пируват превращается в ацетил-кофермент А (ацетил-КоА) ферментом пируватдегидрогеназа. Этот ацетил-КоА затем превращается в ацетат в Кишечная палочка, производя АТФ фосфорилирование на уровне субстрата. Для образования ацетата необходимы два фермента: фосфатацетилтрансфераза и ацетаткиназа.[10]

ацетил-КоА + фосфат → ацетил-фосфат + КоА
ацетилфосфат + АДФ → ацетат + АТФ
Ферментация ацетата
Уксусная кислота также может подвергаться дисмутация реакция на производство метан и углекислый газ:[11][12]
- CH3COO− + H+ → CH4 + CO2 Δграмм° = -36 кДж / моль
Этот непропорциональность реакция катализируется метаноген археи в их ферментативном метаболизме. Один электрон переносится из карбонил функция (е− донор ) из карбоновый группа в метил группа (е− акцептор ) уксусной кислоты для получения CO2 и газ метан.
Структуры

Модель заполнения пространства ацетат-аниона 
резонансный гибрид ацетат-аниона 
канонические формы ацетат-аниона
Смотрите также
- Ацетилирование
- Ацетат целлюлозы
- Ацетат меди (II)
- Ферментация (биохимия)
- Ацетат натрия
- Смешанное кислотное брожение
- Уксусная кислота
- Ацетилхлорид
- Цинка ацетат
Рекомендации
- ^ Марч, Дж. «Продвинутая органическая химия», 4-е изд. Дж. Вили и сыновья, 1992: Нью-Йорк. ISBN 0-471-60180-2.
- ^ а б Зумдал, С.С. «Химия» Хит, 1986: Лексингтон, Массачусетс. ISBN 0-669-04529-2.
- ^ Международный союз теоретической и прикладной химии (2005). Номенклатура неорганической химии (Рекомендации ИЮПАК 2005 г.). Кембридж (Великобритания): RSC –ИЮПАК. ISBN 0-85404-438-8. п. 63. Электронная версия.
- ^ Brimble, Маргарет А .; Блэк, Дэвид StC .; Хартсхорн, Ричард; Rauter, Amélia P .; Ша, Чин-Канг; Сиднес, Лейв К. (10 ноября 2012 г.). «Правила сокращения защитных групп (Технический отчет IUPAC)». Чистая и прикладная химия. 85 (1): 310. Дои:10.1351 / PAC-REP-12-07-12.
- ^ R-9.1 Сохранены тривиальные и полусистематические названия для наименования органических соединений В архиве 2014-02-08 в Wayback Machine, Руководство по номенклатуре органических соединений ИЮПАК, Комиссия ИЮПАК по номенклатуре органической химии
- ^ а б Осия Чунг, Робин С. Танке, Дж. Пол Торренс «Уксусная кислота» в Энциклопедия промышленной химии Ульмана Вайнхайм, Германия: Wiley-VCH, 2005. Дои:10.1002 / 14356007.a01_045
- ^ Nelson, D. L .; Кокс, М. М. «Ленингер, принципы биохимии», 3-е изд. Стоит опубликовать: Нью-Йорк, 2000. ISBN 1-57259-153-6.
- ^ Максвелл, Кристина; и другие. (2010). «Ацетат вызывает у крыс головную боль, вызванную алкогольным похмельем». PLoS ONE. 5 (12): e15963. Bibcode:2010PLoSO ... 515963M. Дои:10.1371 / journal.pone.0015963. ЧВК 3013144. PMID 21209842.
- ^ «Кофе - настоящее лекарство от похмелья?» Боб Холмс, Новый ученый, 15 января 2011 г., стр. 17.
- ^ Кеселер, Ингрид М .; и другие. (2011). «EcoCyc: обширная база данных по биологии Escherichia coli». Исследования нуклеиновых кислот. 39: D583 – D590. Дои:10.1093 / nar / gkq1143. ЧВК 3013716. PMID 21097882.
- ^ Ферри, Дж. (1992). «Метан из ацетата». Журнал бактериологии. 174 (17): 5489–5495. ЧВК 206491. Получено 2011-11-05.
- ^ Vogels, G.D .; Keltjens, J. T .; Ван дер Дрифт, К. (1988). «Биохимия производства метана». В Zehnder A.J.B. (ред.). Биология анаэробных микроорганизмов. Нью-Йорк: Вили. С. 707–770.
внешняя ссылка
Ацетилгалогениды и соли ацетат ион | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| AcOH | Он | ||||||||||||||||||
| LiOAc | Быть (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | AcOOH | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 АЛСОЛ Al (OAc)2ОЙ Al2ТАК4(OAc)4 | Si | п | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Как (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Nb | Пн (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | CD (OAc)2 | В | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Та | W | Re | Операционные системы | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Би (OAc)3 | По | В | Rn | |||
| Пт | Ра | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |||
| ↓ | |||||||||||||||||||
| Ла (OAc)3 | Ce (OAc)Икс | Pr | Nd | Вечера | Sm (OAc)3 | Eu (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Хо (OAc)3 | Э | Тм | Yb (OAc)3 | Лу (OAc)3 | |||||
| Ac | Чт | Па | UO2(OAc)2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||||


