Ацетилирование - Acetylation

Ацетилирование (или в Номенклатура ИЮПАК этаноилирование) является органическим этерификация реакция с уксусная кислота. Он вводит ацетил функциональная группа в химическое соединение. Такие соединения называют сложными эфирами ацетата или ацетатами. Деацетилирование обратная реакция, удаление ацетильной группы из химического соединения.
Реакции ацетилирования и деацетилирования протекают в живых клетках в виде метаболизм лекарств ферментами в печени и других органах (например, головном мозге). Фармацевтические препараты часто используют ацетилирование, чтобы такие эфиры могли проникать через гематоэнцефалический барьер (и плацента ), где они деацетилируются ферментами (карбоксилэстеразы ) аналогично ацетилхолин. Примеры ацетилированных фармацевтических препаратов: диацетилморфин (героин), Ацетилсалициловая кислота (аспирин), THC-O-ацетат, и диацереин. И наоборот, такие препараты, как изониазид ацетилируются в печени во время метаболизма лекарств. Препарат, действие которого зависит от таких метаболических преобразований, называется пролекарство.
Для реакций этерификации вне клеток уксусный ангидрид обычно используется.
Ацетилирование белков
Ацетилирование - важная модификация белков в клеточная биология; и протеомные исследования идентифицировали тысячи ацетилированных белков млекопитающих.[1][2][3] Ацетилирование происходит как ко-трансляционный и посттрансляционная модификация из белки, Например, гистоны, p53, и тубулины. Среди этих белков хроматин белки и метаболические ферменты широко представлены, что указывает на то, что ацетилирование оказывает значительное влияние на экспрессия гена и метаболизм. В бактерии, 90% белков участвуют в центральном метаболизме Salmonella enterica ацетилированы.[4][5]
N-концевое ацетилирование

N-концевой ацетилирование - одна из наиболее распространенных ко-трансляционных ковалентных модификаций белков в эукариоты, и это имеет решающее значение для регуляции и функции различных белков. N-концевое ацетилирование играет важную роль в синтезе, стабильности и локализации белков. Около 85% всех белков человека и 68% в дрожжи ацетилированы на своем Nα-конце.[6] Несколько белков из прокариоты и археи также модифицируются N-концевым ацетилированием.
N-концевое ацетилирование катализируется набором ферментных комплексов, N-концевые ацетилтрансферазы (NAT). NAT переносят ацетильную группу из ацетил-кофермент А (Ac-CoA) к α-аминогруппе первого аминокислота остаток белка. Различные NAT ответственны за ацетилирование N-конца растущего белка, и до сих пор было обнаружено, что ацетилирование необратимо.[7]
N-концевые ацетилтрансферазы
На сегодняшний день у человека обнаружено семь различных NAT - NatA, NatB, NatC, NatD, NatE, NatF и NatH. Каждый из этих различных ферментных комплексов специфичен для разных аминокислот или аминокислотных последовательностей, которые показаны в следующей таблице.
Таблица 1. Состав и субстратная специфичность NAT.
| NAT | Субъединицы (каталитические субъединицы находятся в смелый.) | Субстраты |
|---|---|---|
| NatA | Naa10 (Ard1) Naa15 (Nat1) | Сер -, Ала -, Gly -, Тр-, Вал -, Cys - N-конец |
| NatB | Naa20 (Nat3) Naa25 (Mdm20) | Встретились -Glu -, Встретились -Жерех -, Встретились -Asn -, Встретились -Gln - N-конец |
| NatC | Naa30 (Mak3) Naa35 (Mak10) Naa38 (Mak31) | Встретились -Лея -, Встретились -Иль-, Встретились -Trp-, Встретились -Phe - N-конец |
| NatD | Naa40 (Nat4) | Сер -Gly -Gly -, Сер -Gly -Arg - N-конец |
| NatE | Naa50 (Nat5) Naa10 (Ard1) Naa15 (Nat1) | Встретились -Лея-, Встретились -Ала -, Встретились -Lys -, Встретились -Встретились - N-конец |
| NatF | Naa60 | Встретились -Lys -, Встретились -Лея -, Встретились -Иль-, Встретились -Trp-, Встретились -Phe - N-конец |
| NatH | Naa80 | Актин - N-конец |
NatA

NatA состоит из двух субъединиц, каталитических подразделение Naa10 и вспомогательная субъединица Naa15. Субъединицы NatA более сложны в высших эукариоты чем у низших эукариот. Помимо генов NAA10 и NAA15, гены, специфичные для млекопитающих NAA11 и NAA16, производят функциональные генные продукты, которые образуют различные активные комплексы NatA. Четыре возможных каталитически-вспомогательных димера hNatA образуются этими четырьмя белками. Однако Naa10 / Naa15 - самая распространенная NatA.[9]
Ацетилаты NatA Сер, Ала -, Gly -, Тр-, Вал - и Cys N-конец после инициатора метионин удаляется метионинамино-пептидазами. Эти аминокислоты чаще экспрессируются на N-конце белков у эукариот, поэтому NatA является основным NAT, соответствующим всему количеству его потенциальных субстратов.[10]
Несколько различных партнеров по взаимодействию вовлечены в N-концевое ацетилирование с помощью NatA. Белок K, взаимодействующий с гентингтином (HYPK), взаимодействует с hNatA на рибосома для воздействия на N-концевое ацетилирование субстратов NatA. Субъединицы hNaa10 и hNaa15 будут увеличивать тенденцию к агрегации Хантингтина, если HYPK истощен. Фактор, индуцируемый гипоксией Также было обнаружено, что (HIF) -1α взаимодействует с hNaa10, подавляя опосредованную hNaa10 активацию транскрипционной активности β-катенина.[11]
NatB
Комплексы NatB состоят из каталитической субъединицы Naa20p и вспомогательной субъединицы Naa25p, которые присутствуют как у дрожжей, так и у человека. В дрожжи все субъединицы NatB связаны с рибосомами; но у людей обнаружено, что субъединицы NatB являются ассоциированными с рибосомами и не рибосомными формами. NatB ацетилирует N-концевой метионин субстратов, начиная с Встретились -Glu -, Встретились -Жерех -, Встретились -Asn - или же Встретились -Gln - N termini.
NatC
Комплекс NatC состоит из одной каталитической субъединицы Naa30p и двух вспомогательных субъединиц Naa35p и Naa38p. Все три субъединицы обнаружены на рибосоме дрожжей, но они также обнаруживаются в нерибосомных формах NAT, таких как Nat2. Комплекс NatC ацетилирует N-концевой метионин субстратов. Встретились -Лея -, Встретились -Иль-, Встретились -Trp- или Встретились -Phe N-конец.
NatD
NatD состоит только из каталитического блока Naa40p и Naa40p и концептуально отличается от других NAT. Сначала у дрожжей и человека были идентифицированы только два субстрата, H2A и H4. Во-вторых, субстратная специфичность Naa40p находится в пределах первых 30-50 остатков, что значительно превышает субстратную специфичность других NAT. Ацетилирование гистонов с помощью NatD частично связано с рибосомами, а аминокислотные субстраты представляют собой самые N-концевые остатки, что отличает его от лизин-N-ацетилтрансферазы (КАЦ).[12]
NatE
Комплекс NatE состоит из субъединицы Naa50p и двух субъединиц NatA, Naa10p и Naa15p. N-конец субстратов Naa50p отличается от тех, которые ацетилированы активностью Naa10p в отношении NatA.[13] NAA50 в растениях имеет важное значение для контроля роста, развития и реакции на стресс, а функция NAA50 в высокой степени сохраняется у людей и растений.[14][15][16][17]
NatF

NatF - это NAT, состоящий из фермента Naa60. Первоначально считалось, что NatF был обнаружен только у высших эукариот, так как он отсутствовал в дрожжах.[18] Однако позже было обнаружено, что Naa60 обнаруживается во всем эукариотическом домене, но был вторично потерян в линии грибов.[19] По сравнению с дрожжами, NatF способствует более высокому уровню N-концевого ацетилирования у людей. Комплекс NatF ацетилирует N-концевой метионин субстратов. Встретились -Lys -, Встретились -Лея -, Встретились -Иль-, Встретились -Trp- и Встретились -Phe Концы N, которые частично перекрываются с NatC и NatE.[6] Было показано, что NatF имеет органеллярную локализацию и ацетилирует цитозольные N-концы трансмембранных белков.[20] Органелларная локализация Naa60 опосредована его уникальным С-концом, который состоит из двух альфа-спиралей, которые периферически связаны с мембраной и опосредуют взаимодействия с ней. ПИ (4) П.[21]
NAA80 / NatH
NAA80 / NatH представляет собой N-концевую ацетилтрансферазу, которая специфически ацетилирует N-конец актин.[22]
N-концевая функция ацетилирования
Стабильность белка
N-концевое ацетилирование белков может влиять на стабильность белка, но до сих пор результаты и механизм не были очень ясными.[23] Считалось, что N-концевое ацетилирование защищает белки от разрушения, поскольку N-концы Nα-ацетилирования должны были блокировать N-концевое убиквитинирование и последующее деградация белка.[24] Однако несколько исследований показали, что ацетилированный на N-конце белок имеет такую же скорость разложения, что и белки с неблокированным N-концом.[25]
Локализация белка
Было показано, что N-концевое ацетилирование может управлять локализацией белков. Arl3p - один из "Arf-подобных" (Arl) GTPases, что крайне важно для организации мембранного трафика.[26] Ему нужна его Nα-ацетильная группа для его нацеливания на мембрану Гольджи за счет взаимодействия с проживающим в мембране белком Sys1p. Если Phe или Тир заменен Ала на N-конце Arl3p он больше не может локализоваться на мембране Гольджи, указывая тем самым, что Arl3p нуждается в своих естественных N-концевых остатках, которые могут быть ацетилированы для правильной локализации.[27]
Обмен веществ и апоптоз
Также было доказано, что N-концевое ацетилирование белка связано с регуляцией клеточного цикла, а апоптоз - с экспериментами по нокдауну белка. Нокдаун NatA или комплекса NatC приводит к индукции p53 -зависимый апоптоз, что может указывать на то, что антиапоптотические белки были меньше или больше не функционировали из-за сниженного N-концевого ацетилирования белка.[28] Но в отличие от каспаза-2, который ацетилируется NatA, может взаимодействовать с адаптерным белком RIP, связанным с гомологичным белком Ich-1 / Ced-3 с доменом смерти (RAIDD). Это может активировать каспазу-2 и вызвать апоптоз клеток.[29]
Синтез белка
Рибосома белки играют важную роль в синтезе белков, которые также могут быть ацетилированы на N-конце. N-концевое ацетилирование рибосомных белков может влиять на синтез белка. Снижение скорости синтеза белка на 27% и 23% наблюдалось для штаммов с делецией NatA и NatB. Снижение точности трансляции наблюдалось в штамме с делецией NatA, а в штамме с делецией NatB был замечен дефект рибосомы.[30]
Рак
Было высказано предположение, что NAT действуют как онкобелки и как супрессоры опухолей при раке человека, и экспрессия NAT может увеличиваться или уменьшаться в раковых клетках. Эктопическая экспрессия hNaa10p увеличена распространение клеток и усиление регуляции гена, участвующего в пролиферации выживаемости клеток и метаболизм. Сверхэкспрессия hNaa10p была в моче. Рак мочевого пузыря, рак молочной железы и рак шейки матки.[31] Но высокий уровень экспрессии hNaa10p также может подавлять рост опухоли, а снижение уровня экспрессии hNaa10p связано с плохим прогнозом, большими опухолями и большим количеством метастазов в лимфатические узлы.
Таблица 2. Обзор экспрессии субъединиц NatA в различных раковых тканях.[32]
| Субъединицы Nat | Раковая ткань | Образец выражения |
|---|---|---|
| hNaa10 | рак легких, рак молочной железы, колоректальный рак, гепатоцеллюлярная карцинома | с высоким содержанием опухолей |
| hNaa10 | рак легких, рак молочной железы, панкреатический рак, рак яичников | потеря гетерозиготности в опухолях |
| hNaa10 | рак молочной железы, рак желудка, рак легких | высокий уровень первичных опухолей, низкий уровень метастазов в лимфатические узлы |
| hNaa10 | Немелкоклеточный рак легкого | мало опухолей |
| hNaa15 | папиллярная карцинома щитовидной железы, рак желудка | с высоким содержанием опухолей |
| hNaa15 | нейробластома | высокий уровень опухолей на поздней стадии |
| hNaa11 | гепатоцеллюлярная карцинома | потеря гетерозиготности опухолей |
Ацетилирование и деацетилирование лизина
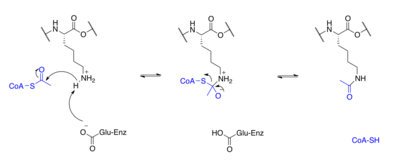
Белки обычно ацетилируются на лизин остатков, и эта реакция зависит от ацетил-кофермент А в качестве донора ацетильной группы. ацетилирование и деацетилирование гистонов, гистоновые белки ацетилируются и деацетилируются по остаткам лизина в N-концевом хвосте как часть генная регуляция. Обычно эти реакции катализируются ферменты с гистонацетилтрансфераза (HAT) или гистоновая деацетилаза (HDAC), хотя HAT и HDAC также могут изменять статус ацетилирования негистоновых белков.[33]
Регуляция факторов транскрипции, эффекторных белков, молекулярные шапероны, а белки цитоскелета путем ацетилирования и деацетилирования являются важным посттрансляционным регуляторным механизмом.[34] Эти регуляторные механизмы аналогичны фосфорилированию и дефосфорилированию под действием киназы и фосфатазы. Не только состояние ацетилирования белка может изменять его активность, но и недавнее предположение, что эта посттрансляционная модификация может также пересекаться с фосфорилирование, метилирование, убиквитинирование, сумоилирование и другие для динамического контроля клеточной сигнализации.[35] Регулирование тубулин белок является примером этого в нейронах мыши и астроглии.[36][37] А тубулин ацетилтрансфераза расположен в аксонема, и ацетилирует субъединицу α-тубулина в собранной микротрубочке. После разборки это ацетилирование удаляется другой специфической деацетилазой в цитозоле клетки. Таким образом, аксонемные микротрубочки, которые имеют длительный период полураспада, несут «характерное ацетилирование», которое отсутствует в цитозольных микротрубочках, которые имеют более короткий период полужизни.
В области эпигенетика, ацетилирование гистонов (и деацетилирование ), как было показано, являются важными механизмами в регуляции транскрипции генов. Однако гистоны - не единственные белки, регулируемые посттрансляционный ацетилирование. Ниже приведены примеры различных других белков, играющих роль в регуляции передачи сигнала, на активность которых также влияет ацетилирование и деацетилирование.
p53
В p53 белок - это подавитель опухолей который играет важную роль в сигнальных транзакциях в клетках, особенно в поддержании стабильности геном предотвращая мутации. Поэтому он также известен как «хранитель генома». Он также регулирует клеточный цикл и останавливает рост клеток, активируя регулятор клеточного цикла, стр.21. В тяжелых условиях Повреждение ДНК, он также инициирует запрограммированная гибель клеток.Функция p53 негативно регулируется онкопротеин Mdm2. Исследования показали, что Mdm2 образует комплекс с p53 и предотвратить его связывание со специфическими p53-чувствительными генами.[38][39]
Ацетилирование р53

Ацетилирование р53 необходимо для его активации. Сообщалось, что уровень ацетилирования р53 значительно повысится, когда клетка подвергнется стрессу. Сайты ацетилирования наблюдались на ДНК-связывающем домене (K164 и K120) и на С-конце.[40] Сайты ацетилирования демонстрируют значительную избыточность: если только один сайт ацетилирования инактивирован мутацией в аргинин, экспрессия стр.21 все еще наблюдается. Однако, если несколько сайтов ацетилирования заблокированы, экспрессия стр.21 и подавление роста клеток, вызванное p53 полностью потеряно. Кроме того, ацетилирование p53 предотвращает его привязку к репрессору Mdm2 по ДНК.[41] Кроме того, предполагается, что ацетилирование p53 имеет решающее значение для его транскрипционно-независимого проапоптотический функции.[42]
Значение для лечения рака
Поскольку основная функция p53 является подавитель опухолей, идея о том, что активация p53 является привлекательной стратегией для лечения рака. Нутлин-3[43] это небольшая молекула, предназначенная для нацеливания p53 и Mdm2 взаимодействие, которое сохранило p53 от деактивации.[44] Отчеты также показали, что раковая клетка при обработке Nutilin-3a ацетилирование lys 382 наблюдалось на c-конце р53.[45][46]
Микротрубочка

Структура микротрубочки длинный полый цилиндр, динамически собранный из α / β-тубулин димеры. Они играют важную роль в поддержании структуры клетки, а также клеточных процессов, например, движения органеллы.[47] Кроме того, микротрубочка отвечает за формирование митотическое веретено в эукариотический клетки для транспортировки хромосомы в деление клеток.[48][49]
Ацетилирование тубулина
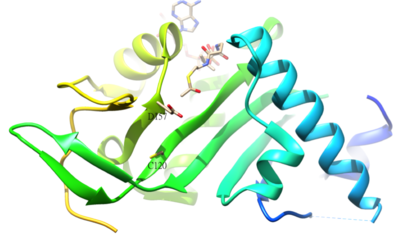
Ацетилированный остаток α-тубулин представляет собой K40, который у человека катализируется α-тубулинацетилтрансферазой (α-TAT). Ацетилирование K40 на α-тубулине является признаком стабильного микротрубочки. Остатки активного центра D157 и C120 α-TAT1 отвечают за катализ из-за формы, комплементарной α-тубулину. Кроме того, некоторые уникальные структурные особенности, такие как β4-β5 заколка для волос Области С-концевой петли и α1-α2 петли важны для специфического α-тубулина. молекулярное распознавание.[50] Обратная реакция ацетилирования катализируется гистоновая деацетилаза 6.[51]
Значение для лечения рака
С микротрубочки играть важную роль в деление клеток, особенно в Фаза G2 / M из клеточный цикл, были попытки помешать микротрубочка функционируют с помощью низкомолекулярных ингибиторов, которые успешно используются в клиниках для лечения рака.[52] Например, барвинок алкалоиды и таксаны избирательно связывать и подавлять микротрубочки, что приводит к остановке клеточного цикла.[53] Идентификация кристаллической структуры ацетилирования α-тубулинацетилтрансферазы (α-TAT) также проливает свет на открытие небольшой молекулы, которая может модулировать стабильность или деполимеризацию тубулин. Другими словами, воздействуя на α-ТАТ, можно предотвратить ацетилирование тубулина и привести к дестабилизации тубулина, что является аналогичным механизмом для дестабилизирующих тубулин агентов.[50]
STAT3
Преобразователь сигнала и активатор транскрипции 3 (STAT3 ) представляет собой фактор транскрипции, который фосфорилируется ассоциированным с рецептором киназы, Например, Тирозинкиназы семейства Янус, и переместиться в ядро. STAT3 регулирует несколько генов в ответ на факторы роста и цитокины и играют важную роль в росте клеток. Следовательно, STAT3 облегчает онкогенез в различных путях, связанных с ростом клеток. С другой стороны, он также играет роль в подавитель опухолей.[54]
Ацетилирование STAT3

Ацетилирование Lys685 из STAT3 важно для STAT3 гомодимеризация, которая необходима для связывания ДНК и активации транскрипции онкогены. Ацетилирование STAT3 катализируется гистонацетилтрансфераза p300, и обратный по типу 1 гистоновая деацетилаза. Ацетилирование лизина STAT3 также повышено в раковых клетках.[55]
Терапевтическое значение для лечения рака
Поскольку ацетилирование STAT3 важно для его онкогенный активности и того факта, что уровень ацетилированного STAT3 высок в раковых клетках, подразумевается, что нацеливание ацетилированного STAT3 на химиопрофилактика и химиотерапия перспективная стратегия. Эта стратегия поддерживается лечением ресвератрол, ингибитор ацетилирования STAT3, в линии раковых клеток обращает аберрантное метилирование CpG-островков.[56]
Ацетилирование древесины
С начала 20-го века ацетилирование древесины исследовалось как метод повышения прочности древесины в плане устойчивости к процессам гниения и плесени. Вторичные преимущества включают улучшение размерной стабильности, улучшенную твердость поверхности и отсутствие ухудшения механических свойств из-за обработки.
Физические свойства любого материала определяются его химической структурой. Древесина содержит множество химических групп, называемых свободные гидроксилы. Свободные гидроксильные группы адсорбируют и выделяют воду в зависимости от климатических условий, которым подвергается древесина. Это объяснение того, почему древесина набухает и сжимается. Также считается, что переваривание древесины ферментами начинается на свободных гидроксильных участках, что является одной из основных причин, по которым древесина склонна к гниению.
Ацетилирование превращает свободные гидроксилы в древесине в ацетильные группы. Это достигается путем реакции древесины с уксусным ангидридом, который получают из уксусной кислоты (известной как уксус в ее разбавленной форме). Когда свободная гидроксильная группа превращается в ацетильную группу, способность древесины поглощать воду значительно снижается, делая древесину более стабильной по размерам и, поскольку она больше не усваивается, чрезвычайно прочной.
В 2007 году лондонская компания Titan Wood с производственными мощностями в Нидерландах добилась рентабельной коммерциализации и начала крупномасштабное производство ацетилированной древесины под торговой маркой «Accoya».
Смотрите также
- Ацетокси группа
- Ацилирование
- Амид
- Компендиум ацетилирования лизина белка
- Сложный эфир
- Гликозилирование
- Липидирование
- Нитрозилирование
- Органический синтез
- Протеолиз
Рекомендации
- ^ Чоудхари К., Кумар С., Гнад Ф, Нильсен М.Л., Рехман М., Вальтер Т.К., Олсен Дж. В., Манн М. (2009). «Ацетилирование лизина нацелено на белковые комплексы и ко-регулирует основные клеточные функции». Наука. 325 (5942): 834–840. Bibcode:2009Sci ... 325..834C. Дои:10.1126 / science.1175371. PMID 19608861. S2CID 206520776.
- ^ Фриц К.С., Галлиган Дж. Дж., Хиршей, доктор медицины, Вердин Э, Петерсен Д. Р. (2012). «Анализ митохондриального ацетилома на мышиной модели алкогольного повреждения печени с использованием мышей с нокаутом SIRT3». J. Proteome Res. 11 (3): 1633–1643. Дои:10.1021 / pr2008384. ЧВК 3324946. PMID 22309199.
- ^ Брук, Том. «Ацетилирование белков: гораздо больше, чем ацетилирование гистонов». Cayman Chemical. Архивировано из оригинал 28 февраля 2014 г.
- ^ Чжао С., Сюй В, Цзян В., Ю В, Лин И, Чжан Т, Яо Дж, Чжоу Л, Цзэн И, Ли Х, Ли И, Ши Дж, Ан В, Хэнкок С.М., Хэ Ф, Цинь Л., Чин Дж. , Ян П, Чен X, Лэй Q, Сюн Y, Гуань KL (2010). «Регуляция клеточного метаболизма ацетилированием лизина протеина». Наука. 327 (5968): 1000–1004. Bibcode:2010Sci ... 327.1000Z. Дои:10.1126 / science.1179689. ЧВК 3232675. PMID 20167786.
- ^ Ван, Цицзюнь; Чжан, Якунь; Ян, Чен; Сюн, Хуэй; Линь, Ян; Яо, Цзюнь; Ли, Хун; Се, Лу; Чжао, Вэй (19 февраля 2010 г.). "Ацетилирование метаболических ферментов координирует использование источников углерода и метаболический поток". Наука. 327 (5968): 1004–1007. Bibcode:2010Sci ... 327.1004W. Дои:10.1126 / science.1179687. ISSN 0036-8075. ЧВК 4183141. PMID 20167787.
- ^ а б Ван Дамм П., Отверстие К, Пимента-Маркес А., Хелсенс К., Вандекеркхове Дж., Мартиньо Р.Г., Геваерт К., Арнесен Т. (2011). «NatF способствует эволюционному сдвигу в ацетилировании N-конца белка и важен для нормальной сегрегации хромосом». PLOS Genet. 7 (7): e1002169. Дои:10.1371 / journal.pgen.1002169. ЧВК 3131286. PMID 21750686.
- ^ Стархейм К.К., Геваерт К., Арнесен Т. (2012). «Белковые N-концевые ацетилтрансферазы: когда начало имеет значение». Trends Biochem. Наука. 37 (4): 152–161. Дои:10.1016 / j.tibs.2012.02.003. PMID 22405572.
- ^ Лискак Г., Гольдберг Дж. М., Фойн Х, Петерссон Э. Дж., Арнесен Т., Марморштейн Р. (2013). «Молекулярная основа N-концевого ацетилирования гетеродимерным комплексом NatA». Nat. Struct. Мол. Биол. 20 (9): 1098–105. Дои:10.1038 / nsmb.2636. ЧВК 3766382. PMID 23912279.
- ^ Стархейм К.К., Громыко Д., Велде Р., Вархауг Дж. Э., Арнесен Т. (2009). «Состав и биологическое значение Nalpha-терминальных ацетилтрансфераз человека». BMC Proceedings. 3 Дополнение 6 (Дополнение 6): S3. Дои:10.1186 / 1753-6561-3-s6-s3. ЧВК 2722096. PMID 19660096.
- ^ Арнесен Т., Ван Дамм П., Полевода Б., Хелсенс К., Эвьент Р., Коларт Н., Вархауг Дж. Э., Вандекеркхов Дж., Лиллехауг Дж. Р., Шерман Ф., Геваерт К. (2009). «Протеомический анализ показывает эволюционную консервацию и дивергенцию N-концевых ацетилтрансфераз дрожжей и людей». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 106 (20): 8157–8162. Bibcode:2009PNAS..106.8157A. Дои:10.1073 / pnas.0901931106. ЧВК 2688859. PMID 19420222.
- ^ Арнесен Т., Стархейм К.К., Ван Дамм П., Эвьент Р., Дин Х., Беттс М.Дж., Рюнинген А., Вандекеркхове Дж., Геваерт К., Андерсон Д. (2010). «Шапероноподобный белок HYPK вместе с NatA участвует в котрансляционном N-концевом ацетилировании и предотвращении агрегации Хантингтина». Мол. Клетка. Биол. 30 (8): 1898–1909. Дои:10.1128 / mcb.01199-09. ЧВК 2849469. PMID 20154145.
- ^ Отверстие К., Ван Дамм П., Дальва М., Акснес Х., Гломнес Н., Вархауг Дж. Э., Лиллехауг Дж. Р., Геваерт К., Арнесен Т. (2011). «Человеческая N-альфа-ацетилтрансфераза 40 (hNaa40p / hNatD) консервативна из дрожжей и ацетилирует на N-конце гистоны H2A и H4». PLOS ONE. 6 (9): e24713. Bibcode:2011PLoSO ... 624713H. Дои:10.1371 / journal.pone.0024713. ЧВК 3174195. PMID 21935442.
- ^ Gautschi M, Just S, Mun A, Ross S, Rücknagel P, Dubaquié Y, Ehrenhofer-Murray A, Rospert S (2003). «Дрожжевая N (альфа) -ацетилтрансфераза NatA количественно закреплена на рибосоме и взаимодействует с возникающими полипептидами». Мол. Клетка. Биол. 23 (20): 7403–7414. Дои:10.1128 / mcb.23.20.7403-7414.2003. ЧВК 230319. PMID 14517307.
- ^ Хартман, Сьон (август 2020 г.). «Значение конца: N-терминальная ацетилтрансфераза NAA50 контролирует рост растений и стрессовые реакции». Физиология растений. 183 (4): 1410–1411. Дои:10.1104 / стр. 20.00794. PMID 32747486.
- ^ Армбрустер, Лаура; Линстер, Эрик; Бойер, Жан-Батист; Брюнье, Анника; Эйрих, Юрген; Стефан, Ивона; Bienvenut, Willy V .; Вайденхаузен, Йонас; Мейннель, Тьерри; Ад, Рюдигер; Грех, Ирмгард; Финкемайер, Ирис; Джильоне, Кармела; Виртц, Маркус (август 2020 г.). «NAA50 представляет собой ферментативно активную Nα-ацетилтрансферазу, которая имеет решающее значение для развития и регуляции стрессовых реакций». Физиология растений. 183 (4): 1502–1516. Дои:10.1104 / стр. 20.00222.
- ^ Нойбауэр, Мэтью; Иннес, Роджер В. (август 2020 г.). «Потеря ацетилтрансферазы NAA50 вызывает стресс эндоплазматического ретикулума и иммунные реакции и подавляет рост». Физиология растений. 183 (4): 1838–1854. Дои:10.1104 / стр. 20.00225.
- ^ Фэн, Цзиньлинь; Ху, Цзяньсинь; Ли, Ян; Ли, Руйци; Ю, Хао; Ма, Лигенг (16 июня 2020 г.). «N-концевая ацетилтрансфераза Naa50 регулирует рост Arabidopsis и реакцию на осмотический стресс». Физиология растений и клеток: pcaa081. Дои:10.1093 / pcp / pcaa081.
- ^ Ван Дамм П., Отверстие К, Пимента-Маркес А. и др. (Июль 2011 г.). «NatF способствует эволюционному сдвигу в ацетилировании N-конца белка и важен для нормальной сегрегации хромосом». PLOS Genet. 7 (7): e1002169. Дои:10.1371 / journal.pgen.1002169. ЧВК 3131286. PMID 21750686.
- ^ Ратхор, Ом Сингх; Фаустино, Александра; Пруденсио, Педро; Ван Дамм, Петра; Кокс, Саймон Дж .; Мартинью, Руи Гонсало (2016). «Отсутствие диверсификации N-концевой ацетилтрансферазы в процессе эволюции эукариотических организмов». Научные отчеты. 6: 21304. Bibcode:2016НатСР ... 621304Р. Дои:10.1038 / srep21304. ЧВК 4748286. PMID 26861501.
- ^ Акснес (3 марта 2015 г.). «Органелларная Nα-ацетилтрансфераза, Naa60, ацетилирует цитозольные N-концы трансмембранных белков и поддерживает целостность Гольджи». Отчеты по ячейкам. 10 (8): 1362–74. Дои:10.1016 / j.celrep.2015.01.053. PMID 25732826.
- ^ Акснес, Генриетта; Горис, Марианна; Стрёмланд, Ойвинд; Дразич, Адриан; Вахид, Кайзер; Рейтер, Натали; Арнесен, Томас (2017). «Молекулярные детерминанты N-концевой ацетилтрансферазы Naa60, прикрепляющейся к мембране Гольджи». Журнал биологической химии. 292 (16): 6821–6837. Дои:10.1074 / jbc.M116.770362. ЧВК 5399128. PMID 28196861.
- ^ Drazic A, Aksnes H, Marie M, Boczkowska M, Varland S, Timmerman E, Foyn H, Glomnes N, Rebowski G, Impens F, Gevaert K, Dominguez R, and Arnesen T. (2018). «NAA80 представляет собой N-концевую ацетилтрансферазу актина и регулирует сборку цитоскелета и подвижность клеток». Proc Natl Acad Sci U S A. 115 (17): 4399–4404. Дои:10.1073 / pnas.1718336115. ЧВК 5924898. PMID 29581253.
- ^ Холлебек Дж, Ван Дамм П, Геваерт К. (2012). «N-концевое ацетилирование и другие функции Nα-ацетилтрансфераз». Биол. Chem. 393 (4): 291–8. Дои:10.1515 / hsz-2011-0228. PMID 22718636.
- ^ Хершко А., Хеллер Х, Эйтан Э, Каклий Г., Роуз И.А. (1984). «Роль альфа-аминогруппы белка в убиквитин-опосредованном распаде белка». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 81 (22): 7021–5. Bibcode:1984PNAS ... 81.7021H. Дои:10.1073 / пнас.81.22.7021. ЧВК 392068. PMID 6095265.
- ^ Хван CS, Шеморри А, Варшавский А (2010). «N-концевое ацетилирование клеточных белков создает специфические сигналы деградации». Наука. 327 (5968): 973–977. Bibcode:2010Sci ... 327..973H. Дои:10.1126 / science.1183147. ЧВК 4259118. PMID 20110468.
- ^ Бехния Р., Паника Б., Уайт Дж. Р., Манро С. (2004). «Нацеливание Arf-подобной GTPase Arl3p на Golgi требует N-концевого ацетилирования и мембранного белка Sys1p». Nat. Cell Biol. 6 (5): 405–413. Дои:10.1038 / ncb1120. PMID 15077113.
- ^ Стархейм К.К., Громыко Д., Эвьент Р., Рюнинген А., Вархауг Дж. Э., Лиллехауг Дж. Р., Арнесен Т. (2009). «Нокдаун человеческого N альфа-концевого комплекса ацетилтрансферазы C приводит к p53-зависимому апоптозу и аберрантной локализации человеческого Arl8b». Мол. Клетка. Биол. 29 (13): 3569–3581. Дои:10.1128 / mcb.01909-08. ЧВК 2698767. PMID 19398576.
- ^ Громыко Д., Арнесен Т., Рюнинген А., Вархауг Дж. Э., Лиллехауг Дж. Р. (2010). «Истощение Nα-концевой ацетилтрансферазы A человека вызывает р53-зависимый апоптоз и р53-независимое ингибирование роста». Int. J. Рак. 127 (12): 2777–2789. Дои:10.1002 / ijc.25275. PMID 21351257.
- ^ Yi CH, Pan H, Seebacher J, Jang IH, Hyberts SG, Heffron GJ, Vander Heiden MG, Yang R, Li F, Locasale JW, Sharfi H, Zhai B, Rodriguez-Mias R, Luithardt H, Cantley LC, Daley GQ , Асара Дж. М., Гайги С. П., Вагнер Дж., Лю К. Ф., Юань Дж. (2011). «Метаболическая регуляция N-альфа-ацетилирования белка с помощью Bcl-xL способствует выживанию клеток». Клетка. 146 (4): 607–620. Дои:10.1016 / j.cell.2011.06.050. ЧВК 3182480. PMID 21854985.
- ^ Камита М, Кимура Й, Ино Й, Камп Р.М., Полевода Б., Шерман Ф, Хирано Х (2011). «N (α) -Ацетилирование рибосомных белков дрожжей и его влияние на синтез белка». J Proteomics. 74 (4): 431–441. Дои:10.1016 / j.jprot.2010.12.007. PMID 21184851.
- ^ Ю М, Гун Дж, Ма М, Ян Х, Лай Дж, Ву Х, Ли Л, Ли Л, Тан Д. (2009). «Иммуногистохимический анализ человека с дефектным арестом-1, экспрессируемым при раке in vivo». Онкол. Представитель. 21 (4): 909–15. Дои:10.3892 / или_00000303. PMID 19287988.
- ^ Калвик Т.В., Арнесен Т. (2013). «Белковые N-концевые ацетилтрансферазы при раке». Онкоген. 32 (3): 269–276. Дои:10.1038 / onc.2012.82. PMID 22391571.
- ^ Садоул К., Бойо С., Пабион М., Хочбин С. (2008). «Регулирование белкового обмена ацетилтрансферазами и деацетилазами». Биохимия. 90 (2): 306–12. Дои:10.1016 / j.biochi.2007.06.009. PMID 17681659.
- ^ Glozak MA, Sengupta N, Zhang X, Seto E (2005). «Ацетилирование и деацетилирование негистоновых белков». Ген. 363: 15–23. Дои:10.1016 / j.gene.2005.09.010. PMID 16289629.
- ^ Ян XJ, Сето Э (2008). «Ацетилирование лизина: кодифицированное перекрестное взаимодействие с другими посттрансляционными модификациями». Мол. Клетка. 31 (4): 449–61. Дои:10.1016 / j.molcel.2008.07.002. ЧВК 2551738. PMID 18722172.
- ^ Эдде Б., Денуле П., де Нешо Б., Кулакофф А., Бервальд-Неттер Ю., Грос Ф (1989). «Посттрансляционные модификации тубулина в культивируемых нейронах мозга мышей и астроглии». Биол. Клетка. 65 (2): 109–117. Дои:10.1016 / 0248-4900 (89) 90018-х. PMID 2736326.
- ^ Марута Х, Грир К., Розенбаум Дж. Л. (1986). «Ацетилирование альфа-тубулина и его связь со сборкой и разборкой микротрубочек». J. Cell Biol. 103 (2): 571–579. Дои:10.1083 / jcb.103.2.571. ЧВК 2113826. PMID 3733880.
- ^ Альбертс, Брюс (март 2002 г.). Молекулярная биология клетки. Наука о гирляндах. ISBN 0815332181.
- ^ Вайнберг, Роберт А. (2013). Биология рака (2-е изд.). [S.l.]: Наука о гирляндах. ISBN 978-0815342205.
- ^ Брукс С.Л., Гу В. (2011). «Влияние ацетилирования и деацетилирования на путь p53». Белковая клетка. 2 (6): 456–462. Дои:10.1007 / s13238-011-1063-9. ЧВК 3690542. PMID 21748595.
- ^ Тан И, Чжао В, Чен И, Чжао И, Гу В (2008). «Ацетилирование необходимо для активации p53». Клетка. 133 (4): 612–626. Дои:10.1016 / j.cell.2008.03.025. ЧВК 2914560. PMID 18485870.
- ^ Ямагути Х., Вудс Н.Т., Пилусо Л.Г., Ли Х.Х., Чен Дж., Бхалла К.Н., Монтейро А., Лю Х, Хунг М.С., Ван Х.Г. (2009). «Ацетилирование p53 имеет решающее значение для его проапоптотических функций, не зависящих от транскрипции». J. Biol. Chem. 284 (17): 11171–11183. Дои:10.1074 / jbc.M809268200. ЧВК 2670122. PMID 19265193.
- ^ Василев Л.Т., Ву Б.Т., Грейвс Б., Карвахал Д., Подляски Ф., Филипович З., Конг Н., Каммлотт Ю., Лукач С., Кляйн С., Фотухи Н., Лю Е.А. (2004). «Активация in vivo пути p53 низкомолекулярными антагонистами MDM2». Наука. 303 (5659): 844–848. Bibcode:2004Наука ... 303..844В. Дои:10.1126 / science.1092472. PMID 14704432.
- ^ Шангары С., Ван С. (2009). «Низкомолекулярные ингибиторы белок-белкового взаимодействия MDM2-p53 для реактивации функции p53: новый подход к терапии рака». Анну. Rev. Pharmacol. Токсикол. 49 (1): 223–241. Дои:10.1146 / annurev.pharmtox.48.113006.094723. ЧВК 2676449. PMID 18834305.
- ^ Зайкович А., Кшесняк М., Матушчик И., Гловала-Косинска М., Буткевич Д., Русин М. (2013). «Nutlin-3a, антагонист MDM2 и активатор p53, помогает сохранить репликативный потенциал раковых клеток, обработанных генотоксической дозой ресвератрола». Мол. Биол. Представитель. 40 (8): 5013–5026. Дои:10.1007 / s11033-013-2602-7. ЧВК 3723979. PMID 23666059.
- ^ Кумамото К., Спилларе Э.А., Фудзита К., Хорикава И., Ямасита Т., Аппелла Э, Нагашима М., Такеношита С., Йокота Дж., Харрис К.С. (2008). «Nutlin-3a активирует p53, подавляя ингибитор роста 2, и активируя экспрессию mir-34a, mir-34b и mir-34c, и вызывая старение». Рак Res. 68 (9): 3193–3203. Дои:10.1158 / 0008-5472.CAN-07-2780. ЧВК 2440635. PMID 18451145.
- ^ Крейс, изд. Томас; Вейл, Рональд (1999). Справочник по цитоскелетным и моторным белкам (2-е изд.). Оксфорд [u.a.]: Oxford Univ. Нажмите. ISBN 0198599560.CS1 maint: дополнительный текст: список авторов (связь)
- ^ Лодиш, Харви (2013). Молекулярная клеточная биология (7-е изд.). Нью-Йорк: W.H. Фриман и Ко. ISBN 978-1429234139.
- ^ Фоджо, отредактированный Тито (2008). Роль микротрубочек в клеточной биологии, нейробиологии и онкологии ([Online-Ausg.] Ред.). Тотова, Н. Дж .: Humana Press. ISBN 978-1588292940.CS1 maint: дополнительный текст: список авторов (связь)
- ^ а б Фридманн Д.Р., Агилар А., Фан Дж., Начуры М.В., Марморштейн Р. (2012). «Структура α-тубулинацетилтрансферазы, αTAT1 и значение для тубулин-специфического ацетилирования». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 109 (48): 19655–19660. Bibcode:2012PNAS..10919655F. Дои:10.1073 / pnas.1209357109. ЧВК 3511727. PMID 23071314.
- ^ Хабберт С., Гвардиола А., Шао Р., Кавагути Ю., Ито А., Никсон А., Йошида М., Ван XF, Яо Т.П. (2002). «HDAC6 представляет собой деацетилазу, ассоциированную с микротрубочками». Природа. 417 (6887): 455–458. Bibcode:2002Натурал.417..455Н. Дои:10.1038 / 417455a. PMID 12024216.
- ^ Тереза Карломаньо, изд. (2009). Тубулинсвязывающие агенты: синтетические, структурные и механистические идеи. вклад К.-Х. Альтманн. Берлин: Springer. ISBN 978-3540690368.
- ^ Зито, под редакцией Томаса Л. Лемке, Дэвида А. Уильямса; младшие редакторы, Виктория Ф. Рош, С. Уильям (2013). Принципы медицинской химии Фуа (7-е изд.). Филадельфия: Wolters Kluwer Health / Lippincott Williams & Wilkins. ISBN 978-1609133450.CS1 maint: дополнительный текст: список авторов (связь)
- ^ Мюллер-Декер, Фридрих Маркс, Урсула Клингмюллер, Карин (2009). Обработка клеточного сигнала: введение в молекулярные механизмы передачи сигнала. Нью-Йорк: Наука Гарланд. ISBN 978-0815342151.
- ^ Юань З.Л., Гуань Ю.Дж., Чаттерджи Д., Чин Ю.Э. (2005). «Димеризация Stat3 регулируется обратимым ацетилированием одного остатка лизина». Наука. 307 (5707): 269–273. Bibcode:2005Наука ... 307..269л. Дои:10.1126 / science.1105166. PMID 15653507.
- ^ Ли Х, Чжан П., Херрманн А., Ян С., Синь Х, Ван З., Хун Д. С., Форман С. Дж., Джов Р., Риггс А. Д., Ю Х (2012). «Ацетилированный STAT3 имеет решающее значение для метилирования промоторов гена-супрессора опухоли, а ингибирование ресвератролом приводит к деметилированию». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 109 (20): 7765–7769. Bibcode:2012PNAS..109.7765L. Дои:10.1073 / pnas.1205132109. ЧВК 3356652. PMID 22547799.
