Ацетилхолин - Википедия - Acetylcholine
Эта статья нужны дополнительные цитаты для проверка. (Август 2019 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
 | |
| Клинические данные | |
|---|---|
| Другие имена | АЧ |
| Физиологический данные | |
| Источник ткани | двигательные нейроны, парасимпатическая нервная система, мозг |
| Целевые ткани | скелетные мышцы, мозг, многие другие органы |
| Рецепторы | никотиновый, мускариновый |
| Агонисты | никотин, мускарин, ингибиторы холинэстеразы |
| Антагонисты | тубокурарин, атропин |
| Предшественник | холин, ацетил-КоА |
| Биосинтез | холинацетилтрансфераза |
| Метаболизм | ацетилхолинэстераза |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Номер E | E1001 (i) (дополнительные химикаты) |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.000.118 |
| Химические и физические данные | |
| Формула | C7ЧАС16NО2 |
| Молярная масса | 146.210 г · моль−1 |
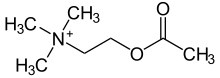
Ацетилхолин (АЧ) является органический химикат который функционирует в мозгу и теле многих видов животных (включая людей) как нейротрансмиттер - химическое сообщение, посылаемое нервными клетками для передачи сигналов другим клеткам, таким как нейроны, мышечные клетки и клетки желез.[1] Его название происходит от его химической структуры: это сложный эфир из уксусная кислота и холин. Части тела, которые используют ацетилхолин или подвергаются его воздействию, называются холинергический. Вещества, повышающие или понижающие общую активность холинергической системы, называются холинергики и холинолитики, соответственно.
Ацетилхолин - нейромедиатор, используемый в нервномышечное соединение - другими словами, это химическое вещество, двигательные нейроны высвобождения нервной системы для активации мышц. Это свойство означает, что препараты, влияющие на холинергические системы, могут иметь очень опасные эффекты, от паралича до судорог. Ацетилхолин также является нейромедиатором в автономная нервная система, как внутренний передатчик для Симпатическая нервная система и как конечный продукт, выпущенный парасимпатическая нервная система.[1] Ацетилхолин является основным нейротрансмиттером парасимпатической нервной системы.[2]
В головном мозге ацетилхолин действует как нейротрансмиттер и как нейромодулятор. В головном мозге есть несколько холинергических областей, каждая из которых выполняет свои функции; например, играет важную роль в возбуждении, внимании, памяти и мотивации.[3]
Ацетилхолин также обнаружен в клетках не нервного происхождения и микробах. Недавно выяснилось, что ферменты, связанные с его синтезом, деградацией и клеточным захватом, восходят к ранним истокам одноклеточных эукариот.[4] Протистный возбудитель Акантамеба виды показал присутствие ACh, который обеспечивает рост и пролиферативные сигналы через мембрану, расположенную гомологом M1-мускаринового рецептора.[5]
Отчасти из-за его функции активации мышц, но также из-за его функций в вегетативной нервной системе и головном мозге, многие важные лекарственные средства оказывают свое действие, изменяя холинергическую передачу. Многочисленные яды и токсины, вырабатываемые растениями, животными и бактериями, а также химические вещества. нервно-паралитические вещества Такие как Зарин, причиняют вред, инактивируя или гиперактивируя мышцы из-за своего влияния на нервно-мышечный переход. Лекарства, действующие на мускариновые рецепторы ацетилхолина, Такие как атропин, могут быть ядовитыми в больших количествах, но в меньших дозах они обычно используются для лечения определенных сердечных заболеваний и проблем с глазами. Скополамин, который действует в основном на мускариновые рецепторы в головном мозге, может вызывать бред и амнезия. Захватывающие качества никотин вытекают из его воздействия на никотиновые рецепторы ацетилхолина в мозгу.
Химия
Ацетилхолин - это молекула холина, которая была ацетилированный на кислород атом. Из-за наличия сильно полярного заряженного аммоний группа, ацетилхолин не проникает через липидные мембраны. Из-за этого, когда молекула вводится извне, она остается во внеклеточном пространстве и не проходит через гематоэнцефалический барьер.
Биохимия
Ацетилхолин синтезируется в определенных нейроны посредством фермент холинацетилтрансфераза из соединений холин и ацетил-КоА. Холинергические нейроны способны продуцировать АХ. Примером центральной холинергической области является базальное ядро Мейнерта в базальной части переднего мозга.[6][7]Фермент ацетилхолинэстераза превращает ацетилхолин в неактивный метаболиты холин и ацетат. Этот фермент в изобилии присутствует в синаптической щели, и его роль в быстром выводе свободного ацетилхолина из синапса важна для правильного функционирования мышц. Определенный нейротоксины работают, ингибируя ацетилхолинэстеразу, что приводит к избытку ацетилхолина в нервномышечное соединение, вызывая паралич мышц, необходимых для дыхания и останавливая сердцебиение.
Функции

Ацетилхолин действует как в Центральная нервная система (ЦНС) и периферическая нервная система (ПНС). В ЦНС холинергические проекции со стороны базальный передний мозг к кора головного мозга и гиппокамп поддержать познавательный функции этих целевых областей. В ПНС ацетилхолин активирует мышцы и является основным нейромедиатором вегетативной нервной системы.
Клеточные эффекты
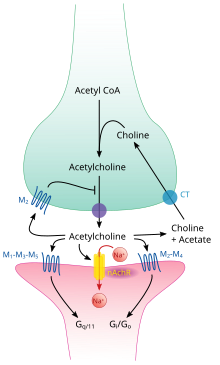
Как и многие другие биологически активные вещества, ацетилхолин проявляет свое действие путем связывания и активации рецепторы расположены на поверхности клеток. Есть два основных класса рецепторов ацетилхолина: никотиновый и мускариновый. Они названы в честь химических веществ, которые могут избирательно активировать каждый тип рецептора, не активируя другой: мускарин это соединение, содержащееся в грибах Мухомор мухомор; никотин содержится в табаке.
Никотиновые рецепторы ацетилхолина находятся ионные каналы, управляемые лигандами проницаемый для натрий, калий, и кальций ионы. Другими словами, они представляют собой ионные каналы, встроенные в клеточные мембраны, способные переключаться из закрытого в открытое состояние, когда с ними связывается ацетилхолин; в открытом состоянии они пропускают ионы. Никотиновые рецепторы бывают двух основных типов, известных как мышечный тип и нейронный тип. Тип мышц может быть выборочно заблокирован кураре, нейронный тип гексаметоний. Основное расположение рецепторов мышечного типа - на мышечных клетках, как более подробно описано ниже. Рецепторы нейронального типа расположены в вегетативных ганглиях (симпатических и парасимпатических) и в центральной нервной системе.
Мускариновые рецепторы ацетилхолина имеют более сложный механизм и влияют на клетки-мишени в течение более длительного периода времени. У млекопитающих идентифицировано пять подтипов мускариновых рецепторов, обозначенных с M1 по M5. Все они функционируют как G-белковые рецепторы, что означает, что они оказывают свое влияние через вторая система обмена сообщениями. Подтипы M1, M3 и M5: граммq -сопряженный; они увеличивают внутриклеточные уровни IP3 и кальций путем активации фосфолипаза C. Их действие на клетки-мишени обычно возбуждающее. Подтипы M2 и M4: граммя/ГРАММо -сопряженный; они снижают внутриклеточные уровни лагерь подавляя аденилатциклаза. Их действие на клетки-мишени обычно тормозящее. Мускариновые рецепторы ацетилхолина обнаруживаются как в центральной нервной системе, так и в периферической нервной системе сердца, легких, верхних отделах желудочно-кишечного тракта и потовых железах.
Нервномышечное соединение
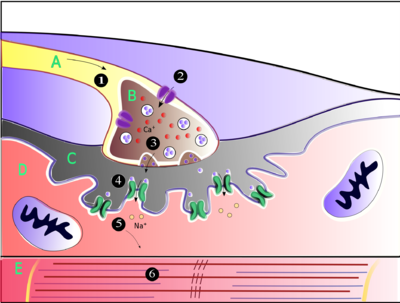
Ацетилхолин - это вещество, которое нервная система использует для активации скелетные мышцы, разновидность поперечно-полосатой мышцы. Эти мышцы используются для всех типов произвольных движений, в отличие от гладкая мышечная ткань, который участвует в ряде непроизвольных действий, таких как перемещение пищи по желудочно-кишечному тракту и сужение кровеносных сосудов. Скелетные мышцы напрямую контролируются двигательные нейроны расположен в спинной мозг или, в некоторых случаях, мозговой ствол. Эти мотонейроны посылают свои аксоны через двигательные нервы, из которых они выходят, чтобы соединиться с мышечными волокнами в особом типе синапс называется нервномышечное соединение.
Когда двигательный нейрон генерирует потенциал действия, он быстро перемещается по нерву, пока не достигает нервно-мышечного соединения, где запускает электрохимический процесс, вызывающий выброс ацетилхолина в пространство между пресинаптическим окончанием и мышечным волокном. Затем молекулы ацетилхолина связываются с рецепторами никотиновых ионных каналов на мембране мышечной клетки, в результате чего ионные каналы открываются. Затем ионы натрия поступают в мышечную клетку, инициируя последовательность шагов, которые в конечном итоге производят сокращение мышц.
Факторы, которые уменьшают высвобождение ацетилхолина (и тем самым влияют на Кальциевые каналы P-типа ):[8]
1) Антибиотики (клиндамицин, полимиксин )
2) Магний: противодействует кальциевым каналам P-типа.
4) Противосудорожные препараты
6) Синдром Итона-Ламберта: подавляет кальциевые каналы P-типа
7) Ботулинический токсин: ингибирует белки SNARE
Блокаторы кальциевых каналов (нифедипин, дилтиазем) не влияют на Р-каналы. Эти препараты влияют на Кальциевые каналы L-типа.
Автономная нервная система
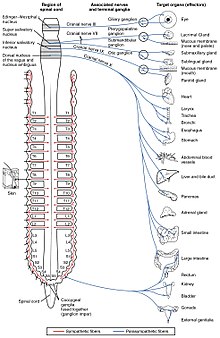
В автономная нервная система контролирует широкий спектр непроизвольных и бессознательных функций организма. Его основными ветвями являются Симпатическая нервная система и парасимпатическая нервная система. Вообще говоря, функция симпатической нервной системы состоит в мобилизации организма к действию; фраза, которую часто используют для его описания, бой или полет. Функция парасимпатической нервной системы состоит в том, чтобы привести тело в состояние, способствующее отдыху, регенерации, пищеварению и размножению; фраза, которую часто используют для описания, это «отдыхать и переваривать пищу» или «кормить и размножаться». Обе вышеупомянутые системы используют ацетилхолин, но по-разному.
На схематическом уровне симпатическая и парасимпатическая нервные системы организованы по существу одинаковым образом: преганглионарные нейроны в центральной нервной системе посылают проекции на нейроны, расположенные в вегетативных ганглиях, которые посылают выходные проекции практически во все ткани тела. В обеих ветвях внутренние связи, выступающие из центральной нервной системы в вегетативные ганглии, используют ацетилхолин в качестве нейромедиатора для иннервации (или возбуждения) нейронов ганглиев. В парасимпатической нервной системе выходные соединения, проекции нейронов ганглиев на ткани, не принадлежащие нервной системе, также выделяют ацетилхолин, но действуют на мускариновые рецепторы. В симпатической нервной системе выходные связи в основном освобождают норадреналин, хотя ацетилхолин выделяется в нескольких точках, таких как судомотор иннервация потовых желез.
Прямые сосудистые эффекты
Ацетилхолин в сыворотка оказывает прямое влияние на сосудистый тонус путем привязки к мускариновые рецепторы присутствует на сосудистых эндотелий. Эти клетки реагируют увеличением производства оксид азота, который дает сигнал окружающим гладким мышцам расслабиться, что приводит к расширение сосудов.[9]
Центральная нервная система
В центральной нервной системе ACh по-разному влияет на пластичность, возбуждение и награда. ACh играет важную роль в повышении бдительности, когда мы просыпаемся,[10] в поддержании внимания [11] и в обучении и памяти.[12]
Было показано, что повреждение холинергической (производящей ацетилхолин) системы в головном мозге связано с дефицитом памяти, связанным с Болезнь Альцгеймера.[13] Также было показано, что ACh способствует REM спать.[14]
В стволе мозга ацетилхолин происходит из Цветоножковое ядро и латеродорсальное тегментальное ядро под общим названием мезоpontine tegmentum зона или понтомезэнцефалотегментарный комплекс.[15][16] В базальном переднем мозге он берет начало от базальное ядро Мейнерта и медиальный септальное ядро:
- В понтомезэнцефалотегментарный комплекс действует в основном на Рецепторы M1 в мозговой ствол, глубокий ядра мозжечка, понтинные ядра, голубое пятно, ядро шва, латеральное ретикулярное ядро и низшая оливковая.[16] Он также направлен на таламус, тектум, базальный ганглий и базальный передний мозг.[15]
- Базальное ядро Мейнерта действует в основном на Рецепторы M1 в неокортекс.
- Медиальный септальное ядро действует в основном на Рецепторы M1 в гиппокамп и части кора головного мозга.
Кроме того, ACh действует как важный внутренний передатчик в полосатое тело, который является частью базальный ганглий. Он выпущен холинергическим интернейроны. У людей, нечеловеческих приматов и грызунов эти интернейроны реагируют на заметные раздражители окружающей среды реакциями, которые во времени совпадают с реакциями дофаминергических нейронов мозга. черная субстанция.[17][18]
объем памяти
Ацетилхолин участвует в учусь и объем памяти несколькими способами. Холинолитический препарат, скополамин, ухудшает усвоение новой информации людьми[19] и животные.[12] У животных нарушение поступления ацетилхолина в неокортекс затрудняет усвоение простых задач распознавания, сравнимых с получением фактической информации[20] и нарушение подачи ацетилхолина в гиппокамп и смежные области коры вызывают забывчивость, сравнимую с антероградная амнезия в людях.[21]
Заболевания и расстройства
Миастения
Болезнь миастения, характеризующийся мышечной слабостью и утомляемостью, возникает, когда организм неправильно производит антитела против никотиновых рецепторов ацетилхолина и, таким образом, подавляет передачу надлежащего сигнала ацетилхолина. Со временем торцевая пластина двигателя разрушается. Лекарства, которые конкурентно ингибируют ацетилхолинэстеразу (например, неостигмин, физостигмин или, прежде всего, пиридостигмин), эффективны при лечении этого расстройства. Они позволяют эндогенно высвободившемуся ацетилхолину больше времени для взаимодействия с соответствующим рецептором, прежде чем он будет инактивирован ацетилхолинэстеразой в синаптической щели (пространство между нервом и мышцей).
Фармакология
Блокирование, сдерживание или имитация действия ацетилхолина имеет множество применений в медицине. Лекарства, действующие на ацетилхолиновую систему, являются либо агонистами рецепторов, стимулируя систему, либо антагонистами, подавляющими ее. Агонисты и антагонисты ацетилхолиновых рецепторов могут либо оказывать действие непосредственно на рецепторы, либо оказывать свое действие косвенно, например, воздействуя на фермент. ацетилхолинэстераза, который разрушает лиганд рецептора. Агонисты повышают уровень активации рецепторов, антагонисты снижают.
Сам по себе ацетилхолин не имеет терапевтического значения в качестве лекарства для внутривенного введения из-за его многогранного действия (неселективного) и быстрой инактивации холинэстеразой. Тем не менее, он используется в форме глазных капель, чтобы вызвать сужение зрачка во время операции по удалению катаракты, что способствует быстрому послеоперационному восстановлению.
Никотиновые рецепторы
Никотин связывается и активирует никотиновые рецепторы ацетилхолина, имитируя действие ацетилхолина на эти рецепторы. Когда ACh взаимодействует с никотиновым рецептором ACh, он открывает Na+ канал и Na+ ионы попадают в мембрану. Это вызывает деполяризацию и приводит к возникновению возбуждающего постсинаптического потенциала. Таким образом, АХ возбуждает скелетные мышцы; электрический отклик быстрый и непродолжительный. Курарес представляют собой яды со стрелами, которые действуют на никотиновые рецепторы и использовались для разработки клинически полезных методов лечения.
Мускариновые рецепторы
Атропин является неселективным конкурентным антагонистом ацетилхолина мускариновых рецепторов.
Ингибиторы холинэстеразы
Многие агонисты рецепторов ACh действуют косвенно, ингибируя фермент. ацетилхолинэстераза. В результате накопление ацетилхолина вызывает постоянную стимуляцию мышц, желез и центральной нервной системы, что может привести к фатальным судорогам, если доза будет высокой.
Они примеры ингибиторы ферментов, и увеличить действие ацетилхолина, задерживая его распад; некоторые использовались как нервно-паралитические вещества (Зарин и VX нервно-паралитический газ) или пестициды (органофосфаты и карбаматы ). Многие токсины и яды, вырабатываемые растениями и животными, также содержат ингибиторы холинэстеразы. В клинической практике они вводятся в низких дозах, чтобы обратить действие миорелаксанты, лечить миастения, и для лечения симптомов Болезнь Альцгеймера (ривастигмин, который увеличивает холинергическую активность в головном мозге).
Ингибиторы синтеза
Органический ртутный соединения, такие как метилртуть, имеют большое сходство с сульфгидрильные группы, вызывающий дисфункцию фермента холинацетилтрансферазы. Это ингибирование может привести к дефициту ацетилхолина и может иметь последствия для двигательной функции.
Ингибиторы высвобождения
Ботулинический токсин (Ботокс) действует, подавляя высвобождение ацетилхолина, в то время как яд из черная вдова паук (альфа-латротоксин ) имеет обратный эффект. Причины торможения АХ паралич. Когда укусил черная вдова паук, человек испытывает потерю запасов ACh, и мышцы начинают сокращаться. Если и когда запасы истощены, паралич происходит.
Сравнительная биология и эволюция
Ацетилхолин используется организмами во всех сферах жизни для различных целей. Считается, что холин, предшественник ацетилхолина, использовался одноклеточными организмами миллиарды лет назад.[нужна цитата ] для синтеза фосфолипидов клеточных мембран.[22] После эволюции переносчиков холина обилие внутриклеточного холина открыло путь для включения холина в другие пути синтеза, включая производство ацетилхолина. Ацетилхолин используется бактериями, грибами и множеством других животных. Многие из применений ацетилхолина зависят от его действия на ионные каналы через GPCR, такие как мембранные белки.
Два основных типа рецепторов ацетилхолина, мускариновые и никотиновые рецепторы, конвергентно эволюционировали, чтобы реагировать на ацетилхолин. Это означает, что эти рецепторы произошли не от общего гомолога, а от отдельных семейств рецепторов. Считается, что семейство никотиновых рецепторов существует более 2,5 миллиардов лет.[22] Точно так же считается, что мускариновые рецепторы отделились от других GPCR по крайней мере 0,5 миллиарда лет назад. Обе эти группы рецепторов развили множество подтипов с уникальным сродством к лигандам и механизмами передачи сигналов. Разнообразие типов рецепторов позволяет ацетилхолину создавать различные ответы в зависимости от того, какие типы рецепторов активированы, и позволяет ацетилхолину динамически регулировать физиологические процессы.
История
В 1867 г. Адольф фон Байер разрешил структуры холин и ацетилхолин и синтезировал их оба, указав на последний как "ацетилнейрин" В исследовании.[23][24] Холин является предшественником ацетилхолина. Вот почему Фредерик Уокер Мотт и Уильям Добинсон Халлибертон в 1899 году заметил, что инъекции холина снижали кровяное давление животных.[25][24] Ацетилхолин был впервые отмечен как биологически активный в 1906 году, когда Рид Хант (1870–1948) и Рене де М. Таво обнаружил, что это уменьшилось артериальное давление в исключительно крошечных дозах.[26][24][27]
В 1914 г. Артур Дж. Юинс был первым, кто извлек из природы ацетилхолин. Он определил это как загрязняющее вещество, снижающее кровяное давление, от некоторых Claviceps purpurea спорынья выписки, по запросу Генри Халлетт Дейл.[24] Позже, в 1914 году, Дейл обрисовал влияние ацетилхолина на различные типы периферических синапсов, а также отметил, что он снижает кровяное давление у кошек посредством подкожные инъекции даже при дозах одного нанограмм.[28][24]
Концепция нейротрансмиттеры был неизвестен до 1921 г., когда Отто Леви отметил, что блуждающий нерв выделял вещество, которое стимулировало сердечная мышца работая профессором в Университет Граца. Он назвал это Vagusstoff («вещество блуждающего нерва»), отметил, что это структурный аналог холина и подозревали, что это ацетилхолин.[29][30] В 1926 году Леви и Э. Навратил пришли к выводу, что соединение, вероятно, представляет собой ацетилхолин, поскольку вагусстоф и синтетический ацетилхолин теряли свою активность аналогичным образом при контакте с тканями. лизаты содержащие ферменты, расщепляющие ацетилхолин (ныне известные как холинэстеразы ).[31][32] Этот вывод получил широкое признание. Более поздние исследования подтвердили функцию ацетилхолина как нейромедиатора.[30]
В 1936 г. Х. Х. Дейл и О. Лоуи разделили Нобелевская премия по физиологии и медицине за их исследования ацетилхолина и нервных импульсов.[24]
Смотрите также
Рекомендации
- ^ а б Тивари П., Двиведи С., Сингх МП, Мишра Р., Чанди А. (октябрь 2012 г.). «Основные и современные представления о холинергических рецепторах: обзор». Азиатско-Тихоокеанский журнал тропических болезней. 3 (5): 413–420. Дои:10.1016 / S2222-1808 (13) 60094-8. ЧВК 4027320.
- ^ Лотт Э.Л., Джонс Э.Б. (июнь 2019 г.). «Холинергическая токсичность». PMID 30969605. Цитировать журнал требует
| журнал =(помощь) - ^ Капалка, Джордж М. (2010). «Вещества, участвующие в нейротрансмиссии». Лечебное питание и лечение травами для детей и подростков. Эльзевир. стр.71 –99. Дои:10.1016 / b978-0-12-374927-7.00004-2. ISBN 978-0-12-374927-7.
- ^ Баиг А.М., Рана З., Тарик С., Лалани С., Ахмад Х.Р. (март 2018 г.). «На временной шкале: открытие ацетилхолина и компонентов холинергической системы человека в примитивных одноклеточных эукариотах Acanthamoeba spp». ACS Chem Neurosci. 9 (3): 494–504. Дои:10.1021 / acschemneuro.7b00254. PMID 29058403.
- ^ Баиг А.М., Ахмад HR (июнь 2017 г.). «Доказательства гомолога M1-мускариновой GPCR в одноклеточных эукариотах: 3D-моделирование и эксперименты с биоинформатикой Acanthamoeba spp». J. Recept. Сигнал Transduct. Res. 37 (3): 267–275. Дои:10.1080/10799893.2016.1217884. PMID 27601178. S2CID 5234123.
- ^ Смитис Дж (2009). «Философия, восприятие и нейробиология». Восприятие. 38 (5): 638–51. Дои:10.1068 / стр. 6025. PMID 19662940. S2CID 45579740.
- ^ Смитис Дж, д'Орей де Лантреманж М (2016). «Природа и функции механизмов сжатия цифровой информации в мозгу и в технологиях цифрового телевидения». Front Syst Neurosci. 10: 40. Дои:10.3389 / fnsys.2016.00040. ЧВК 4858531. PMID 27199688.
- ^ Миллер Р.Д., Эрикссон Л.И., Флейшер Л.А., Винер-Крониш Ю.П., Янг В.Л., ред. (2009-01-01). Анестезия Миллера (7-е изд.). Elsevier Health Sciences. С. 343–47. ISBN 978-0-443-06959-8.
- ^ Kellogg DL, Zhao JL, Coey U, Green JV (февраль 2005 г.). «Вызванная ацетилхолином вазодилатация опосредуется оксидом азота и простагландинами в коже человека». J. Appl. Физиол. 98 (2): 629–32. Дои:10.1152 / japplphysiol.00728.2004. PMID 15649880.
- ^ Джонс БЭ (ноябрь 2005 г.). «От бодрствования до сна: нейрональные и химические субстраты». Trends Pharmacol. Наука. 26 (11): 578–86. Дои:10.1016 / j.tips.2005.09.009. PMID 16183137.
- ^ Химмельхебер А.М., Сартер М., Бруно Дж. П. (июнь 2000 г.). «Повышение высвобождения кортикального ацетилхолина при устойчивом внимании у крыс». Brain Res Cogn Brain Res. 9 (3): 313–25. Дои:10.1016 / S0926-6410 (00) 00012-4. PMID 10808142.
- ^ а б Ридли RM, Bowes PM, Baker HF, Crow TJ (1984). «Участие ацетилхолина в обучении распознаванию объектов и памяти у мартышек». Нейропсихология. 22 (3): 253–63. Дои:10.1016/0028-3932(84)90073-3. PMID 6431311. S2CID 7110504.
- ^ Фрэнсис П. Т., Палмер А. М., Снейп М., Уилкок Г. К. (февраль 1999 г.). «Холинергическая гипотеза болезни Альцгеймера: обзор прогресса». J. Neurol. Нейрохирургия. Психиатрия. 66 (2): 137–47. Дои:10.1136 / jnnp.66.2.137. ЧВК 1736202. PMID 10071091.
- ^ Платт Б., Ридель Г. (август 2011 г.). «Холинергическая система, ЭЭГ и сон». Behav. Мозг Res. 221 (2): 499–504. Дои:10.1016 / j.bbr.2011.01.017. PMID 21238497. S2CID 25323695.
- ^ а б Вульф, штат Нью-Джерси, Мясник, LL (май 1986 г.). «Холинергические системы в головном мозге крысы: III. Проекции от понтомезэнцефалической покрышки до таламуса, тектума, базальных ганглиев и базального переднего мозга». Brain Res. Бык. 16 (5): 603–37. Дои:10.1016/0361-9230(86)90134-6. PMID 3742247. S2CID 39665815.
- ^ а б Вульф, штат Нью-Джерси, Мясник, LL (декабрь 1989 г.). «Холинергические системы в головном мозге крыс: IV. Нисходящие проекции понтомезэнцефалического покрышки». Brain Res. Бык. 23 (6): 519–40. Дои:10.1016/0361-9230(89)90197-4. PMID 2611694. S2CID 4721282.
- ^ Гольдберг Дж. А., Рейнольдс Дж. Н. (декабрь 2011 г.). «Спонтанное возбуждение и вызванные паузы в тонически активных холинергических интернейронах полосатого тела». Неврология. 198: 27–43. Дои:10.1016 / j.neuroscience.2011.08.067. PMID 21925242. S2CID 21908514.
- ^ Моррис Г., Аркадир Д., Невет А., Ваадиа Е., Бергман Н. (июль 2004 г.). «Совпадающие, но разные сообщения дофамина среднего мозга и тонически активных нейронов полосатого тела». Нейрон. 43 (1): 133–43. Дои:10.1016 / j.neuron.2004.06.012. PMID 15233923.
- ^ Crow TJ, Grove-White IG (октябрь 1973 г.). «Анализ дефицита обучения после введения гиосцина человеку». Br. J. Pharmacol. 49 (2): 322–7. Дои:10.1111 / j.1476-5381.1973.tb08379.x. ЧВК 1776392. PMID 4793334.
- ^ Ридли Р.М., Мюррей Т.К., Джонсон Дж. А., Бейкер Х. Ф. (июнь 1986 г.). «Нарушение обучаемости после поражения базального ядра Мейнерта у мартышек: модификация холинергическими препаратами». Мозг Res. 376 (1): 108–16. Дои:10.1016/0006-8993(86)90904-2. PMID 3087582. S2CID 29182517.
- ^ Истон А., Ридли Р.М., Бейкер Х.Ф., Гаффан Д. (июль 2002 г.). «Односторонние поражения холинергических базальных частей переднего мозга и свода в одном полушарии и нижней височной коры в противоположном полушарии вызывают серьезные нарушения обучения у макак-резусов». Цереб. Кора. 12 (7): 729–36. Дои:10.1093 / cercor / 12.7.729. PMID 12050084.
- ^ а б Дин Б. (ноябрь 2009 г.). «Эволюция холинерической системы ЦНС человека: привело ли это к возникновению психических заболеваний?». Aust N Z J Психиатрия. 43 (11): 1016–28. Дои:10.3109/00048670903270431. PMID 20001397. S2CID 31059344.
- ^ Байер А. (1867 г.). "I. Üeber das neinin". Юстус Либигс Энн Хем (на немецком). 142 (3): 322–326. Дои:10.1002 / jlac.18671420311.
- ^ а б c d е ж Кавасима К., Фуджи Т., Мориваки Ю., Мисава Х., Хоригучи К. (2015). «Ненейрональная холинергическая система в регуляции иммунной функции с акцентом на α7 nAChR». Международная иммунофармакология. 29 (1): 127–34. Дои:10.1016 / j.intimp.2015.04.015. PMID 25907239.
- ^ Мотт FW, Halliburton WD (1899). «VII. Физиологическое действие холина и нейрина». Философские труды Лондонского королевского общества. Серия B, содержащая документы биологического характера. 191 (2001): 211–267. Дои:10.1098 / рстб.1899.0007. ЧВК 2463419. PMID 20758460.
- ^ Хант Р., Таво М. (1906). «О физиологическом действии некоторых производных холина и новых методах определения холина». BMJ. 2: 1788–1791.
- ^ Доркинс HR (апрель 1982 г.). «Суксаметоний - разработка современного лекарства с 1906 года до наших дней». История болезни. 26 (2): 145–68. Дои:10.1017 / s0025727300041132. ЧВК 1139149. PMID 7047939.
- ^ Дейл HH (1914). «Действие некоторых сложных и простых эфиров холина и их связь с мускарином». J Pharmacol Exp Ther. 6 (2): 147–190.
- ^ Лоуи О. (1922). "Über humorale übertragbarkeit der herznervenwirkung". Pflug Arch Ges Phys (на немецком). 193 (1): 201–213. Дои:10.1007 / BF02331588. S2CID 34861770.
- ^ а б Цейзель Ш. (2012). «Краткая история холина». Анналы питания и метаболизма. 61 (3): 254–8. Дои:10.1159/000343120. ЧВК 4422379. PMID 23183298.
- ^ Лоуи О., Навратил Э (1926). "Über humorale übertragbarkeit der herznervenwirkung". Pflug Arch Ges Phys (на немецком). 214 (1): 678–688. Дои:10.1007 / BF01741946. S2CID 43748121.
- ^ Zimmer HG (март 2006 г.). «Отто Леви и химическая передача стимуляции блуждающего нерва в сердце». Клиническая кардиология. 29 (3): 135–6. Дои:10.1002 / clc.4960290313. ЧВК 6654523. PMID 16596840.
Библиография
- Бреннер GM, Стивенс CW (2006). Фармакология (2-е изд.). Филадельфия, Пенсильвания: W.B. Сондерс. ISBN 1-4160-2984-2.
- Канадская ассоциация фармацевтов (2000). Сборник фармацевтических препаратов и специальностей (25-е изд.). Торонто ON: Webcom. ISBN 0-919115-76-4.
- Карлсон Н.Р. (2001). Физиология поведения (7-е изд.). Needham Heights MA: Аллин и Бэкон. ISBN 0-205-30840-6.
- Гершон, доктор медицины (1998). Второй мозг. Нью-Йорк, штат Нью-Йорк: HarperCollins. ISBN 0-06-018252-0.
- Сигал А., Сапру Х.Н. (2006). "Глава 15". Essential Neuroscience (Пересмотренное 1-е изд.). Филадельфия: Липпинкотт, Уильямс и Уилкинс. стр.255–267.
- Хассельмо МЭ (Февраль 1995 г.). «Нейромодуляция и корковые функции: моделирование физиологических основ поведения». Behav. Мозг Res. 67 (1): 1–27. Дои:10.1016 / 0166-4328 (94) 00113-Т. PMID 7748496. S2CID 17594590. как PDF
- Ю AJ, Даян П (Май 2005 г.). «Неуверенность, нейромодуляция и внимание». Нейрон. 46 (4): 681–92. Дои:10.1016 / j.neuron.2005.04.026. PMID 15944135. S2CID 15980355. как PDF
