Нейростероид - Википедия - Neurosteroid
Нейростероиды, также известный как нейроактивные стероиды, находятся эндогенный или экзогенный стероиды которые быстро меняются нейронный возбудимость через взаимодействие с ионные каналы, управляемые лигандами и другие рецепторы клеточной поверхности.[1][2] Период, термин нейростероид был придуман французами физиолог Этьен-Эмиль Больё и относится к стероидам, синтезируемым в головном мозге.[3][4] Период, термин, нейроактивный стероид относится к стероидам, которые могут синтезироваться в головном мозге или синтезироваться эндокринная железа, которые затем попадают в мозг через кровоток и влияют на функции мозга.[5] Термин нейроактивные стероиды впервые был придуман в 1992 году Стивеном Полом и Робертом Парди. В дополнение к их действию на рецепторы мембран нейронов, некоторые из этих стероидов могут также оказывать влияние на экспрессия гена через ядерный рецепторы стероидных гормонов. Нейростероиды имеют широкий спектр потенциальных клинических применений из седация к лечению эпилепсия[6] и травматическое повреждение мозга.[7][8] Ганаксолон, синтетический аналог эндогенного нейростероида аллопрегнанолон, находится под следствием для лечения эпилепсии.[9]
Классификация
Основываясь на различиях в Мероприятия и структура, нейростероиды можно в общих чертах разделить на несколько основных групп.[3]
Тормозящие нейростероиды
Эти нейростероиды оказывают тормозящий действия на нейротрансмиссия. Они действуют как положительные аллостерические модуляторы из ГАМКА рецептор (особенно субъединица δ -содержащий изоформы ) и обладают, в произвольном порядке, антидепрессант, анксиолитик, снятие стресса, награждение,[10] просоциальный,[11] антиагрессивный,[12] прозексуальный,[11] успокаивающее, про сон,[13] познавательный и нарушающий память,[нужна цитата ] обезболивающее,[14] анестетик, противосудорожное средство, нейропротекторный, и нейрогенный последствия.[3]
Основные примеры включают тетрагидродезоксикортикостерон (THDOC), андростан 3α-андростандиол, то холестан холестерин и беременные прегнанолон (элтанолон), аллопрегнанолон (3α, 5α-THP).[15][16]
Возбуждающие нейростероиды
Эти нейростероиды имеют возбуждающий эффекты на нейротрансмиссию. Они действуют как мощные отрицательные аллостерические модуляторы ГАМКА рецептора, слабоположительные аллостерические модуляторы Рецептор NMDA, и / или агонисты из σ1 рецептор, и в основном антидепрессант, анксиогенный, познавательный и улучшающий память, судорожный, нейропротекторный, и нейрогенный последствия.[3]
Основные примеры включают прегнаны прегненолона сульфат (PS), эпипрегнанолон, и изопрегнанолон (сепранолон), андростаны дегидроэпиандростерон (ДГЭА; прастерон ), и дегидроэпиандростерона сульфат (DHEA-S; сульфат прастерона ), а холестан 24(S) -гидроксихолестерин (Селективный к рецепторам NMDA; очень мощный).[17]
Феромоны
Феромоны - это нейростероиды, которые влияют на деятельность мозга, в частности гипоталамический функция, через активацию вомероназальный рецептор клетки.[18][19][20]
В их состав входят андростаны андростадиенол, андростадиенон, андростенол, и андростенон и эстран эстратетраенол.
Другие нейростероиды
Некоторые другие эндогенные стероиды, такие как прегненолон,[21] прогестерон,[22][23] эстрадиол,[5] и кортикостерон также нейростероиды. Однако, в отличие от перечисленных выше, эти нейростероиды не модулируют ГАМК.А или рецепторы NMDA, и вместо этого воздействуют на различные другие рецепторы клеточной поверхности и негеномные мишени. Также многие эндогенные стероиды, включая прегненолон, прогестерон, кортикостерон, дезоксикортикостерон, DHEA и тестостерон, находятся метаболизируется в (другие) нейростероиды, эффективно функционирующие как так называемые профинейростероиды.
Биосинтез
Нейростероиды синтезируются из холестерин, который превращается в прегненолон, а затем во все другие эндогенные стероиды. Нейростероиды продуцируются в головном мозге после местного синтеза или преобразования стероидов надпочечников периферического происхождения или гонадных стероидов. Они накапливаются, в частности, в миелинизирующих глиальных клетках из холестерина или предшественников стероидов, импортируемых из периферических источников.[24][25] 5α-редуктаза I типа и 3α-гидроксистероид дегидрогеназа участвуют в биосинтезе тормозных нейростероидов, а 3β-гидроксистероид дегидрогеназа и гидроксистероидные сульфотрансферазы участвуют в производстве возбуждающих нейростероидов.[3]
Функция
Некоторые крупные известные биологические функции нейростероидов включают модуляцию нейронная пластичность,[26] учусь и объем памяти процессы,[27] поведение,[28][29] и предрасположенность к приступам,[30] а также ответы на стресс, беспокойство, и депрессия.[11][31] Нейростероиды также играют важную роль в различных сексуально-диморфный поведение и эмоциональные реакции.[29]
Острый стресс повышает уровни ингибирующих нейростероидов, таких как аллопрегнанолон, и эти нейростероиды, как известно, противодействуют многим эффектам стресса.[32] Это похоже на случай эндорфины, которые высвобождаются в ответ на стресс и физическую боль и противодействуют негативным субъективным эффектам таких состояний. Таким образом, было высказано предположение, что одна из биологических функций этих нейромодуляторы может помочь сохранить эмоциональную гомеостаз.[28][33] Хронический стресс был связан с пониженным уровнем аллопрегнанолона и изменением стрессовой реакции аллопрегнанолона, психические расстройства, и гипоталамо-гипофизарно-надпочечниковая система нарушение регуляции.[31][32]
Считается, что колебания уровней тормозящих нейростероидов во время менструальный цикл и беременность играют важную роль в различных Женский условия, включая предменструальный синдром (ПМС), предменструальное дисфорическое расстройство (PMDD), послеродовая депрессия (PPD), послеродовой психоз, и менструальная эпилепсия.[34][35][36] Кроме того, считается, что изменения уровня нейростероидов могут быть связаны с изменениями настроения, тревожности и сексуального желания, которые происходят во время половое созревание у обоих полов и во время менопауза у женщин.[3][37][38]
Повышенные уровни ингибирующих нейростероидов, а именно аллопрегнанолона, могут вызывать парадоксальные эффекты, такие как отрицательное настроение, беспокойство, раздражительность, и агрессия.[39][40][41][42] По всей видимости, это связано с тем, что эти нейростероиды, как и другие положительные аллостерические модуляторы ГАМКА рецептор, такой как бензодиазепины, барбитураты, и этиловый спирт,[34][42] обладают двухфазным U-образным действием - умеренные уровни (в диапазоне 1,5–2 нМ / л общего аллопрогестерона, что примерно эквивалентно лютеиновой фазы уровни) подавляют активность ГАМКА рецептора, в то время как более низкие и более высокие концентрации способствуют активности рецептора.[40][41]
Биологическая активность
Рецептор сигма-1
| Сложный | Kя (нМ) | Действие | Разновидность | Ссылка |
|---|---|---|---|---|
| Прогестерон | 268 | Антагонист | морская свинка | [44][45] |
| Дезоксикортикостерон | 938 | Неизвестный | морская свинка | [44][45] |
| Тестостерон | 1,014 | Неизвестный | морская свинка | [44][45] |
| Прегненолон | ND | Агонист | ND | ND |
| Прегненолона сульфат | 3,198 | Агонист | морская свинка | [44][45] |
| DHEA | 3,700 | Агонист | ? | [45] |
| DHEA-S | ND | Агонист | ND | ND |
| Кортикостерон | 4,074 | Неизвестный | морская свинка | [44] |
Терапевтические приложения
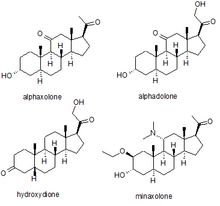
Анестезия
Несколько синтетических нейростероидов были использованы в качестве успокаивающие с целью общая анестезия для проведения хирургических вмешательств. Самыми известными из них являются альфаксолон, альфадолон, гидроксидион, и минаксолон. Первым из них был введен гидроксидион, который представляет собой этерифицированное 21-гидроксипроизводное 5β-прегнандиона. Гидроксидион оказался полезным анестезирующим препаратом с хорошим профилем безопасности, но при инъекции он был болезненным и раздражающим, вероятно, из-за плохой растворимости в воде. Это привело к разработке новых нейроактивных стероидов. Следующим на рынке лекарством из этого семейства была смесь альфаксолона и альфадолона, известная как Альтезин. Он был исключен из использования людьми из-за редких, но серьезных токсических реакций, но все еще используется в Ветеринария. Следующим нейростероидным анестетиком, введенным в медицину человека, был новый препарат минаксолон, который примерно в три раза более эффективен, чем альтезин, и сохраняет благоприятный профиль безопасности без проблем с токсичностью, характерных для альтезина. Однако это лекарство также было в конечном итоге прекращено, но не из-за проблем с клиническим использованием, а потому, что исследования на животных предполагали потенциальную канцерогенность и поскольку были доступны альтернативные препараты, было сочтено, что возможный риск перевешивает выгоду от сохранения препарата на рынке.
Ганаксолон

Нейростероид ганаксолон, аналог аллопрегнанолона, метаболита прогестерона, широко исследовался на животных моделях и в настоящее время проходит клинические испытания для лечения эпилепсия. Нейростероиды, включая ганаксолон, обладают широким спектром активности на животных моделях.[46] Они могут иметь преимущества перед другими ГАМК.А модуляторы рецепторов, особенно бензодиазепины, с такой толерантностью, по-видимому, не возникают при длительном применении.[47][48]
Рандомизированное плацебо-контролируемое 10-недельное клиническое испытание фазы 2 перорального приема ганаксолона у взрослых с частичным началом приступа продемонстрировало, что лечение является безопасным, хорошо переносимым и эффективным.[9] Препарат продолжал демонстрировать эффективность в течение 104 недель открытого исследования. Данные доклинических исследований показывают, что ганаксолон может иметь низкий риск для использования во время беременности. Помимо использования при лечении эпилепсии, препарат может применяться при лечении широкого спектра неврологических и психиатрических состояний. В настоящее время проводятся подтверждающие исследования посттравматического стрессового расстройства и синдрома ломкой Х-хромосомы.
Менструальная эпилепсия
Исследователи предложили использовать так называемую «заместительную нейростероидную терапию» в качестве способа лечения менструальная эпилепсия с нейроактивными стероидами, такими как ганаксолон, в период менструальный цикл когда захват частота увеличивается.[6] Микронизированный прогестерон, который надежно ведет себя как пролекарство аналогично аллопрегнанолону, был предложен для лечения менструальной эпилепсии аналогичным образом.[49]
Аллопрегнанолон
Аллопрегнанолон (SAGE-547) находится в стадии разработки в качестве внутривенная терапия для лечения сверхрефрактерный эпилептический статус, послеродовая депрессия, и эссенциальный тремор.[50][51]
Другие приложения
4,16-Андростадиен-3β-ол (PH94B, Aloradine) - синтетический феромон, или ферин, нейростероид, который исследуется для лечения тревожные расстройства у женщин.[19][20][52]
3β-метоксипрегненолон (MAP-4343), или 3β-метиловый эфир прегненолона, представляет собой синтетический нейроактивный стероид и производное прегненолона, которое взаимодействует с белок, связанный с микротрубочками 2 (MAP2) аналогично прегненолону и находится в стадии разработки для потенциального клинического использования по показаниям, таким как лечение мозг и повреждение спинного мозга и депрессивные расстройства.[53][54][55][56]
Роль в антидепрессивном действии
Определенный антидепрессант наркотики, такие как флуоксетин и флувоксамин, которые, как принято считать, влияют на депрессию, действуя как селективные ингибиторы обратного захвата серотонина (СИОЗС), также было обнаружено, что нормализует уровни некоторых нейростероидов (которые часто недостаточны у пациентов с депрессией) в дозах, которые не действуют в отношении обратный захват из серотонин. Это предполагает, что другие действия, связанные с нейростероидами, также могут влиять на эффективность этих препаратов против депрессии.[57][58]
Действие бензодиазепинов на нейростероиды
Бензодиазепины могут влиять на метаболизм нейростероидов в силу их действия на белок-транслокатор (TSPO; «периферический бензодиазепиновый рецептор»).[59] В фармакологический действия бензодиазепинов на ГАМКА рецепторы аналогичны рецепторам нейростероиды. Факторы, которые влияют на способность отдельных бензодиазепинов изменять уровни нейростероидов, могут зависеть от того, взаимодействует ли отдельный бензодиазепиновый препарат с TSPO. Некоторые бензодиазепины могут также ингибировать нейростероидогенные ферменты, снижающие синтез нейростероидов.[60]
Смотрите также
Рекомендации
- ^ Пол С.М., Парди Р.Х. (март 1992 г.). «Нейроактивные стероиды». Журнал FASEB. 6 (6): 2311–22. Дои:10.1096 / fasebj.6.6.1347506. PMID 1347506. S2CID 221753076.
- ^ Lan NC, Gee KW (декабрь 1994 г.). «Нейроактивные стероидные действия на рецептор GABAA». Гормоны и поведение. 28 (4): 537–44. Дои:10.1006 / hbeh.1994.1052. PMID 7729823. S2CID 40697424.
- ^ а б c d е ж Редди Д.С. (2010). «Нейростероиды: эндогенная роль в мозге человека и терапевтические возможности». Прогресс в исследованиях мозга. 186: 113–37. Дои:10.1016 / B978-0-444-53630-3.00008-7. ЧВК 3139029. PMID 21094889.
- ^ Редди Д.С., Рогавски М.А. (2012). «Нейростероиды - эндогенные регуляторы предрасположенности к приступам и их роль в лечении эпилепсии». В Noebels JL, Avoli M, Rogawski MA, et al. (ред.). Основные механизмы эпилепсии Джаспера [Интернет]. 4-е издание. Bethesda (MD): Национальный центр биотехнологической информации (США).
- ^ а б Шривастава Д.П., Уотерс Е.М., Мермельштейн П.Г., Крамар Е.А., Шорс Т.Дж., Лю Ф. (ноябрь 2011 г.). «Быстрая передача сигналов эстрогена в головном мозге: значение для тонкой настройки нейронных схем». Журнал неврологии. 31 (45): 16056–63. Дои:10.1523 / JNEUROSCI.4097-11.2011. ЧВК 3245715. PMID 22072656.
- ^ а б Редди Д.С., Рогавски М.А. (апрель 2009 г.). «Заместительная нейростероидная терапия при менструальной эпилепсии». Нейротерапия. 6 (2): 392–401. Дои:10.1016 / j.nurt.2009.01.006. ЧВК 2682439. PMID 19332335.
- ^ Морроу А.Л. (октябрь 2007 г.). «Последние достижения в значении и терапевтической значимости нейроактивных стероидов - Введение в специальный выпуск». Фармакология и терапия. 116 (1): 1–6. Дои:10.1016 / j.pharmthera.2007.04.003. ЧВК 2047816. PMID 17531324.
- ^ Дубровский Б.О. (февраль 2005 г.). «Стероиды, нейроактивные стероиды и нейростероиды в психопатологии». Прогресс в нейропсихофармакологии и биологической психиатрии. 29 (2): 169–92. Дои:10.1016 / j.pnpbp.2004.11.001. PMID 15694225. S2CID 36197603.
- ^ а б Биалер М., Йоханнесен С.И., Леви Р.Х., Перука Э., Томсон Т., Уайт Г.С. (январь 2013 г.). «Отчет о ходе разработки новых противоэпилептических препаратов: резюме Одиннадцатой конференции в Эйлате (EILAT XI)». Исследования эпилепсии. 103 (1): 2–30. Дои:10.1016 / j.eplepsyres.2012.10.001. PMID 23219031.
- ^ Rougé-Pont F, Mayo W, Marinelli M, Gingras M, Le Moal M, Piazza PV (июль 2002 г.). «Нейростероид аллопрегнанолон увеличивает высвобождение дофамина и дофаминергический ответ на морфин в прилежащем ядре крысы». Европейский журнал нейробиологии. 16 (1): 169–73. Дои:10.1046 / j.1460-9568.2002.02084.x. PMID 12153544. S2CID 9953445.
- ^ а б c Фрай CA (декабрь 2009 г.). «Эффекты нейростероидов и механизмы для социальных, когнитивных, эмоциональных и физических функций». Психонейроэндокринология. 34 Приложение 1: С143-61. Дои:10.1016 / j.psyneuen.2009.07.005. ЧВК 2898141. PMID 19656632.
- ^ Пинна Дж., Коста Е., Гуидотти А. (февраль 2005 г.). «Изменения в биосинтезе тестостерона и аллопрегнанолона в мозге вызывают агрессивное поведение». Труды Национальной академии наук Соединенных Штатов Америки. 102 (6): 2135–40. Bibcode:2005ПНАС..102.2135П. Дои:10.1073 / pnas.0409643102. ЧВК 548579. PMID 15677716.
- ^ Теран-Перес Г., Арана-Лечуга Ю., Эскеда-Леон Е., Сантана-Миранда Р., Рохас-Заморано Х., Веласкес Моктесума Дж. (Октябрь 2012 г.). «Стероидные гормоны и регуляция сна». Мини-обзоры по медицинской химии. 12 (11): 1040–8. Дои:10.2174/138955712802762167. PMID 23092405.
- ^ Патте-Менса С., Мейер Л., Талеб О., Менсах-Няган АГ (февраль 2014 г.). «Возможная роль аллопрегнанолона для безопасной и эффективной терапии невропатической боли». Прогресс в нейробиологии. 113: 70–8. Дои:10.1016 / j.pneurobio.2013.07.004. PMID 23948490. S2CID 207407077.
- ^ Хенин Дж., Салари Р., Мурлидаран С., Бранниган Дж. (2014). «Предполагаемый сайт связывания холестерина на рецепторе GABAA». Биофиз. J. 106 (9): 1938–49. Bibcode:2014BpJ ... 106.1938H. Дои:10.1016 / j.bpj.2014.03.024. ЧВК 4017285. PMID 24806926.
- ^ Левитан, Ирена; Сингх, Дев К .; Розенхаус-Данцкер, Авиа (2014). «Связывание холестерина с ионными каналами». Границы физиологии. 5: 65. Дои:10.3389 / fphys.2014.00065. ISSN 1664-042X. ЧВК 3935357. PMID 24616704.
- ^ Paul, S.M .; Доэрти, Дж. Дж .; Робишо, А. Дж .; Belfort, G.M .; Chow, B. Y .; Hammond, R. S .; Crawford, D.C .; Linsenbardt, A.J .; Shu, H.-J .; Izumi, Y .; Mennerick, S.J .; Зорумский, К. Ф. (2013). «Главный метаболит холестерина в головном мозге 24 (S) -гидроксихолестерин является мощным аллостерическим модулятором рецепторов N-метил-D-аспартата». Журнал неврологии. 33 (44): 17290–17300. Дои:10.1523 / JNEUROSCI.2619-13.2013. ISSN 0270-6474. ЧВК 3812502. PMID 24174662.
- ^ Кристофер Х. Хоукс; Ричард Л. Доти (12 февраля 2009 г.). Неврология обоняния. Издательство Кембриджского университета. С. 37–. ISBN 978-0-521-68216-9.
- ^ а б Монти-Блох Л., Дженнингс-Уайт С., Дольберг Д.С., Берлинер Д.Л. (1994). «Вомероназальная система человека». Психонейроэндокринология. 19 (5–7): 673–86. Дои:10.1016/0306-4530(94)90049-3. PMID 7938363. S2CID 36129626.
- ^ а б Либовиц М.Р., Салман Э., Николини Х., Розенталь Н., Ганновер Р., Монти Л. (июнь 2014 г.). «Влияние острой интраназальной аэрозольной дозы PH94B на социальную тревогу и беспокойство по поводу производительности у женщин с социальным тревожным расстройством». Американский журнал психиатрии. 171 (6): 675–82. Дои:10.1176 / appi.ajp.2014.12101342. PMID 24700254.
- ^ Маркс CE, Брэдфорд Д.В., Хамер Р.М., Нейлор Дж. К., Аллен Т. Б., Либерман Дж. А., Штраус Дж. Л., Килтс Дж. Д. (сентябрь 2011 г.). «Прегненолон как новый терапевтический кандидат при шизофрении: новые доклинические и клинические данные». Неврология. 191: 78–90. Дои:10.1016 / j.neuroscience.2011.06.076. PMID 21756978. S2CID 26396652.
- ^ Болье Э, Шумахер М (2000). «Прогестерон как нейроактивный нейростероид с особым упором на влияние прогестерона на миелинизацию». Стероиды. 65 (10–11): 605–12. Дои:10.1016 / s0039-128x (00) 00173-2. PMID 11108866. S2CID 14952168.
- ^ Томас П., Панг И (2012). «Мембранные рецепторы прогестерона: доказательства нейропротекторной, нейростероидной передачи сигналов и нейроэндокринных функций в нейрональных клетках». Нейроэндокринология. 96 (2): 162–71. Дои:10.1159/000339822. ЧВК 3489003. PMID 22687885.
- ^ Агис-Бальбоа Р.С., Пинна Дж., Жуби А., Малоку Е., Велдич М., Коста Е., Гуидотти А. (сентябрь 2006 г.). «Характеристика нейронов мозга, экспрессирующих ферменты, опосредующие биосинтез нейростероидов». Труды Национальной академии наук Соединенных Штатов Америки. 103 (39): 14602–7. Bibcode:2006ПНАС..10314602А. Дои:10.1073 / pnas.0606544103. ЧВК 1600006. PMID 16984997.
- ^ Меллон Ш., Гриффин Л. Д. (2002). «Нейростероиды: биохимия и клиническое значение». Тенденции в эндокринологии и метаболизме. 13 (1): 35–43. Дои:10.1016 / S1043-2760 (01) 00503-3. PMID 11750861. S2CID 11605131.
- ^ Benarroch EE (март 2007 г.). «Нейростероиды: эндогенные модуляторы нейрональной возбудимости и пластичности». Неврология. 68 (12): 945–7. Дои:10.1212 / 01.wnl.0000257836.09570.e1. PMID 17372131. S2CID 219216099.
- ^ Валле М., Майо В., Куб Г.Ф., Ле Моаль М. (2001). «Нейростероиды в процессах обучения и памяти». Международный обзор нейробиологии. 46: 273–320. Дои:10.1016 / s0074-7742 (01) 46066-1. ISBN 9780123668462. PMID 11599303.
- ^ а б Энгель С.Р., Грант К.А. (2001). «Нейростероиды и поведение». Международный обзор нейробиологии. 46: 321–48. Дои:10.1016 / S0074-7742 (01) 46067-3. ISBN 9780123668462. PMID 11599304.
- ^ а б Король SR (2008). «Новые роли нейростероидов в сексуальном поведении и функции». Журнал Андрологии. 29 (5): 524–33. Дои:10.2164 / jandrol.108.005660. PMID 18567641.
- ^ Джоши С., Раджасекаран К., Капур Дж. (Июнь 2013 г.). «ГАМКергическая передача при височной эпилепсии: роль нейростероидов». Экспериментальная неврология. 244: 36–42. Дои:10.1016 / j.expneurol.2011.10.028. ЧВК 3319002. PMID 22101060.
- ^ а б Гирдлер С.С., Клацкин Р. (октябрь 2007 г.). «Нейростероиды в контексте стресса: последствия для депрессивных расстройств». Фармакология и терапия. 116 (1): 125–39. Дои:10.1016 / j.pharmthera.2007.05.006. ЧВК 2650267. PMID 17597217.
- ^ а б Бали А., Джагги А.С. (январь 2014 г.). «Многофункциональные аспекты аллопрегнанолона при стрессе и связанных с ним расстройствах». Прогресс в нейропсихофармакологии и биологической психиатрии. 48: 64–78. Дои:10.1016 / j.pnpbp.2013.09.005. PMID 24044974. S2CID 21399549.
- ^ Ганн Б.Г., Каннингем Л., Митчелл С.Г., Суинни Д.Д., Ламберт Д.Дж., Белелли Д. (январь 2015 г.). «Нейростероиды, действующие на рецептор ГАМК: роль в развитии и регуляции стрессовой реакции». Границы нейроэндокринологии. 36: 28–48. Дои:10.1016 / j.yfrne.2014.06.001. ЧВК 4349499. PMID 24929099.
- ^ а б Бэкстрём Т., Андерссон А., Андреэ Л., Бирзниеце В., Биксо М., Бьёрн И., Хааге Д., Исакссон М., Йоханссон И. М., Линдблад С., Лундгрен П., Нюберг С., Одмарк И. С., Стрёмберг Дж., Сундстрём-Поромаа И., Туркмен С. Wahlström G, Wang M, Wihlbäck AC, Zhu D, Zingmark E (декабрь 2003 г.). «Патогенез нарушений ЦНС, связанных с менструальным циклом». Летопись Нью-Йоркской академии наук. 1007 (1): 42–53. Bibcode:2003НЯСА1007 ... 42Б. Дои:10.1196 / Анналы.1286.005. PMID 14993039. S2CID 20995334.
- ^ Guille C, Spencer S, Cavus I, Epperson CN (июль 2008 г.). «Роль половых стероидов при менструальной эпилепсии и предменструальном дисфорическом расстройстве: значение для диагностики и лечения». Эпилепсия и поведение. 13 (1): 12–24. Дои:10.1016 / j.yebeh.2008.02.004. ЧВК 4112568. PMID 18346939.
- ^ Finocchi C, Ferrari M (май 2011 г.). «Женские репродуктивные стероиды и возбудимость нейронов». Неврологические науки. 32 Дополнение 1: S31-5. Дои:10.1007 / s10072-011-0532-5. PMID 21533709. S2CID 8885335.
- ^ Дженаццани А.Р., Бернарди Ф., Монтелеоне П., Луизи С., Луизи М. (2000). «Нейропептиды, нейротрансмиттеры, нейростероиды и начало полового созревания». Летопись Нью-Йоркской академии наук. 900 (1): 1–9. Bibcode:2000НЯСА.900 .... 1Г. Дои:10.1111 / j.1749-6632.2000.tb06210.x. PMID 10818386. S2CID 19302118.
- ^ Melcangi RC, Panzica G, Garcia-Segura LM (сентябрь 2011 г.). «Нейроактивные стероиды: фокус на человеческий мозг». Неврология. 191: 1–5. Дои:10.1016 / j.neuroscience.2011.06.024. HDL:10261/61590. PMID 21704130. S2CID 55704799.
- ^ Андреен Л., Сундстрем-Поромаа I, Биксо М., Нюберг С., Бэкстрем Т. (август 2006 г.). «Концентрация аллопрегнанолона и настроение - бимодальная ассоциация у женщин в постменопаузе, получавших пероральный прогестерон». Психофармакология. 187 (2): 209–21. Дои:10.1007 / s00213-006-0417-0. PMID 16724185. S2CID 1933116.
- ^ а б Бэкстрём Т., Хааге Д., Лёфгрен М., Йоханссон И.М., Стрёмберг Дж., Нюберг С., Андреен Л., Оссеваарде Л., ван Винген Г.А., Туркмен С., Бенгтссон С.К. (сентябрь 2011 г.). «Парадоксальные эффекты модуляторов ГАМК-А могут объяснить симптомы негативного настроения, вызванные половыми стероидами, у некоторых людей». Неврология. 191: 46–54. Дои:10.1016 / j.neuroscience.2011.03.061. PMID 21600269. S2CID 38928854.
- ^ а б Андреен Л., Нюберг С., Туркмен С., ван Винген Г., Фернандес Г., Бэкстрем Т. (сентябрь 2009 г.). «Негативное настроение, вызванное половыми стероидами, можно объяснить парадоксальным эффектом, опосредованным модуляторами ГАМК». Психонейроэндокринология. 34 (8): 1121–32. Дои:10.1016 / j.psyneuen.2009.02.003. PMID 19272715. S2CID 22259026.
- ^ а б Бэкстрём Т., Биксо М., Йоханссон М., Нюберг С., Оссеваарде Л., Рагагнин Г., Савич И., Стрёмберг Дж., Тимби Е., ван Брукховен Ф., ван Винген Г. (февраль 2014 г.). «Аллопрегнанолон и расстройства настроения». Прогресс в нейробиологии. 113: 88–94. Дои:10.1016 / j.pneurobio.2013.07.005. PMID 23978486. S2CID 207407084.
- ^ Морис Т., Урани А., Фан В.Л., Ромье П. (2001). «Взаимодействие между нейроактивными стероидами и функцией рецептора сигма1: поведенческие последствия и терапевтические возможности». Brain Res. Brain Res. Rev. 37 (1–3): 116–32. Дои:10.1016 / s0165-0173 (01) 00112-6. PMID 11744080. S2CID 44931783.
- ^ а б c d е Su TP, London ED, Jaffe JH (1988). «Связывание стероидов на сигма-рецепторах предполагает связь между эндокринной, нервной и иммунной системами». Наука. 240 (4849): 219–21. Bibcode:1988Научный ... 240..219S. Дои:10.1126 / science.2832949. PMID 2832949.
- ^ а б c d е Такэбаяси М., Хаяси Т., Су ТП (2004). «Взгляд на новый механизм антидепрессантов: нейритогенез через рецепторы сигма-1». Фармакопсихиатрия. 37 Дополнение 3: S208–13. Дои:10.1055 / с-2004-832679. PMID 15547787.
- ^ Рогавски М.А., Редди Д.С., 2004. Нейростероиды: эндогенные модуляторы предрасположенности к приступам. В: Ро, Дж. М., Санкар, Р., Кавазос, Дж. (Ред.), Эпилепсия: научные основы клинической практики. Марсель Деккер, Нью-Йорк, 2004; 319-355.
- ^ Кокате Т.Г., Ямагути С., Паннелл Л.К., Раджамани Ю., Кэрролл Д.М., Гроссман А.Б., Рогавски М.А. (ноябрь 1998 г.). «Отсутствие противосудорожной толерантности к нейроактивному стероиду прегнанолон у мышей». Журнал фармакологии и экспериментальной терапии. 287 (2): 553–8. PMID 9808680.
- ^ Редди Д.С., Рогавски М.А. (декабрь 2000 г.). «Хроническое лечение крыс нейроактивным стероидом ганаксолоном вызывает противосудорожную толерантность к диазепаму, но не к самому себе». Журнал фармакологии и экспериментальной терапии. 295 (3): 1241–8. PMID 11082461.
- ^ Оррин Девинский; Стивен Шахтер; Стивен Пачиа (1 января 2005 г.). Дополнительные и альтернативные методы лечения эпилепсии. Demos Medical Publishing. С. 378–. ISBN 978-1-934559-08-6.
- ^ http://adisinsight.springer.com/drugs/800039944
- ^ http://www.sagerx.com/programs.php#547
- ^ Грибель Г., Холмс А. (сентябрь 2013 г.). «50 лет препятствий и надежд в открытии анксиолитических препаратов» (PDF). Обзоры природы.Открытие наркотиков. 12 (9): 667–87. Дои:10.1038 / nrd4075. ЧВК 4176700. PMID 23989795.
- ^ http://adisinsight.springer.com/drugs/800034216
- ^ Duchossoy Y, David S, Baulieu EE, Robel P (2011). «Лечение экспериментального повреждения спинного мозга 3β-метоксипгненолоном». Brain Res. 1403: 57–66. Дои:10.1016 / j.brainres.2011.05.065. PMID 21704982. S2CID 42657539.
- ^ Бьянки М, Болье Э. (2012). «3β-Метоксипгненолон (MAP4343) как инновационный терапевтический подход к депрессивным расстройствам». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 109 (5): 1713–8. Bibcode:2012PNAS..109.1713B. Дои:10.1073 / pnas.1121485109. ЧВК 3277154. PMID 22307636.
- ^ Baulieu ÉÉ (2015). «От стероидных гормонов до депрессивных состояний и старческой деменции: новые механистические, терапевтические и прогностические подходы». Comptes Rendus Biologies. 338 (8–9): 613–6. Дои:10.1016 / j.crvi.2015.06.003. PMID 26251072.
- ^ Узунова В., Шелин Ю., Дэвис Дж. М., Расмуссон А., Узунов Д. П., Коста Е., Гуидотти А. (март 1998 г.). «Повышение содержания нейростероидов в спинномозговой жидкости у пациентов с униполярной большой депрессией, получающих флуоксетин или флувоксамин». Труды Национальной академии наук Соединенных Штатов Америки. 95 (6): 3239–44. Bibcode:1998PNAS ... 95.3239U. Дои:10.1073 / пнас.95.6.3239. ЧВК 19726. PMID 9501247.
- ^ Пинна Дж., Коста Е., Гуидотти А. (июнь 2006 г.). «Флуоксетин и норфлуоксетин стереоспецифически и избирательно увеличивают содержание нейростероидов в головном мозге в дозах, которые не действуют на обратный захват 5-HT». Психофармакология. 186 (3): 362–72. Дои:10.1007 / s00213-005-0213-2. PMID 16432684. S2CID 7799814.
- ^ Дхир А., Рогавски М.А. (апрель 2012 г.). «Роль нейростероидов в противосудорожной активности мидазолама». Британский журнал фармакологии. 165 (8): 2684–91. Дои:10.1111 / j.1476-5381.2011.01733.x. ЧВК 3423249. PMID 22014182.
- ^ Усами Н., Ямамото Т., Синтани С., Исикура С., Хигаки Ю., Катагири Ю., Хара А. (апрель 2002 г.). «Субстратная специфичность человеческой 3 (20) альфа-гидроксистероиддегидрогеназы в отношении нейростероидов и ее ингибирование бензодиазепинами» (pdf). Биологический и фармацевтический бюллетень. 25 (4): 441–5. Дои:10.1248 / bpb.25.441. PMID 11995921.
дальнейшее чтение
- Akk G, Shu HJ, Wang C, Steinbach JH, Zorumski CF, Covey DF, Mennerick S (декабрь 2005 г.). «Нейростероидный доступ к рецептору ГАМКА». Журнал неврологии. 25 (50): 11605–13. Дои:10.1523 / JNEUROSCI.4173-05.2005. ЧВК 6726021. PMID 16354918.
- Ван Дж. М., Джонстон П. Б., Болл Б. Г., Бринтон Р. Д. (май 2005 г.). «Нейростероид аллопрегнанолон способствует пролиферации клеток-предшественников нервов грызунов и человека и регулирует экспрессию генов и белков клеточного цикла». Журнал неврологии. 25 (19): 4706–18. Дои:10.1523 / JNEUROSCI.4520-04.2005. ЧВК 6724768. PMID 15888646.
- Донг Э., Мацумото К., Узунова В., Сугая И., Такахата Х., Номура Х., Ватанабе Х., Коста Е., Гуидотти А. (февраль 2001 г.). «Синтез 5альфа-дигидропрогестерона и аллопрегнанолона в мозге на мышиной модели длительной социальной изоляции». Труды Национальной академии наук Соединенных Штатов Америки. 98 (5): 2849–54. Bibcode:2001PNAS ... 98.2849D. Дои:10.1073 / pnas.051628598. ЧВК 30228. PMID 11226329.
- Melcangi RC, Celotti F, Martini L (март 1994). «Прогестерон 5-альфа-редукция в нейронах и в различных типах культур глиальных клеток: астроциты 1 и 2 типа и олигодендроциты». Исследование мозга. 639 (2): 202–6. Дои:10.1016/0006-8993(94)91731-0. PMID 8205473. S2CID 37105244.
- Corpéchot C, Robel P, Axelson M, Sjövall J, Baulieu EE (август 1981). «Характеристика и измерение сульфата дегидроэпиандростерона в мозге крысы». Труды Национальной академии наук Соединенных Штатов Америки. 78 (8): 4704–7. Bibcode:1981PNAS ... 78.4704C. Дои:10.1073 / пнас.78.8.4704. ЧВК 320231. PMID 6458035.
- Редди Д., Рогавский М.А. (2012). «Нейростероиды - эндогенные регуляторы предрасположенности к судорогам и роль в лечении эпилепсии». В Noebels JL, Avoli M, Rogawski MA, et al. (ред.). Основные механизмы эпилепсии Джаспера (4-е изд.). Bethesda (MD): Национальный центр биотехнологической информации. PMID 22787590.
