Холестерин - Cholesterol
 | |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК холест-5-ен-3β-ол | |
| Систематическое название ИЮПАК (3S,8S,9S,10р,13р,14S,17р) -10,13-диметил-17 - [(2р) -6-метилгептан-2-ил] -2,3,4,7,8,9,11,12,14,15,16,17-додекагидро-1ЧАС-циклопента [а] фенантрен-3-ол | |
| Другие имена Холестерин, холестериловый спирт[1] | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.000.321 |
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C27ЧАС46О | |
| Молярная масса | 386,65 г / моль |
| Внешность | белый кристаллический порошок[2] |
| Плотность | 1,052 г / см3 |
| Температура плавления | От 148 до 150 ° C (от 298 до 302 ° F, от 421 до 423 K) [2] |
| Точка кипения | 360 ° С (680 ° F, 633 К) (разлагается) |
| 0,095 мг / л (30 ° С)[1] | |
| Растворимость | растворим в ацетон, бензол, хлороформ, этиловый спирт, эфир, гексан, изопропилмиристат, метанол |
| -284.2·10−6 см3/ моль | |
| Опасности | |
| точка возгорания | 209,3 ± 12,4 ° С |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
| Виды жиры в еда |
|---|
| Смотрите также |
Холестерин (от Древнегреческий холе- (желчь ) и стереосистемы (сплошной), за которым следует химический суффикс -ol для алкоголь ) является органический молекула. Это стерол (или же модифицированный стероидный препарат ),[3] тип липид.[1] Холестерин - это биосинтезированный всем животным клетки и является важным структурным компонентом животное клеточные мембраны.
Холестерин также служит предшественник для биосинтез из стероидные гормоны, желчная кислота[4] и Витамин Д. Холестерин - главный стерол синтезируется всеми животными. В позвоночные, печеночный клетки обычно производят наибольшее количество. Его нет среди прокариоты (бактерии и археи ), хотя есть и исключения, например Микоплазма, которым для роста необходим холестерин.[5]
Франсуа Пулетье де ла Саль впервые идентифицировал холестерин в твердой форме в камни в желчном пузыре в 1769 г. Однако только в 1815 г. химик Мишель Эжен Шеврёль назвал соединение «холестерин».[6][7]
Физиология
Холестерин необходим для всего животного мира, и каждая клетка способна синтезировать его с помощью сложного 37-этапного процесса. Это начинается с мевалонат или же Путь HMG-CoA редуктазы, цель статины препараты, который включает первые 18 шагов. Далее следуют 19 дополнительных шагов для преобразования полученного ланостерин в холестерин.
Мужчина-мужчина весом 68 кг (150 фунтов) обычно синтезирует около 1 грамма (1000 мг) холестерина в день, а его тело содержит около 35 г, в основном содержащихся в клеточных мембранах. Типичное дневное потребление холестерина с пищей для мужчины в Соединенных Штатах составляет 307 мг.[8]
Наиболее проглоченный холестерин этерифицированный, из-за чего он плохо всасывается в кишечнике. Организм также компенсирует поглощение проглоченного холестерина за счет снижения собственного синтеза холестерина.[9] По этим причинам холестерин в пище через семь-десять часов после приема внутрь практически не влияет на концентрацию холестерина в крови.[10] Однако в течение первых семи часов после приема внутрь холестерина, поскольку поглощенные жиры распределяются по телу во внеклеточной воде посредством различных липопротеины (которые переносят все жиры из воды за пределы клеток), концентрация увеличивается.[11]
Растения не производят холестерин [12] но производство фитостерины, химически подобные вещества, которые могут конкурировать с холестерином за реабсорбцию в кишечном тракте, потенциально снижая реабсорбцию холестерина.[13] Когда клетки слизистой оболочки кишечника поглощают фитостерины вместо холестерина, они обычно выводят молекулы фитостерина обратно в организм. Желудочно-кишечный тракт, важный защитный механизм. Потребление природных фитостеринов, содержащихся в растениях. стеролы и станолы, колеблется в пределах ≈200–300 мг / день в зависимости от привычек питания.[14] Разработаны специально разработанные экспериментальные вегетарианские диеты с выходом более 700 мг в день.[15]
Функция в ячейках
Мембраны
Холестерин составляет около 30% всего животного клеточные мембраны. Требуется для создания и обслуживания мембран и модулирующих текучесть мембраны в диапазоне физиологических температур. В гидроксил группа каждой молекулы холестерина взаимодействует с молекулами воды, окружающей мембрану, как и полярный главы мембрана фосфолипиды и сфинголипиды, а громоздкие стероидный препарат и углеводород цепи встроены в мембрану, рядом с неполярный цепь жирных кислот других липидов. Взаимодействуя с фосфолипидными жирнокислотными цепями, холестерин увеличивает упаковку мембраны, что одновременно изменяет ее текучесть.[16] и поддерживает целостность мембран, так что животным клеткам не нужно строить клеточные стенки (как растения и большинство бактерий). Мембрана остается стабильной и прочной, но при этом не жесткой, позволяя клеткам животных изменять форму, а животным - двигаться.
Структура тетрациклический кольцо холестерина способствует текучести клеточной мембраны, поскольку молекула находится в транс конформация, делающая все, кроме боковой цепи холестерина, жесткими и плоскими.[17] В этой структурной роли холестерин также снижает проницаемость плазматической мембраны для нейтральных растворенных веществ,[18] водород ионы, и натрий ионы.[19]
Ворота
Внутри клеточной мембраны холестерин также участвует во внутриклеточном транспорте, передаче сигналов между клетками и нервной проводимости. Холестерин необходим для структуры и функции инвагинированных кавеолы и клатрин -покрытый ямы, включая кавеолозависимые и клатринзависимые эндоцитоз. Роль холестерина в эндоцитозе этих типов может быть исследована с помощью метил-бета-циклодекстрин (MβCD) для удаления холестерина с плазматической мембраны.
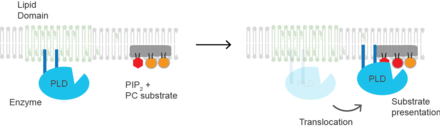
Презентация субстрата
Холестерин регулирует биологический процесс презентация субстрата и ферменты, которые используют представление субстрата как механизм своей активации. (PLD2 ) является четко определенным примером фермента, активируемого презентацией субстрата.[20] Фермент пальмитоилированный заставляя фермент перемещаться к холестерин-зависимым липидным доменам, иногда называемым "липидные рафты ". Подложка фосфолипаза D является фосфатидилхолин (PC), который является ненасыщенным и мало содержится в липидных рафтах. ПК локализуется в неупорядоченной области клетки вместе с полиненасыщенным липидом. фосфатидилинозитол-4,5-бисфосфат (PIP2 ). PLD2 имеет PIP2 связывающий домен. Когда концентрация PIP2 в мембране увеличивается, PLD2 покидает холестерин-зависимые домены и связывается с PIP2, где затем получает доступ к своему субстрату PC и начинает катализ на основе презентации субстрата.
Сигнализация
Холестерин также участвует в процессах передачи сигналов в клетках, помогая в образовании липидные рафты в плазматическая мембрана, который сближает рецепторные белки с высокими концентрациями вторичных молекул-посредников.[21] В нескольких слоях холестерин и фосфолипиды, оба электрические изоляторы, могут способствовать скорости передачи электрических импульсов по нервной ткани. Для многих нейронных волокон миелин оболочка, богатая холестерином, так как образована из уплотненных слоев Шванновская ячейка мембрана обеспечивает изоляцию для более эффективного проведения импульсов.[22] Демиелинизация (потеря некоторых из этих шванновских клеток) считается частью основы для рассеянный склероз.
Холестерин связывается и влияет на стробирование ряда ионные каналы такой как никотиновый рецептор ацетилхолина, ГАМКА рецептор, а входной выпрямительный калиевый канал.[23] Холестерин также активирует эстроген-связанный рецептор альфа (ERRα), и может быть эндогенный лиганд для рецептор.[24][25] Конститутивно активная природа рецептора может быть объяснена тем фактом, что холестерин присутствует в организме повсеместно.[25] Ингибирование передачи сигналов ERRα за счет снижения выработки холестерина было идентифицировано как ключевой медиатор эффектов статины и бисфосфонаты на кость, мышца, и макрофаги.[24][25] На основании этих результатов было высказано предположение, что ERRα следует деорфанизировать и классифицировать как рецептор холестерина.[24][25]
Химический прекурсор
Внутри клеток холестерин также является молекулой-предшественником для нескольких биохимические пути. Например, это молекула-предшественник для синтеза Витамин Д в метаболизм кальция и все стероидные гормоны, в том числе надпочечник гормоны кортизол и альдостерон, а также половые гормоны прогестерон, эстрогены, и тестостерон, и их производные.[4][26]
Метаболизм
Холестерин - это переработанный в организме. Печень выводит холестерин в желчный жидкости, которые затем хранятся в желчный пузырь, который затем выводит их в не-этерифицированный форма (через желчь) в пищеварительный тракт. Как правило, около 50% выводимого холестерина реабсорбируется тонкий кишечник обратно в кровоток.[27]
Биосинтез и регуляция
Биосинтез
Все животные клетки производят холестерин как для мембранной структуры, так и для других целей, при этом относительная скорость продукции зависит от типа клеток и функций органов. Около 80% от общего суточного производства холестерина происходит в печень и кишечник;[28] другие сайты высшего синтез ставки включают мозг, то надпочечники, а репродуктивные органы.
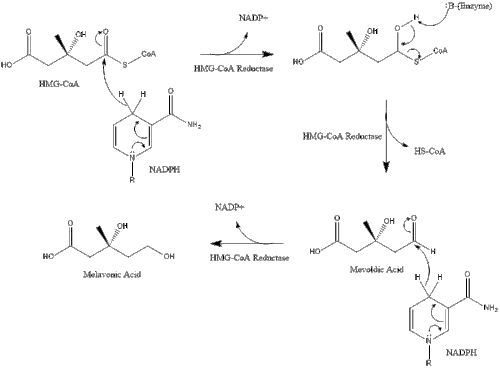
Синтез в организме начинается с мевалонатный путь где две молекулы ацетил-КоА конденсироваться в форму ацетоацетил-КоА. Затем следует вторая конденсация между ацетил-КоА и ацетоацетил-КоА формировать 3-гидрокси-3-метилглутарил-КоА (HMG-CoA ).[29]

Затем эта молекула сокращается до мевалонат ферментом HMG-CoA редуктаза. Изготовление мевалонат является лимитирующей и необратимой стадией синтеза холестерина и является местом действия для статины (класс препаратов, снижающих уровень холестерина).
Мевалонат наконец превращается в изопентенилпирофосфат (IPP) через две стадии фосфорилирования и одну стадию декарбоксилирования, которая требует АТФ.
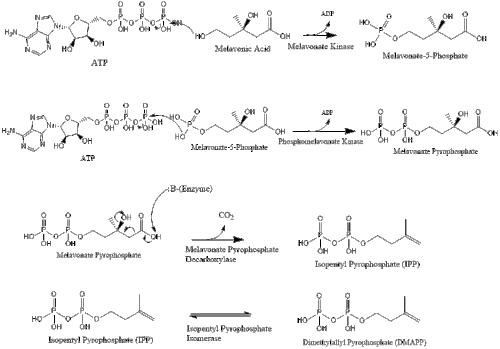
Три молекулы изопентенилпирофосфата конденсируются с образованием фарнезилпирофосфат за счет действия геранилтрансферазы.

Две молекулы фарнезилпирофосфата затем конденсируются с образованием сквален действием скваленсинтаза в эндоплазматический ретикулум.[29]
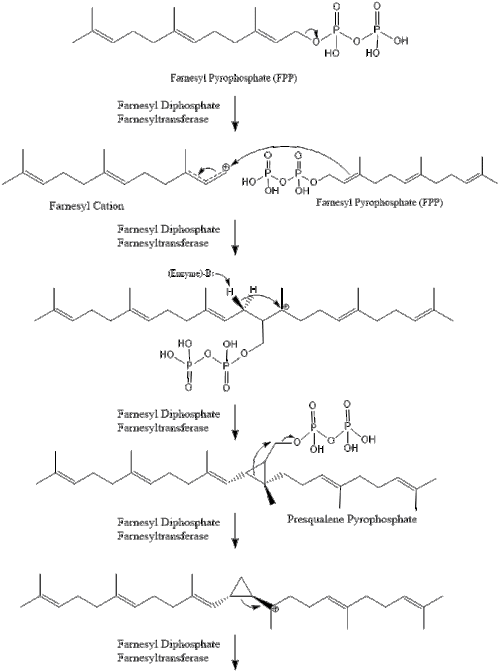
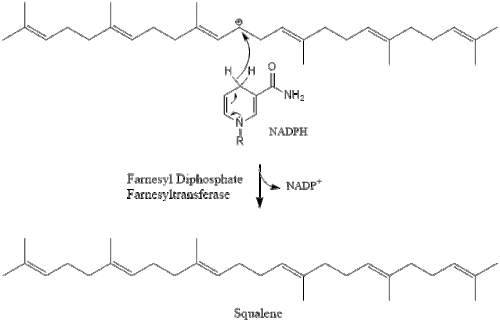
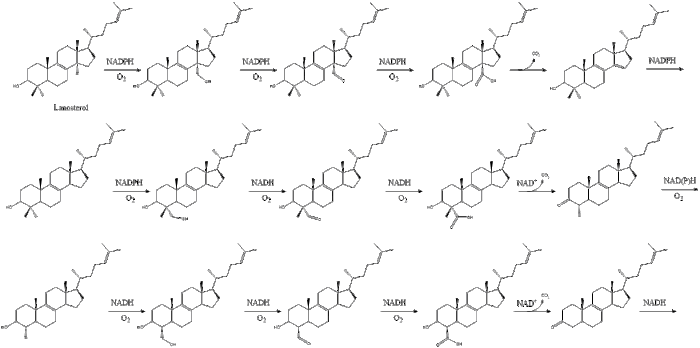
Оксидоскваленциклаза затем циклизует сквален с образованием ланостерин. Наконец, ланостерин превращается в холестерин за 19 этапов.[30][31]
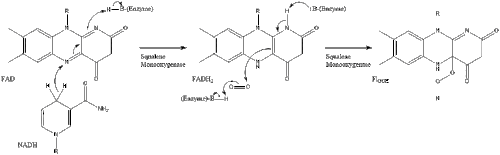
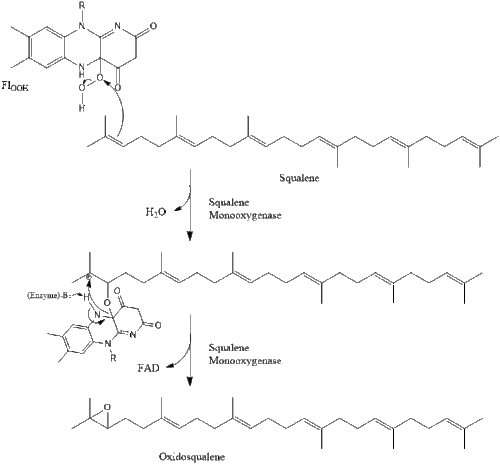
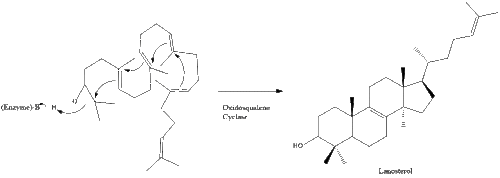
Последние 19 шагов к холестерину содержат НАДФН и кислород, чтобы помочь окислить метильные группы для удаления углерода, мутазы двигаться алкен группы и НАДН чтобы помочь уменьшить кетоны.

Конрад Блох и Федор Линен поделился Нобелевская премия по физиологии и медицине в 1964 г. за открытия, касающиеся некоторых механизмов и методов регуляции холестерина и метаболизм жирных кислот.[32]
Регуляция синтеза холестерина
Биосинтез холестерина напрямую регулируется имеющимся уровнем холестерина, хотя гомеостатический задействованные механизмы поняты лишь частично. Более высокое потребление с пищей приводит к чистому снижению эндогенного производства, тогда как более низкое потребление с пищей имеет противоположный эффект. Основным регуляторным механизмом является восприятие внутриклеточный холестерин в эндоплазматический ретикулум посредством белок SREBP (белок 1 и 2, связывающий регуляторный элемент стерола).[33] В присутствии холестерина SREBP связывается с двумя другими белками: SCAP (Белок, активирующий расщепление SREBP) и INSIG-1. Когда уровень холестерина падает, INSIG-1 диссоциирует от комплекса SREBP-SCAP, что позволяет комплексу мигрировать в аппарат Гольджи. Здесь SREBP расщепляется S1P и S2P (протеаза сайта 1 и протеаза сайта 2), двумя ферментами, которые активируются SCAP при низком уровне холестерина.
Затем расщепленный SREBP мигрирует в ядро и действует как фактор транскрипции связываться с регуляторным элементом стерола (SRE), который стимулирует транскрипция многих генов. Среди них липопротеины низкой плотности (ЛПНП ) рецептор и HMG-CoA редуктаза. Рецептор LDL удаляет циркулирующие LDL из кровотока, тогда как HMG-CoA редуктаза приводит к увеличению эндогенной продукции холестерина.[34] Большая часть этого сигнального пути была выяснена доктором. Майкл С. Браун и доктор Джозеф Л. Гольдштейн в 1970-е гг. В 1985 году они получили Нобелевская премия по физиологии и медицине за их работу. Их последующая работа показывает, как путь SREBP регулирует экспрессию многих генов, контролирующих образование и метаболизм липидов, а также выделение топлива в организме.
Синтез холестерина также можно отключить при высоком уровне холестерина. HMG-CoA редуктаза содержит как цитозольный домен (отвечающий за его каталитическую функцию), так и мембранный домен. Мембранный домен воспринимает сигналы о его разрушении. Повышение концентрации холестерина (и других стеринов) вызывает изменение состояния олигомеризации этого домена, что делает его более восприимчивым к разрушению протеосома. Активность этого фермента также может быть снижена за счет фосфорилирования AMP-активированным белком. киназа. Поскольку эта киназа активируется АМФ, который продуцируется при гидролизе АТФ, из этого следует, что синтез холестерина останавливается при низком уровне АТФ.[35]
Плазменный транспорт и регуляция абсорбции

Как изолированная молекула холестерин лишь минимально растворим в воды, или же гидрофильный. Из-за этого он растворяется в крови в очень малых концентрациях. Для эффективной транспортировки холестерин вместо этого упаковывается в липопротеины, сложный дискоидный частицы с внешней амфифильный протеины и липиды, чьи обращенные наружу поверхности растворимы в воде, а обращенные внутрь поверхности - липидорастворимы. Это позволяет ему перемещаться по крови через эмульгирование. Несвязанный холестерин, будучи амфипатическим, транспортируется на поверхности монослоя липопротеиновой частицы вместе с фосфолипидами и белками. С другой стороны, сложные эфиры холестерина, связанные с жирной кислотой, транспортируются внутри жирного гидрофильного ядра липопротеина вместе с триглицеридом.[36]
В крови есть несколько типов липопротеинов. В порядке увеличения плотности они хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины средней плотности (IDL), липопротеин низкой плотности (ЛПНП) и липопротеин высокой плотности (HDL). Более низкое соотношение белок / липид делает липопротеины менее плотными. Холестерин в составе различных липопротеинов идентичен, хотя некоторые из них находятся в своей природной «свободной» спиртовой форме (группа холестерина-ОН, обращенная к воде, окружающей частицы), а другие - в виде жирных ациловых эфиров, известных также как сложные эфиры холестерина, внутри частиц.[36]
Липопротеиновые частицы организованы сложным аполипопротеины обычно 80–100 различных белков на частицу, которые могут распознаваться и связываться специфическими рецепторами на клеточных мембранах, направляя свою липидную нагрузку в определенные клетки и ткани, которые в настоящее время поглощают эти частицы транспорта жира. Эти поверхностные рецепторы служат уникальными молекулярными сигнатурами, которые затем помогают определять распределение жира по телу.[36]
Хиломикроны, наименее плотные транспортные молекулы холестерина, содержат аполипопротеин B-48, аполипопротеин С, и аполипопротеин E (основной переносчик холестерина в головном мозге[37]) в своих оболочках. Хиломикроны переносят жиры из кишечника в мышцы и другие ткани, которые нуждаются в жирных кислотах для получения энергии или производства жира. Неиспользованный холестерин остается в более богатых холестерином остатках хиломикронов и попадает отсюда в кровоток печенью.[36]
Молекулы ЛПОНП производятся печенью из триацилглицерин и холестерин, который не использовался в синтезе желчных кислот. Эти молекулы содержат аполипопротеин B100 и аполипопротеин E в их оболочках и могут быть разрушены липопротеин липаза на стенке артерии к IDL. Это расщепление артериальной стенки позволяет абсорбировать триацилглицерин и увеличивает концентрацию циркулирующего холестерина. Затем молекулы IDL потребляются в двух процессах: половина метаболизируется HTGL и поглощается рецептором ЛПНП на поверхности клеток печени, в то время как другая половина продолжает терять триацилглицерины в кровотоке, пока они не превратятся в частицы ЛПНП, нагруженные холестерином.[36]
Частицы ЛПНП являются основными переносчиками холестерина в крови. Каждый из них содержит примерно 1500 молекул эфира холестерина. Оболочки молекул ЛПНП содержат только одну молекулу аполипопротеин B100, признанный Рецепторы ЛПНП в периферических тканях. При связывании аполипопротеин B100, многие рецепторы ЛПНП концентрируются в клатрин ямы с покрытием. И ЛПНП, и его рецептор образуют везикулы внутри клетки через эндоцитоз. Эти везикулы затем сливаются с лизосома, где липаза лизосомальной кислоты фермент гидролизует сложные эфиры холестерина. Затем холестерин можно использовать для биосинтеза мембран или эстерифицировать и хранить внутри клетки, чтобы не мешать клеточным мембранам.[36]
Рецепторы ЛПНП расходуются во время абсорбции холестерина, а его синтез регулируется SREBP, тот же белок, который контролирует синтез холестерина de novo, по его наличию внутри клетки. В клетке с высоким содержанием холестерина будет заблокирован синтез рецептора ЛПНП, чтобы предотвратить поглощение нового холестерина в молекулах ЛПНП. И наоборот, синтез рецепторов ЛПНП происходит, когда клетка испытывает дефицит холестерина.[36]
Когда этот процесс становится нерегулируемым, в крови начинают появляться молекулы ЛПНП без рецепторов. Эти молекулы ЛПНП окисляются и поглощаются макрофаги, которые набухают и образуют пенистые ячейки. Эти пенистые клетки часто застревают в стенках кровеносных сосудов и способствуют атеросклеротическая бляшка формирование. Различия в гомеостазе холестерина влияют на развитие раннего атеросклероза (толщина интима-медиа сонных артерий).[38] Эти бляшки являются основными причинами сердечных приступов, инсультов и других серьезных медицинских проблем, что приводит к ассоциации так называемого холестерина ЛПНП (фактически, липопротеин ) с «плохим» холестерином.[35]
Считается, что частицы ЛПВП транспортируют холестерин обратно в печень либо для выведения, либо для других тканей, которые синтезируют гормоны, в процессе, известном как обратный транспорт холестерина (RCT).[39] Большое количество частиц ЛПВП коррелирует с лучшими результатами для здоровья,[40] тогда как низкое количество частиц ЛПВП связано с атероматозный прогрессирование болезни в артериях.[нужна цитата ]
Метаболизм, переработка и выведение
Холестерин подвержен окислению и легко образует оксигенированные производные, называемые оксистерины. Их могут образовывать три различных механизма: автоокисление, вторичное окисление до перекисного окисления липидов и окисление ферментов, метаболизирующих холестерин. Большой интерес к оксистеринам возник, когда было показано, что они оказывают ингибирующее действие на биосинтез холестерина.[41] Это открытие стало известно как «гипотеза оксистерина». Дополнительные роли оксистеринов в физиологии человека включают их участие в биосинтезе желчных кислот, функцию транспортных форм холестерина и регуляцию транскрипции генов.[42]
В биохимических экспериментах используются радиоактивно меченные формы холестерина, такие как холестерин, меченный тритием. Эти производные разлагаются при хранении, поэтому перед использованием необходимо очистить холестерин. Холестерин можно очистить с помощью небольших колонок с сефадексом LH-20.[43]
Холестерин окисляется печенью в различные желчные кислоты.[44] Это, в свою очередь, сопряженный с глицин, таурин, глюкуроновая кислота, или же сульфат. Смесь конъюгированных и неконъюгированных желчных кислот вместе с самим холестерином выводится из организма. печень в желчь. Примерно 95% желчных кислот реабсорбируются из кишечника, а оставшаяся часть теряется с калом.[45] Выведение и реабсорбция желчных кислот составляет основу энтерогепатическое кровообращение, который необходим для переваривания и усвоения пищевых жиров. При определенных обстоятельствах, когда они более концентрированы, как в желчный пузырь, холестерин кристаллизуется и является основным компонентом большинства камни в желчном пузыре (лецитин и билирубин камни в желчном пузыре тоже встречаются, но реже).[46] Ежедневно в толстую кишку поступает до 1 г холестерина. Этот холестерин поступает из пищи, желчи и слущенных кишечных клеток и может метаболизироваться бактериями толстой кишки. Холестерин превращается в основном в копростанол, невсасывающийся стерол, который выводится с калом.[нужна цитата ]
Хотя холестерин является стероидом, обычно ассоциируемым с млекопитающими, патоген человека Микобактерии туберкулеза способен полностью разрушить эту молекулу и содержит большое количество генов, которые регулируются его присутствием.[47] Многие из этих генов, регулируемых холестерином, являются гомологи из жирная кислота β-окисление гены, но эволюционировали таким образом, чтобы связывать большие стероидные субстраты, такие как холестерин.[48][49]
Диетические источники
Животные жиры представляют собой сложные смеси триглицериды, с меньшим количеством как фосфолипиды и молекулы холестерина, из которых построены мембраны всех клеток животных (и человека). Поскольку все клетки животных производят холестерин, все продукты животного происхождения содержат холестерин в различных количествах.[50] Основные пищевые источники холестерина включают: красное мясо, яичные желтки и весь яйца, печень, почка, потроха, рыбий жир, и масло сливочное.[51] Человек грудное молоко также содержит значительное количество холестерина.[52]
Клетки растений синтезируют холестерин в качестве предшественника других соединений, таких как фитостерины и стероидный гликоалкалоиды, при этом холестерин остается в растительной пище только в незначительных количествах или отсутствует.[51][53] Некоторые растительные продукты, такие как авокадо, льняное семя и арахис, содержат фитостерины, которые конкурируют с холестерином за всасывание в кишечнике, снижают всасывание как пищевого, так и желчного холестерина.[54] Типичная диета содержит около 0,2 грамма фитостеринов, что недостаточно, чтобы оказать существенное влияние на блокирование всасывания холестерина. Прием фитостеринов может быть дополнен употреблением фитостеринсодержащих функциональные продукты или же пищевые добавки которые признаны имеющими потенциал для снижения уровней ЛПНП -холестерин.[55]
Медицинские указания и рекомендации
В 2016 г. Министерство сельского хозяйства США Консультативный комитет по диетическим рекомендациям рекомендовал американцам есть как можно меньше диетического холестерина.[56] Большинство продуктов, богатых холестерином, также содержат насыщенный жир и тем самым может увеличить риск сердечно-сосудистых заболеваний.[57]
В некоторых дополнительных руководствах рекомендуются дозы фитостеролов в диапазоне 1,6–3,0 грамма в день (Health Canada, EFSA, ATP III, FDA). Недавний метаанализ продемонстрировал снижение уровня холестерина ЛПНП на 12% при средней дозе 2,1 грамма в день.[58] Тем не менее, польза диеты с добавлением фитостеринов также подвергалась сомнению.[59]
Клиническое значение
Гиперхолестеринемия

Согласно липидная гипотеза, повышенный уровень холестерина в крови приводит к атеросклероз что может увеличить риск острое сердечно-сосудистое заболевание, Инсульт, и заболевание периферических артерий. Поскольку более высокие уровни ЛПНП в крови - особенно более высокие концентрации ЛПНП и меньший размер частиц ЛПНП - вносят больший вклад в этот процесс, чем содержание холестерина в частицах ЛПВП,[60] Частицы ЛПНП часто называют «плохим холестерином». Высокие концентрации функциональных ЛПВП, которые могут удалять холестерин из клеток и атером, обеспечивают защиту и обычно называются «хорошим холестерином». Этот баланс в основном определяется генетически, но может быть изменен составом тела, лекарства, рацион питания,[61] и другие факторы.[62] Исследование 2007 года показало, что уровень общего холестерина в крови имеет экспоненциальный эффект на сердечно-сосудистую систему и общую смертность, причем эта связь более выражена у молодых людей. Поскольку сердечно-сосудистые заболевания относительно редко встречаются среди молодого населения, влияние высокого холестерина на здоровье больше у пожилых людей.[63]
Повышенные уровни фракций липопротеинов, ЛПНП, IDL и VLDL, а не общий уровень холестерина, коррелируют со степенью и прогрессированием атеросклероза.[64] И наоборот, общий холестерин может быть в пределах нормы, но состоять в основном из небольших частиц ЛПНП и мелких частиц ЛПВП, при которых скорость роста атеромы высока. А постфактум Анализ проспективных исследований IDEAL и EPIC обнаружил связь между высоким уровнем холестерина ЛПВП (с поправкой на аполипопротеин A-I и аполипопротеин B) и повышенным риском сердечно-сосудистых заболеваний, что ставит под сомнение кардиозащитную роль «хорошего холестерина».[65][66]
Один из 250 взрослых может иметь генетическую мутацию рецептора холестерина ЛПНП, которая вызывает у них семейную гиперхолеринемию. Унаследованный высокий уровень холестерина также может включать генетические мутации в гене PCSK9 и гене аполипопротеина B.[67]
Повышенный уровень холестерина лечится строгой диетой, состоящей из продуктов с низким содержанием насыщенных жиров, трансжиров и низким содержанием холестерина,[68][69] часто сопровождается одним из различных гиполипидемические средства, Такие как статины, фибраты, ингибиторы абсорбции холестерина, производные никотиновой кислоты или секвестранты желчных кислот.[70] Существует несколько международных руководств по лечению гиперхолестеринемии.[71]
Испытания на людях с использованием HMG-CoA редуктаза ингибиторы, известные как статины, неоднократно подтверждали, что изменение схемы транспорта липопротеинов с нездоровой на более здоровую значительно снижает частоту сердечно-сосудистых заболеваний, даже у людей, уровень холестерина в настоящее время считается низким для взрослых.[72] Исследования показали, что снижение уровня холестерина ЛПНП примерно на 38,7 мг / дл с помощью статинов может снизить риск сердечно-сосудистых заболеваний и инсульта примерно на 21%.[73] Исследования также показали, что статины уменьшают прогрессирование атеромы.[74] В результате люди с сердечно-сосудистыми заболеваниями в анамнезе могут получить пользу от статинов независимо от уровня холестерина (общий холестерин ниже 5,0 ммоль / л [193 мг / дл]),[75] а у мужчин без сердечно-сосудистых заболеваний есть польза от снижения аномально высокого уровня холестерина («первичная профилактика»).[76] Первичная профилактика у женщин первоначально практиковалась только путем расширения результатов исследований на мужчинах,[77] поскольку у женщин ни одно из крупных исследований статинов, проведенных до 2007 года, не продемонстрировало значительного снижения общей смертности или показателей сердечно-сосудистой системы.[78] Мета-анализ продемонстрировал значительное снижение общей смертности и смертности от сердечно-сосудистых заболеваний без значительной разнородности по полу.[79]
| Уровень | Интерпретация | |
|---|---|---|
| мг /дл | ммоль /L | |
| < 200 | < 5.2 | Желаемый уровень (меньший риск) |
| 200–240 | 5.2–6.2 | Пограничный высокий риск |
| > 240 | > 6.2 | Высокий риск |
Отчет 1987 г. Национальная образовательная программа по холестерину, Группа по лечению взрослых предполагает, что уровень общего холестерина в крови должен быть: <200 мг / дл нормального холестерина в крови, 200–239 мг / дл погранично высокого уровня,> 240 мг / дл высокого холестерина.[80] В Американская Ассоциация Сердца предоставляет аналогичный набор руководящих принципов для уровня общего холестерина (натощак) и риска сердечных заболеваний:[81] Статины эффективны в снижении холестерина ЛПНП и широко используются для первичная профилактика у людей с высоким риском сердечно-сосудистых заболеваний, а также в вторичная профилактика для тех, у кого развились сердечно-сосудистые заболевания.[82]
Более современные методы тестирования определяют холестерин ЛПНП («плохой») и ЛПВП («хороший») отдельно, что позволяет более детально анализировать холестерин. Желательный уровень ЛПНП считается менее 130 мг / дл (2,6 ммоль / Л),[83] хотя новый верхний предел 70 мг / дл (1,8 ммоль / л) может быть рассмотрен для лиц с более высоким риском на основании некоторых из вышеупомянутых исследований. Отношение общего холестерина к ЛПВП - еще один полезный показатель - менее 5: 1 считается более здоровым.

Общий холестерин определяется как сумма HDL, LDL и VLDL. Обычно измеряются только общее количество, ЛПВП и триглицериды. По соображениям стоимости ЛПОНП обычно оценивается как одна пятая от триглицеридов, а ЛПНП оценивается с использованием формулы Фридевальда (или вариант ): оценка ЛПНП = [общий холестерин] - [общий холестерин] - [оценка ЛПОНП]. ЛПОНП можно рассчитать, разделив общее количество триглицеридов на пять. Прямые измерения ЛПНП используются, когда уровень триглицеридов превышает 400 мг / дл. Расчетные значения ЛПОНП и ЛПНП имеют больше ошибок, когда триглицериды выше 400 мг / дл.[84]
в Фрамингемское исследование сердца у субъектов старше 50 лет они обнаружили общее увеличение на 11% и увеличение на 14% смертности от сердечно-сосудистых заболеваний на 1 мг / дл в год снижения общего уровня холестерина. Исследователи связывают это явление с тем, что люди с тяжелыми хроническими заболеваниями или раком, как правило, имеют уровень холестерина ниже нормы.[85] Это объяснение не поддерживается Программой мониторинга и укрепления здоровья Форарльберга, в которой мужчины всех возрастов и женщины старше 50 лет с очень низким уровнем холестерина могли умирать от рака, заболеваний печени и психических заболеваний. Этот результат указывает на то, что эффект низкого уровня холестерина наблюдается даже среди более молодых респондентов, что противоречит предыдущей оценке когорт пожилых людей, что это показатель или маркер дряхлости, возникающей с возрастом.[86]
Хотя существует связь между холестерином и атеросклерозом, как обсуждалось выше, обзор 2014 года пришел к выводу, что недостаточно доказательств, подтверждающих рекомендацию о высоком потреблении полиненасыщенных жирных кислот и низком потреблении общих насыщенных жиров для здоровья сердечно-сосудистой системы.[87] В обзоре 2016 года был сделан вывод о том, что уровень холестерина ЛПВП обратно пропорционален смертности у людей старше 60 лет, и либо не было связи между ЛПНП и смертностью, либо более низкий уровень ЛПНП был связан с более высоким риском смертности, особенно у пожилых людей.[88]
Гипохолестеринемия
Аномально низкий уровень холестерина называют гипохолестеринемия. Исследования причин этого состояния относительно ограничены, но некоторые исследования предполагают связь с депрессия, рак, и кровоизлияние в мозг. В общем, низкий уровень холестерина кажется следствием, а не причиной основного заболевания.[63] Генетический дефект синтеза холестерина вызывает Синдром Смита – Лемли – Опица, что часто связано с низким уровнем холестерина в плазме. Гипертиреоз, или любое другое эндокринное нарушение, которое вызывает усиление регуляции Рецептор ЛПНП, может привести к гипохолестеринемии.[89]
Тест на холестерин
В Американская Ассоциация Сердца рекомендует проверять холестерин каждые 4–6 лет людям в возрасте 20 лет и старше.[90] Отдельный набор Американская Ассоциация Сердца в руководствах, выпущенных в 2013 г. статины Лекарства должны проверяться на холестерин через 4–12 недель после приема первой дозы, а затем каждые 3–12 месяцев.[91]
После 12-часового голодания врач берет образец крови или использует домашнее устройство для контроля холестерина для измерения липидный профиль, подход, используемый для оценки человека липопротеины, гораздо более важная проблема, потому что липопротеины всегда согласовывались с результатами, хотя липидный профиль обычно не согласован. Количество частиц ЛПНП и риск сердечно-сосудистых заболеваний в будущем в исследовании Framingham Offspring.
Липидный профиль измеряет: (а) общий холестерин, (б) холестерин, связанный с частицами ЛПВП (то есть с более высокой плотностью {чем вода} Липиды, переносимые в белках) («которые могут регрессировать артериальное заболевание»), (d) (согласно расчетам и предположениям) холестерин, переносимый частицами ЛПНП (то есть с более низкой плотностью {чем вода} Липиды, переносимые в белках) («которые вызывают артериальные заболевания»).
Рекомендуется проверять холестерин не реже одного раза в пять лет, если у человека общий холестерин 5,2 ммоль / л или более (200+ мг / дл), или если у мужчины старше 45 лет или у женщины старше 50 есть значения ХС-ЛПВП. менее 1 ммоль / л (40 мг / дл), или есть другие причины сердечных заболеваний и инсульта. Дополнительные факторы сердечно-сосудистых заболеваний включают: сахарный диабет, гипертония (или использование антигипертензивные препараты ), низкий уровень ЛПВП, семейный анамнез ишемическая болезнь сердца (CAD) и гиперхолестеринемия, и курение сигарет.[92]
Интерактивная карта проезда
Нажмите на гены, белки и метаболиты ниже, чтобы ссылки на соответствующие статьи. [§ 1]
- ^ Интерактивную карту путей можно редактировать на WikiPathways: "Statin_Pathway_WP430".
Холестерические жидкие кристаллы
Известно, что некоторые производные холестерина (среди других простых холестерических липидов) генерируют жидкокристаллический «холестерическая фаза». Фактически холестерическая фаза хиральный нематическая фаза, и он меняет цвет при изменении температуры. Это делает производные холестерина полезными для индикации температуры в жидкокристаллический дисплей термометры и в термочувствительных красках.[нужна цитата ]
Стереоизомеры
Холестерин имеет 256 стереоизомеры которые возникают из его 8 стереоцентров, хотя только два из стереоизомеров имеют биохимическое значение (нац-холестерин и Ent-холестерин, для естественный и энантиомер, соответственно),[93][94] и только один встречается естественным образом (нац-холестерин).

Смотрите также
- Arcus senilis «Кольцо холестерина» в глазах
- Сердечно-сосудистые заболевания
- Холестериновая эмболия
- Общий синтез холестерина
- Семейная гиперхолестеринемия
- Гиперхолестеринемия "Высокое содержание холестерина"
- Гипохолестеринемия «Низкий холестерин»
- Молекула с лицом Януса
- Список холестерина в продуктах питания
- Болезнь Ниманна – Пика Тип C
- Оксихолестерин
- Остаточный холестерин
Дополнительные изображения

Конвертация единиц холестерина
Стероидогенез, используя холестерин в качестве строительного материала
Модель заполнения пространства молекулы холестерина

Нумерация стероидный препарат ядра
Рекомендации
- ^ а б c «Холестерин, 57-88-5». PubChem, Национальная медицинская библиотека, Национальные институты здравоохранения США. 9 ноября 2019 г.. Получено 14 ноября 2019.
- ^ а б «Данные безопасности (MSDS) для холестерина». Архивировано из оригинал 12 июля 2007 г.. Получено 20 октября 2007.
- ^ Холестерин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- ^ а б Ханукоглу I (декабрь 1992 г.). «Стероидогенные ферменты: структура, функция и роль в регуляции биосинтеза стероидных гормонов». Журнал стероидной биохимии и молекулярной биологии. 43 (8): 779–804. Дои:10.1016/0960-0760(92)90307-5. PMID 22217824. S2CID 112729.
- ^ Разин С., Талли Дж. Г. (май 1970 г.). «Потребность микоплазм в холестерине». Журнал бактериологии. 102 (2): 306–10. Дои:10.1128 / JB.102.2.306-310.1970. ЧВК 247552. PMID 4911537.
- ^ Шеврёль (1816 г.) "Recherches chimiques sur les corps gras, et specificulièrement sur leurs combinaisons avec les alcalis. Sixième mémoire. Examen des graisses d'homme, de mouton, de boeuf, de jaguar et d'oie" (Химические исследования жирных веществ , и особенно об их комбинациях o filippos ine kapios со щелочами. Шестые воспоминания. Исследование человеческого, овечьего, говяжьего, ягуарового и гусиного жира), Annales de Chimie et de Physique, 2 : 339–372. Из стр. 346 : "Je nommerai холестерин, de χολη, bile, et στερεος, solide, la субстанция cristallisée des calcs biliares humains, ... "(я назову холестерин - от χολη (желчь) и στερεος (твердое тело) - кристаллизованное вещество из желчных камней человека ...)
- ^ Олсон Р. Э. (февраль 1998 г.). «Открытие липопротеинов, их роли в транспорте жира и их значения как факторов риска». Журнал питания. 128 (2 доп.): 439S – 443S. Дои:10.1093 / jn / 128.2.439S. PMID 9478044.
- ^ «Национальное обследование здоровья и питания» (PDF). Центр по контролю за заболеваниями США. Получено 28 января 2012.
- ^ Lecerf JM, de Lorgeril M (июль 2011 г.). «Диетический холестерин: от физиологии к сердечно-сосудистому риску». Британский журнал питания. 106 (1): 6–14. Дои:10.1017 / S0007114511000237. PMID 21385506.
- ^ Солиман Г.А. (июнь 2018 г.). «Диетический холестерин и отсутствие данных о сердечно-сосудистых заболеваниях». Питательные вещества. 10 (6): 780. Дои:10.3390 / nu10060780. ЧВК 6024687. PMID 29914176.
- ^ Дюбуа С., Арман М., Мекки Н., Португалия Х., Паули А.М., Бернар П.М. и др. (Ноябрь 1994 г.). «Влияние увеличения количества пищевого холестерина на постпрандиальную липемию и липопротеины у людей». Журнал липидных исследований. 35 (11): 1993–2007. PMID 7868978.
- ^ Берман Э.Дж., Гопалан В. (2005). Scovell WM (ред.). «Холестерин и растения». Журнал химического образования. 82 (12): 1791. Bibcode:2005JChEd..82.1791B. Дои:10.1021 / ed082p1791.
- ^ Джон С., Сорокин А.В., Томпсон П.Д. (февраль 2007 г.). «Фитостерины и сосудистые заболевания». Текущее мнение в липидологии. 18 (1): 35–40. Дои:10.1097 / MOL.0b013e328011e9e3. PMID 17218830. S2CID 29213889.
- ^ Джеш Э.Д., Карр Т.П. (июнь 2017 г.). «Пищевые ингредиенты, ингибирующие абсорбцию холестерина». Профилактическое питание и пищевые науки. 22 (2): 67–80. Дои:10.3746 / pnf.2017.22.2.67. ЧВК 5503415. PMID 28702423.
- ^ Agren JJ, Tvrzicka E, Nenonen MT, Helve T, Hänninen O (февраль 2001 г.). «Дивергентные изменения стеринов в сыворотке крови при соблюдении строгой веганской диеты без тепловой обработки у пациентов с ревматоидным артритом». Британский журнал питания. 85 (2): 137–9. Дои:10.1079 / BJN2000234. PMID 11242480.
- ^ Садава Д., Хиллис Д.М., Хеллер Х.С., Беренбаум М.Р. (2011). Жизнь: Наука биологии, 9-е издание. Сан-Франциско: Фриман. С. 105–114. ISBN 978-1-4292-4646-0.
- ^ Охво-Рекиля Х, Рамштедт Б., Леппимяки П., Слотте Дж. П. (январь 2002 г.). «Взаимодействие холестерина с фосфолипидами в мембранах». Прогресс в исследованиях липидов. 41 (1): 66–97. Дои:10.1016 / S0163-7827 (01) 00020-0. PMID 11694269.
- ^ Йигл П.Л. (октябрь 1991 г.). «Модуляция функции мембраны холестерином». Биохимия. 73 (10): 1303–10. Дои:10.1016 / 0300-9084 (91) 90093-Г. PMID 1664240.
- ^ Haines TH (июль 2001 г.). «Уменьшают ли стеролы утечку протонов и натрия через липидные бислои?». Прогресс в исследованиях липидов. 40 (4): 299–324. Дои:10.1016 / S0163-7827 (01) 00009-1. PMID 11412894.
- ^ Петерсен Э. Н., Чунг Х. В., Наебосадри А., Хансен С. Б. (декабрь 2016 г.). «Кинетическое разрушение липидных рафтов - механосенсор фосфолипазы D». Nature Communications. 7: 13873. Bibcode:2016НатКо ... 713873P. Дои:10.1038 / ncomms13873. ЧВК 5171650. PMID 27976674.
- ^ Incardona JP, Eaton S (апрель 2000 г.). «Холестерин в сигнальной трансдукции». Текущее мнение в области клеточной биологии. 12 (2): 193–203. Дои:10.1016 / S0955-0674 (99) 00076-9. PMID 10712926.
- ^ Павлина В., Росс М. В. (2006). Гистология: текст и атлас: взаимосвязанная клеточная и молекулярная биология. Филадельфия: Lippincott Wiliams & Wilkins. п. 230. ISBN 978-0-7817-5056-1.
- ^ Левитан I, Сингх Д.К., Розенхаус-Данцкер А (2014). «Связывание холестерина с ионными каналами». Границы физиологии. 5: 65. Дои:10.3389 / fphys.2014.00065. ЧВК 3935357. PMID 24616704.
- ^ а б c Вэй В., Швайд А.Г., Ван Х, Ван Х, Чен С., Чу Кью и др. (Март 2016 г.). «Активация лиганда ERRα холестерином опосредует эффекты статина и бисфосфоната». Клеточный метаболизм. 23 (3): 479–91. Дои:10.1016 / j.cmet.2015.12.010. ЧВК 4785078. PMID 26777690.
- ^ а б c d Ядерные рецепторы в развитии и заболевании. Elsevier Science. 17 мая 2017. С. 88–. ISBN 978-0-12-802196-5.
- ^ Payne AH, Hales DB (декабрь 2004 г.). «Обзор стероидогенных ферментов на пути от холестерина к активным стероидным гормонам». Эндокринные обзоры. 25 (6): 947–70. Дои:10.1210 / er.2003-0030. PMID 15583024.
- ^ Кон Дж. С., Камили А., Ват Э, Чанг Р. В., Тэнди С. (февраль 2010 г.). «Диетические фосфолипиды и абсорбция холестерина в кишечнике». Питательные вещества. 2 (2): 116–27. Дои:10.3390 / nu2020116. ЧВК 3257636. PMID 22254012.
- ^ «Как это сделано: производство холестерина в вашем теле». Harvard Health Publishing. Получено 18 октября 2018.
- ^ а б «Биосинтез и регуляция холестерина (с анимацией)». PharmaXChange.info. 17 сентября 2013 г.
- ^ Берг Дж. (2002). Биохимия. Нью-Йорк: WH Freeman. ISBN 978-0-7167-3051-4.
- ^ Родос К.М., Страйер Л., Таскер Р. (1995). Биохимия (4-е изд.). Сан-Франциско: W.H. Фримен. С. 280, 703. ISBN 978-0-7167-2009-6.
- ^ "Нобелевская премия по физиологии и медицине 1964 г.". = Нобелевская премия, Nobel Media.
- ^ Эспеншад П.Дж., Хьюз А.Л. (2007). «Регуляция синтеза стеролов у эукариот». Ежегодный обзор генетики. 41: 401–27. Дои:10.1146 / annurev.genet.41.110306.130315. PMID 17666007.
- ^ Браун М.С., Гольдштейн Дж. Л. (май 1997 г.). «Путь SREBP: регуляция метаболизма холестерина путем протеолиза мембраносвязанного фактора транскрипции». Клетка. 89 (3): 331–40. Дои:10.1016 / S0092-8674 (00) 80213-5. PMID 9150132. S2CID 17882616.
- ^ а б Тимочко Дж. Л., Берг Т., Страйер Л., Берг Дж. М. (2002). Биохимия. Сан-Франциско: W.H. Фримен. стр.726–727. ISBN 978-0-7167-4955-4.
- ^ а б c d е ж грамм Паттон К.Т., Тибодо Г.А. (2010). Анатомия и психология (7-е изд.). Мосби / Эльзевьер. ISBN 978-9996057762. Получено 20 марта 2019.
- ^ Mahley RW (июль 2016 г.). «Аполипопротеин E: от сердечно-сосудистых заболеваний до нейродегенеративных заболеваний». Журнал молекулярной медицины. 94 (7): 739–46. Дои:10.1007 / s00109-016-1427-y. ЧВК 4921111. PMID 27277824.
- ^ Weingärtner O, Pinsdorf T, Rogacev KS, Blömer L, Grenner Y, Gräber S и др. (Октябрь 2010 г.). Федеричи М (ред.). «Взаимосвязь маркеров гомеостаза холестерина с толщиной интима-медиа сонной артерии». PLOS ONE. 5 (10): e13467. Bibcode:2010PLoSO ... 513467W. Дои:10.1371 / journal.pone.0013467. ЧВК 2956704. PMID 20976107.
- ^ Льюис Г.Ф., Рейдер DJ (июнь 2005 г.). «Новое понимание регуляции метаболизма ЛПВП и обратного транспорта холестерина». Циркуляционные исследования. 96 (12): 1221–32. Дои:10.1161 / 01.RES.0000170946.56981.5c. PMID 15976321.
- ^ Гордон Д. Д., Пробстфилд Д. Л., Гаррисон Р. Д., Нитон Д. Д., Кастелли В. П., Нок Д. Д. и др. (Январь 1989 г.). «Холестерин липопротеинов высокой плотности и сердечно-сосудистые заболевания. Четыре проспективных американских исследования». Тираж. 79 (1): 8–15. Дои:10.1161 / 01.CIR.79.1.8. PMID 2642759.
- ^ Кандуч А.А., Чен Х.В., Хейнигер Х.Д. (август 1978 г.). «Биологическая активность некоторых оксигенированных стеринов». Наука. 201 (4355): 498–501. Bibcode:1978Научный ... 201..498K. Дои:10.1126 / science.663671. PMID 663671.
- ^ Рассел Д.В. (декабрь 2000 г.). «Ферменты биосинтеза оксистерина». Biochimica et Biophysica Acta (BBA) - молекулярная и клеточная биология липидов. 1529 (1–3): 126–35. Дои:10.1016 / S1388-1981 (00) 00142-6. PMID 11111082.
- ^ Ханукоглу И., Джефкоат ЧР (1980). «Отделение прегненолона от холестерина с использованием мини-колонок Sephadex LH-20». Журнал хроматографии А. 190 (1): 256–262. Дои:10.1016 / S0021-9673 (00) 85545-4.
- ^ Джавитт Н.Б. (декабрь 1994 г.). «Синтез желчных кислот из холестерина: регуляторные и вспомогательные пути». Журнал FASEB. 8 (15): 1308–11. Дои:10.1096 / fasebj.8.15.8001744. PMID 8001744. S2CID 20302590.
- ^ Wolkoff AW, Cohen DE (февраль 2003 г.). «Желчные кислоты регуляции физиологии печени: I. Гепатоцитарный транспорт желчных кислот». Американский журнал физиологии. Физиология желудочно-кишечного тракта и печени. 284 (2): G175-9. Дои:10.1152 / ajpgi.00409.2002. PMID 12529265.
- ^ Маршалл Х.Ю., Эйнарссон К. (июнь 2007 г.). «Желчнокаменная болезнь». Журнал внутренней медицины. 261 (6): 529–42. Дои:10.1111 / j.1365-2796.2007.01783.x. PMID 17547709. S2CID 8609639.
- ^ Випперман М.Ф., Сэмпсон Н.С., Томас С.Т. (2014). «Возбудитель ярости: использование холестерина микобактериями туберкулеза». Критические обзоры в биохимии и молекулярной биологии. 49 (4): 269–93. Дои:10.3109/10409238.2014.895700. ЧВК 4255906. PMID 24611808.
- ^ Томас С.Т., Сэмпсон Н.С. (апрель 2013 г.). «Mycobacterium tuberculosis использует уникальную гетеротетрамерную структуру для дегидрирования боковой цепи холестерина». Биохимия. 52 (17): 2895–904. Дои:10.1021 / bi4002979. ЧВК 3726044. PMID 23560677.
- ^ Випперман М.Ф., Ян М., Томас С.Т., Сэмпсон Н.С. (октябрь 2013 г.). «Сокращение протеома FadE Mycobacterium tuberculosis: понимание метаболизма холестерина посредством идентификации семейства α2β2-гетеротетрамеров ацилкофермент A дегидрогеназы». Журнал бактериологии. 195 (19): 4331–41. Дои:10.1128 / JB.00502-13. ЧВК 3807453. PMID 23836861.
- ^ Уильям В. С. (2003). Анализ липидов: выделение, разделение, идентификация и структурный анализ липидов. Эр, Шотландия: Oily Press. ISBN 978-0-9531949-5-7.
- ^ а б «Содержание холестерина в пищевых продуктах, ранжирование на 100 г; В: Базы данных о составе пищевых продуктов Министерства сельского хозяйства США». Министерство сельского хозяйства США. 2019 г.. Получено 4 марта 2019.
- ^ Дженсен Р.Г., Хагерти М.М., МакМахон К.Э. (июнь 1978 г.). «Липиды грудного молока и детских смесей: обзор». Американский журнал клинического питания. 31 (6): 990–1016. Дои:10.1093 / ajcn / 31.6.990. PMID 352132.
- ^ Sonawane PD, Pollier J, Panda S, Szymanski J, Massalha H, Yona M и др. (Декабрь 2016 г.). «Путь биосинтеза холестерина растений перекрывается метаболизмом фитостерина». Природа Растения. 3 (1): 16205. Дои:10.1038 / nplants.2016.205. PMID 28005066. S2CID 5518449.
- ^ Де Смет Э, Менсинк РП, Плат J (июль 2012 г.). «Влияние растительных стеролов и станолов на метаболизм холестерина в кишечнике: предполагаемые механизмы из прошлого в настоящее». Молекулярное питание и пищевые исследования. 56 (7): 1058–72. Дои:10.1002 / mnfr.201100722. PMID 22623436.
- ^ Европейское агентство по безопасности пищевых продуктов, журнал (2010). «Научное заключение по обоснованию заявлений о пользе для здоровья в отношении растительных стеролов и растительных станолов и поддержания нормальной концентрации холестерина в крови».
- ^ «Рекомендации по питанию на 2015–2020 годы: ответы на ваши вопросы. Что такое« схемы питания »и почему в рекомендациях по питанию на 2015–2020 годы они сосредоточены на них?». ChooseMyPlate.gov, Министерство сельского хозяйства США. Январь 2016. Получено 17 февраля 2017.
- ^ Солиман Г.А. (июнь 2018 г.). «Диетический холестерин и отсутствие данных о сердечно-сосудистых заболеваниях». Питательные вещества. 10 (6): 780. Дои:10.3390 / nu10060780. PMID 29914176.
- ^ Рас RT, Гелейнсе Дж. М., Траутвейн Е. А. (июль 2014 г.). «Эффект снижения холестерина ЛПНП растительных стеролов и станолов в различных диапазонах доз: метаанализ рандомизированных контролируемых исследований». Британский журнал питания. 112 (2): 214–9. Дои:10.1017 / S0007114514000750. ЧВК 4071994. PMID 24780090.
- ^ Weingärtner O, Böhm M, Laufs U (февраль 2009 г.). «Спорная роль эфиров растительных стеролов в лечении гиперхолестеринемии». Европейский журнал сердца. 30 (4): 404–9. Дои:10.1093 / eurheartj / ehn580. ЧВК 2642922. PMID 19158117.
- ^ Брунзель Дж. Д., Дэвидсон М., Фурберг С. Д., Голдберг РБ, Ховард Б. В., Штейн Дж. Х., Витцтум Дж. Л. (апрель 2008 г.). «Управление липопротеинами у пациентов с кардиометаболическим риском: согласованное заявление Американской диабетической ассоциации и Фонда Американского колледжа кардиологов». Уход за диабетом. 31 (4): 811–22. Дои:10.2337 / dc08-9018. PMID 18375431.
- ^ Департамент здравоохранения (Великобритания), NHS Choices "Еще одно свидетельство в пользу средиземноморской диеты". 8 марта 2011 г. Дата доступа: 11 ноября 2015 г.
- ^ Даррингтон П. (август 2003 г.). «Дислипидемия». Ланцет. 362 (9385): 717–31. Дои:10.1016 / S0140-6736 (03) 14234-1. PMID 12957096. S2CID 208792416.
- ^ а б Льюингтон С., Уитлок Дж., Кларк Р., Шерликер П., Эмберсон Дж., Холси Дж. И др. (Декабрь 2007 г.). «Холестерин в крови и смертность от сосудов по возрасту, полу и артериальному давлению: метаанализ индивидуальных данных из 61 проспективного исследования с 55 000 случаев смерти от сосудов». Ланцет. 370 (9602): 1829–39. Дои:10.1016 / S0140-6736 (07) 61778-4. PMID 18061058. S2CID 54293528.
- ^ «Обнаружение, оценка и лечение повышенного холестерина в крови у взрослых (Группа лечения взрослых III), заключительный отчет» (PDF). Национальные институты здоровья. Национальный институт сердца, легких и крови. 1 сентября 2002 г.. Получено 27 октября 2008.
- ^ ван дер Стиг WA, Holme I, Boekholdt SM, Larsen ML, Lindahl C, Stroes ES, et al. (Февраль 2008 г.). «Холестерин липопротеинов высокой плотности, размер частиц липопротеинов высокой плотности и аполипопротеин A-I: значение для сердечно-сосудистого риска: исследования IDEAL и EPIC-Norfolk». Журнал Американского колледжа кардиологии. 51 (6): 634–42. Дои:10.1016 / j.jacc.2007.09.060. PMID 18261682.
- ^ Робинсон Дж. Г., Ван С., Якобсон Т. А. (ноябрь 2012 г.). «Метаанализ сравнения эффективности снижения уровня аполипопротеина B по сравнению с холестерином липопротеинов низкой плотности и холестерином липопротеинов невысокой плотности для снижения риска сердечно-сосудистых заболеваний в рандомизированных исследованиях». Американский журнал кардиологии. 110 (10): 1468–76. Дои:10.1016 / j.amjcard.2012.07.007. PMID 22906895.
- ^ «Семейная гиперхолестеринемия (СГ)». www.heart.org. Получено 2 августа 2019.
- ^ «Как я могу снизить высокий уровень холестерина» (PDF). Американская Ассоциация Сердца. Архивировано из оригинал (PDF) 21 декабря 2015 г.. Получено 3 апреля 2011.
- ^ «Болезни и состояния. Высокий холестерин: оливковое масло, продукты с добавлением растительных стеролов или станолов, другие изменения в вашем рационе». Клиника Майо. 2012 г.. Получено 11 ноября 2015.
- ^ Национальный институт здравоохранения и клинического совершенства. Клиническое руководство 67: Модификация липидов. Лондон, 2008 год.
- ^ Манну Г.С., Заман М.Дж., Гупта А., Рехман Х.Ю., Мьинт П.К. (октябрь 2012 г.). «Обновление рекомендаций по лечению гиперхолестеринемии». Экспертный обзор сердечно-сосудистой терапии. 10 (10): 1239–49. Дои:10.1586 / erc.12.94. PMID 23190064. S2CID 5451203.
- ^ Kizer JR, Madias C, Wilner B, Vaughan CJ, Mushlin AI, Trushin P и др. (Май 2010 г.). «Связь различных показателей холестерина липопротеинов низкой плотности с риском ишемической болезни сердца и смерти в мета-регрессионном анализе крупномасштабных испытаний терапии статинами». Американский журнал кардиологии. 105 (9): 1289–96. Дои:10.1016 / j.amjcard.2009.12.051. ЧВК 2917836. PMID 20403481.
- ^ Гранди С.М., Стоун Н.Дж., Бейли А.Л., Луч C, Биртчер К.К., Блюменталь Р.С. и др. (Июнь 2019). "2018 AHA / ACC / AACVPR / AAPA / ABC / ACPM / ADA / AGS / APhA / ASPC / NLA / PCNA Руководство по контролю холестерина в крови: отчет Американского колледжа кардиологов / Целевой группы Американской кардиологической ассоциации по клинической практике Руководящие указания". Тираж. 139 (25): e1082 – e1143. Дои:10.1161 / CIR.0000000000000625. ЧВК 7403606. PMID 30586774.
- ^ Николлс SJ (август 2008 г.). «Розувастатин и прогрессирование атеросклероза». Экспертный обзор сердечно-сосудистой терапии. 6 (7): 925–33. Дои:10.1586/14779072.6.7.925. PMID 18666843. S2CID 46419583.
- ^ Совместная группа по изучению защиты сердца (июль 2002 г.). «MRC / BHF Heart Protection Study по снижению холестерина с помощью симвастатина у 20 536 человек из группы высокого риска: рандомизированное плацебо-контролируемое исследование». Ланцет. 360 (9326): 7–22. Дои:10.1016 / S0140-6736 (02) 09327-3. PMID 12114036. S2CID 35836642.
- ^ Шеперд Дж., Коббе С.М., Форд I, Айлз К.Г., Лоример А.Р., Макфарлейн П.В. и др. (Ноябрь 1995 г.). «Профилактика ишемической болезни сердца с помощью правастатина у мужчин с гиперхолестеринемией. Западная группа исследования коронарной профилактики Шотландии». Медицинский журнал Новой Англии. 333 (20): 1301–7. Дои:10.1056 / NEJM199511163332001. PMID 7566020.
- ^ Гранди С.М. (май 2007 г.). «Следует ли предлагать женщинам препараты, снижающие уровень холестерина, для предотвращения сердечно-сосудистых заболеваний? Да». BMJ. 334 (7601): 982. Дои:10.1136 / bmj.39202.399942.AD. ЧВК 1867899. PMID 17494017.
- ^ Кендрик М (май 2007 г.). «Следует ли предлагать женщинам препараты, снижающие уровень холестерина, для предотвращения сердечно-сосудистых заболеваний? Нет».. BMJ. 334 (7601): 983. Дои:10.1136 / bmj.39202.397488.AD. ЧВК 1867901. PMID 17494018.
- ^ Брюгц Дж. Дж., Йетгин Т., Хукс С.Е., Готто А.М., Шеперд Дж., Вестендорп Р.Г. и др. (Июнь 2009 г.). «Преимущества статинов у людей без установленных сердечно-сосудистых заболеваний, но с факторами риска сердечно-сосудистых заболеваний: метаанализ рандомизированных контролируемых исследований». BMJ. 338: b2376. Дои:10.1136 / bmj.b2376. ЧВК 2714690. PMID 19567909.
- ^ «Отчет Группы экспертов Национальной образовательной программы по холестерину по обнаружению, оценке и лечению повышенного уровня холестерина в крови у взрослых. Группа экспертов». Архивы внутренней медицины. 148 (1): 36–69. Январь 1988 г. Дои:10.1001 / archinte.148.1.36. PMID 3422148.
- ^ «Холестерин». Американская Ассоциация Сердца. 30 апреля 2017 г.. Получено 22 марта 2019.
- ^ Alenghat FJ, Davis AM (февраль 2019 г.). «Управление холестерином в крови». JAMA. 321 (8): 800–801. Дои:10.1001 / jama.2019.0015. ЧВК 6679800. PMID 30715135.
- ^ «О холестерине». Американская Ассоциация Сердца.
- ^ Варник Г. Р., Кнопп Р. Х., Фицпатрик В., Брэнсон Л. (январь 1990 г.). «Оценка холестерина липопротеидов низкой плотности по уравнению Фридевальда подходит для классификации пациентов на основе рекомендуемых в стране пороговых значений». Клиническая химия. 36 (1): 15–9. Дои:10.1093 / Clinchem / 36.1.15. PMID 2297909.
- ^ Андерсон К.М., Кастелли В.П., Леви Д. (апрель 1987 г.). «Холестерин и смертность. 30 лет наблюдения из Фрамингемского исследования». JAMA. 257 (16): 2176–80. Дои:10.1001 / jama.257.16.2176. PMID 3560398.
- ^ Ulmer H, Kelleher C, Diem G, Concin H (2004).«Почему Ева не Адам: проспективное наблюдение за 149650 женщинами и мужчинами по поводу холестерина и других факторов риска, связанных с сердечно-сосудистыми заболеваниями и смертностью от всех причин». Журнал женского здоровья. 13 (1): 41–53. Дои:10.1089/154099904322836447. PMID 15006277.
- ^ Чоудхури Р., Варнакула С., Кунуцор С., Кроу Ф., Уорд Х.А., Джонсон Л. и др. (Март 2014 г.). «Связь пищевых, циркулирующих и дополнительных жирных кислот с риском коронарного русла: систематический обзор и метаанализ». Анналы внутренней медицины. 160 (6): 398–406. Дои:10.7326 / M13-1788. PMID 24723079.
- ^ Равнсков У., Даймонд Д.М., Хама Р., Хамазаки Т., Хаммаршельд Б., Хайнс Н. и др. (Июнь 2016). «Отсутствие ассоциации или обратной связи между холестерином липопротеинов низкой плотности и смертностью среди пожилых людей: систематический обзор». BMJ Open. 6 (6): e010401. Дои:10.1136 / bmjopen-2015-010401. ЧВК 4908872. PMID 27292972.
- ^ Резюме Ризоса, Элизаф М.С., Либеропулос EN (24 февраля 2011 г.). «Влияние дисфункции щитовидной железы на липидный профиль». Открытый журнал сердечно-сосудистой медицины. 5 (1): 76–84. Дои:10.2174/1874192401105010076. ЧВК 3109527. PMID 21660244.
- ^ «Как проверить уровень холестерина». Американская Ассоциация Сердца. Получено 10 июля 2013.
- ^ Стоун, штат Нью-Джерси, Робинсон Дж, Гофф, округ Колумбия (2013). «Ознакомление с Руководством». Американский колледж кардиологии. Архивировано из оригинал 7 июля 2014 г.. Получено 2 апреля 2014.
- ^ «Последствия недавних клинических испытаний для рекомендаций ATP III». Национальный институт сердца, легких и крови. Архивировано из оригинал 2 февраля 2014 г.. Получено 2014-01-27.
- ^ Вестовер Э.Дж., Кови Д.Ф., Брокман Х.Л., Браун Р.Э., Пайк Л.Дж. (декабрь 2003 г.). «Истощение запасов холестерина приводит к сайт-специфическому увеличению фосфорилирования рецептора эпидермального фактора роста из-за эффектов на уровне мембраны. Исследования с энантиомерами холестерина». Журнал биологической химии. 278 (51): 51125–33. Дои:10.1074 / jbc.M304332200. ЧВК 2593805. PMID 14530278.
- ^ Кристиана И., Луу В., Стивенсон Дж., Картланд С., Джессап В., Белани Дж. Д. и др. (Сентябрь 2012 г.). «Холестерин через зеркало: способность его энантиомера также вызывать гомеостатические реакции». Журнал биологической химии. 287 (40): 33897–904. Дои:10.1074 / jbc.M112.360537. ЧВК 3460484. PMID 22869373.





