Сакситоксин - Saxitoxin
 | |||
| |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК [(3aS,4р, 10аS) -10,10-дигидрокси-2,6-дииминооктагидро-1ЧАС,8ЧАС-пирроло [1,2-c] пурин-4-ил] метилкарбамат | |||
| Идентификаторы | |||
3D модель (JSmol ) | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.160.395 | ||
| КЕГГ | |||
PubChem CID | |||
| UNII | |||
| |||
| |||
| Свойства | |||
| C10ЧАС17N7О4 | |||
| Молярная масса | 299.291 г · моль−1 | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Сакситоксин (STX) является мощным нейротоксин и самые известные паралитические моллюски токсин (ТИХООКЕАНСКОЕ СТАНДАРТНОЕ ВРЕМЯ). Проглатывание сакситоксина людьми, обычно при употреблении в пищу моллюсков, загрязненных токсичными цветение водорослей, несет ответственность за болезнь, известную как паралитическое отравление моллюсками (PSP).
Термин сакситоксин происходит от названия рода масличных моллюсков (Саксидомус ), из которого он был впервые изолирован. Но термин сакситоксин может также относиться ко всему набору из более чем 50 структурно связанных нейротоксинов (известных под общим названием «сакситоксины»), продуцируемых водорослями и цианобактериями, включая сам сакситоксин (STX), неосакситоксин (NSTX), гониутоксины (GTX) и декарбамоилсакситоксин (dcSTX).
Сакситоксин оказывает большое влияние на окружающую среду и экономику, поскольку его присутствие в двустворчатых моллюсках, таких как моллюски, моллюски, устрицы и гребешки часто приводит к запретам на коммерческий и развлекательный промысел моллюсков во многих прибрежных водах с умеренным климатом по всему миру, включая северо-восток и запад Соединенных Штатов, западную Европу, Восточную Азию, Австралию, Новую Зеландию и Южную Африку. В США паралитическое отравление моллюсками произошло в Калифорния, Орегон, Вашингтон, Аляска, и Новая Англия.
Источник в природе
Сакситоксин - это нейротоксин естественно производятся некоторыми видами морских динофлагелляты (Александрий sp., Гимнодиниум sp., Пиродиниум sp.) и пресноводный цианобактерии (Анабаена sp., некоторые Афанизоменон виды, Цилиндроспермопсис sp., Lyngbya sp., Планктотрикс sp.)[1][2] Сакситоксин накапливается, в частности, в двустворчатых фильтраторах.
Сакситоксин также был обнаружен как минимум в 12 морских рыба фугу виды в Азии и одна пресноводная рыба тилапия в Бразилии.[3] Однако окончательный источник STX часто остается неясным. Динофлагеллята Pyrodinium bahamense источник STX находится в Флорида.[4][5] Недавние исследования показывают обнаружение STX в коже, мышцах, внутренних органах и гонадах «Индийская речная лагуна Южная рыба фугу, с самой высокой концентрацией (22 104 мкг STX-экв / 100 г ткани), измеренной в яичники. Даже после года плена кожная слизь оставалась очень токсичной.[6] Концентрации в рыбе фугу из США аналогичны концентрациям, обнаруженным на Филиппинах, в Таиланде,[5] Япония,[5][7] и страны Южной Америки.[8] Рыба-фугу также накапливает токсин, отличающийся по своей структуре. тетродотоксин.
Структура и синтез
Дигидрохлорид сакситоксина представляет собой аморфное гигроскопичное твердое вещество, но Рентгеновская кристаллография кристаллических производных позволили определить структуру сакситоксина.[9][10] Окисление сакситоксина приводит к образованию производного пурина с высокой флуоресценцией, которое используется для обнаружения его присутствия.[11]
Было выполнено несколько полных синтезов сакситоксина.[12][13][14]
Механизм действия

Сакситоксин - это нейротоксин, который действует как селективный, обратимый блокатор потенциал-управляемых натриевых каналов.[15][16] Один из самых сильных известных природных токсинов, он действует на потенциалзависимые натриевые каналы нейроны, препятствуя нормальному функционированию клеток и приводя к паралич.
Напряжение-управляемые натриевые каналы необходимы для нормального функционирования нейронов. Он существует как интегральные мембранные белки вперемешку с аксон нейрона и обладающий четырьмя доменами, которые охватывают клеточная мембрана. Открытие потенциалозависимого натриевого канала происходит при изменении Напряжение или несколько лиганд связывает правильным образом. Чрезвычайно важно, чтобы эти натриевые каналы функционировали должным образом, поскольку они необходимы для распространения потенциал действия. Без этой способности нервная клетка становится неспособной передавать сигналы, и область тела, которую она обессиливает, оказывается отрезанной от нервная система. Это может привести к параличу пораженной области, как в случае с сакситоксином.
Сакситоксин обратимо связывается с натриевым каналом. Он связывается непосредственно в поре белка канала, закрывая отверстие и препятствуя прохождению ионов натрия через мембрану. Это приводит к нервному отключению, описанному выше.
Биосинтез
Хотя биосинтез сакситоксина кажется сложным, организмы двух разных королевства действительно два разных домены, виды морских динофлагелляты и пресная вода цианобактерии, способны производить эти токсины. В то время как преобладающая теория производства динофлагеллят происходила через симбиотические мутуализм с цианобактериями появились свидетельства того, что динофлагелляты сами по себе также обладают гены требуется для синтеза сакситоксина.[17]
Биосинтез сакситоксина - первый нетерпеновый алкалоид путь описан для бактерий, хотя точный механизм биосинтеза сакситоксина все еще остается теоретической моделью. Точный механизм того, как субстраты связываются с ферменты до сих пор неизвестен, а гены, участвующие в биосинтезе сакситоксина, либо предполагаются, либо были идентифицированы только недавно.[17][18]
В прошлом было предложено два биосинтеза. Более ранние версии отличаются от более позднего предложения Келлманна и др. основано как на биосинтетических соображениях, так и на генетических доказательствах, недоступных на момент первого предложения. Более поздняя модель описывает кластер генов STX (sxt), используемый для получения более благоприятной реакции. Самая последняя последовательность реакций Sxt у цианобактерий[18] составляет. Обратитесь к диаграмме для получения подробного описания биосинтеза и промежуточных структур.
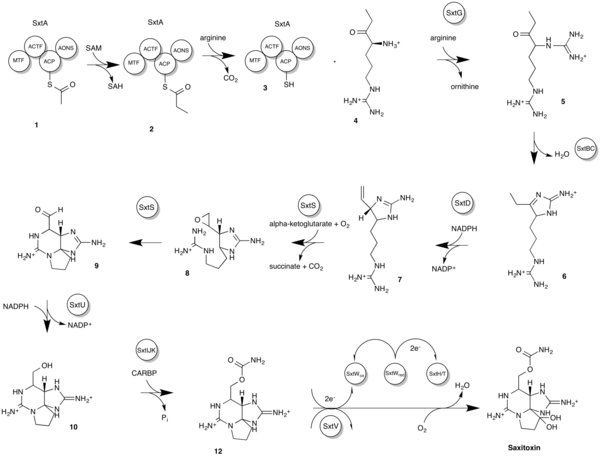
- Он начинается с загрузки белок-носитель ацила (ACP) с ацетатом из ацетил-КоА, давая промежуточное звено 1.
- За этим следует катализируемое SxtA метилирование ацетил-ACP, которое затем превращается в пропионил-ACP, давая промежуточное соединение 2.
- Позже другой SxtA выполняет Клейзеновская конденсация реакция между пропионил-ACP и аргинин производя промежуточное звено 4 и промежуточное звено 3.
- SxtG переносит амидиногруппу от аргинина к α-аминогруппе промежуточного соединения 4, продуцируя промежуточное соединение 5.
- Промежуточное соединение 5 затем подвергается ретроальдольной конденсации под действием SxtBC, давая промежуточное соединение 6.
- SxtD добавляет двойную связь между C-1 и C-5 промежуточного соединения 6, что вызывает сдвиг 1,2-H между C-5 и C-6 в промежуточном соединении 7.
- SxtS выполняет эпоксидирование двойной связи с образованием промежуточного соединения 8, а затем раскрытие эпоксида на альдегид, образуя промежуточное звено 9.
- SxtU восстанавливает концевую альдегидную группу промежуточного соединения 9 STX, образуя таким образом промежуточное соединение 10.
- SxtIJK катализирует перенос карбамоильной группы к свободной гидроксильной группе промежуточного соединения 10, образуя промежуточное соединение 11.
- SxtH и SxtT, вместе с SxtV и кластером генов SxtW, выполняют аналогичную функцию, которая заключается в последовательном гидроксилировании C-12, таким образом продуцируя сакситоксин и завершая путь биосинтеза STX.
Болезнь и отравление
Токсикология
Сакситоксин очень токсичен для морские свинки смертельный исход при дозе 5 мкг / кг вводится внутримышечно. Смертельные дозы (LD50 ) для мышей очень похожи с разными путями введения: i.v. составляет 3,4 мкг / кг, i.p. составляет 10 мкг / кг и п.о. составляет 263 мкг / кг. Пероральная LD50 для человека составляет 5,7 мкг / кг, поэтому примерно 0,57 мг сакситоксина (1/8 песчинки среднего размера) является летальным при проглатывании, а летальная доза при инъекции составляет примерно 1/10 от этой дозы (примерно 0,6 мкг / кг). Ингаляционная токсичность человека аэрозольный сакситоксин оценивается в 5 мг · мин / м³. Сакситоксин может попадать в организм через открытые раны, и была предложена смертельная доза 50 мкг на человека при использовании этого пути.[19]
Болезнь у человека
Болезнь человека, связанная с приемом вредных уровней сакситоксина, известна как паралитическое отравление моллюсками, или PSP, а сакситоксин и его производные часто называют «токсинами PSP».[1]
Важность сакситоксина для медицины и окружающей среды обусловлена потреблением загрязненных моллюски и некоторые виды рыб, которые могут концентрировать токсин динофлагеллят или цианобактерий. Блокировка нейронов натриевые каналы что происходит в PSP, производит вялый паралич который оставляет свою жертву спокойной и сознательной благодаря прогрессированию симптомы. Смерть часто наступает от нарушение дыхания. Токсины PSP были причастны к гибели различных морских животных, включая: трофический перенос токсина из источника водорослей вверх по пищевой цепи на более высокие хищники.
Исследования на животных показали, что летальные эффекты сакситоксина можно обратить вспять с помощью 4-аминопиридин,[20][21][22] но исследований на людях нет. Как и в случае с любым паралитическим агентом, реанимация «рот в рот» или искусственная вентиляция с использованием любых средств сохранят отравленную жертву в живых до тех пор, пока не будет введено противоядие или пока яд не исчезнет.
Военный интерес
Сакситоксин, в силу его чрезвычайно низкого LD50, легко поддается оружию. В прошлом он рассматривался для использования в военных целях Соединенными Штатами и был разработан как химическое оружие посредством Военные США.[23] Известно, что сакситоксин был разработан как для открытого военного использования, так и для тайных целей. ЦРУ.[24] Среди запасов оружия были боеприпасы M1, содержащие либо сакситоксин, либо ботулинический токсин или их смесь.[25] С другой стороны, известно, что ЦРУ выдало небольшую дозу сакситоксина пилоту самолета-разведчика U-2. Фрэнсис Гэри Пауэрс в виде небольшой инъекции, спрятанной в серебряном долларе, для использования в случае его поимки и задержания.[24][25]
После запрета 1969 г. биологическая война Президентом Никсон, американские запасы сакситоксина были уничтожены, и разработка сакситоксина как военного оружия прекратилась.[26] Однако в 1975 году ЦРУ сообщило Конгрессу, что оно хранило небольшое количество сакситоксина и яда кобры против приказов Никсона, которое затем было уничтожено или передано исследователям.[24]
Он указан в график 1 из Конвенция о химическом оружии. Военные США выделили сакситоксин и назначили ему обозначение химического оружия TZ.
Смотрите также
- Канадские справочные материалы
- Потенциал действия
- Александрий тамаренс
- Анабаена циркиналис
- Вредное цветение водорослей
- Паралитическое отравление моллюсками
- Бреветоксин
- Цигуатоксин
- Домоевая кислота
- Окадаиновая кислота
- Тетродотоксин
использованная литература
- ^ а б Clark R. F .; Уильямс С.Р .; Nordt S.P .; Маногуэрра А. С. (1999). «Обзор отдельных отравлений морепродуктами». Подводный гиперболт. 26 (3): 175–84. PMID 10485519. Получено 2008-08-12.
- ^ Ландсберг, Ян Х. (2002). «Влияние вредоносного цветения водорослей на водные организмы». Обзоры в науке о рыболовстве. 10 (2): 113–390. Дои:10.1080/20026491051695. S2CID 86185142.
- ^ Galvão, J. A .; Oetterer, M .; Биттенкур-Оливейра Мдо, М. Д. С .; Gouvêa-Barros, S .; Хиллер, С .; Erler, K .; Luckas, B .; Pinto, E .; Куйбида, П. (2009). «Накопление сакситоксинов пресноводной тилапией (Oreochromis niloticus) для потребления человеком». Токсикон. 54 (6): 891–894. Дои:10.1016 / j.toxicon.2009.06.021. PMID 19560484.
- ^ Smith, E. A .; Грант, Ф .; Фергюсон, К. М. Дж .; Галлахер, С. (2001). «Биотрансформации паралитических токсинов моллюсков бактериями, выделенными из двустворчатых моллюсков». Прикладная и экологическая микробиология. 67 (5): 2345–2353. Дои:10.1128 / AEM.67.5.2345-2353.2001. ЧВК 92876. PMID 11319121.
- ^ а б c Sato, S .; Kodama, M .; Огата, Т .; Saitanu, K .; Furuya, M .; Hirayama, K .; Какинума, К. (1997). «Сакситоксин как токсичный ингредиент пресноводного иглобрюха Tetraodon fangi в Таиланде». Токсикон. 35 (1): 137–140. Дои:10.1016 / S0041-0101 (96) 00003-7. PMID 9028016.
- ^ Landsberg, J. H .; Холл, С .; Johannessen, J. N .; Уайт, К. Д .; Conrad, S.M .; Abbott, J. P .; Flewelling, L.J .; Richardson, R.W .; Dickey, R.W .; Шут, Эдвард Л.Э .; Этеридж, Стейси М .; Дело, Джонатан Р .; Ван Долах, Фрэнсис М .; Leighfield, Tod A .; Цзоу, Инлинь; Beaudry, Clarke G .; Беннер, Рональд А .; Роджерс, Патрисия Л .; Скотт, Паула С .; Кавабата, Кенджи; Wolny, Jennifer L .; Штайдингер, Карен А. (2006). «Отравление фуговыми рыбами сакситоксином в Соединенных Штатах, с первым отчетом о Pyrodinium bahamense как предполагаемом источнике токсина». Перспективы гигиены окружающей среды. 114 (10): 1502–1507. Дои:10.1289 / ehp.8998. ЧВК 1626430. PMID 17035133.
- ^ Дело, J. R .; Landsberg, J. H .; Etheridge, S.M .; Pitcher, G.C .; Лонган, С. В. (2008). «Нетрадиционные переносчики паралитического отравления моллюсками». Морские препараты. 6 (2): 308–348. Дои:10.3390 / md6020308. ЧВК 2525492. PMID 18728730.
- ^ Lagos, N. S .; Onodera, H .; Загатто, П. А .; Андриноло, D. ́O .; Азеведо, С. М. Ф. К .; Осима, Ю. (1999). «Первое свидетельство паралитического токсина моллюсков в пресноводной цианобактерии Cylindrospermopsis raciborskii, выделенной из Бразилии». Токсикон. 37 (10): 1359–1373. Дои:10.1016 / S0041-0101 (99) 00080-X. PMID 10414862.
- ^ Борднер Дж .; Thiessen W. E .; Bates H.A .; Рапопорт Х. (1975). «Строение кристаллического производного сакситоксина. Строение сакситоксина». Журнал Американского химического общества. 97 (21): 6008–12. Дои:10.1021 / ja00854a009. PMID 1176726.
- ^ Schantz E. J .; Казаросян В. Э .; Schnoes H.K .; Сильный Ф. М .; Springer J. P .; Pezzanite J. O .; Кларди Дж. (1975). «Строение сакситоксина». Журнал Американского химического общества. 97 (5): 1238–1239. Дои:10.1021 / ja00838a045. PMID 1133383.
- ^ Bates H.A .; Кострикен Р .; Рапопорт Х. (1978). «Химический анализ сакситоксина. Улучшения и модификации». Журнал сельскохозяйственной и пищевой химии. 26 (1): 252–4. Дои:10.1021 / jf60215a060. PMID 621331.
- ^ Танино Х .; Наката Т .; Канеко Т .; Киши Ю. (1997). «Стереоспецифический тотальный синтез d, l-сакситоксина». Журнал Американского химического общества. 99 (8): 2818–9. Дои:10.1021 / ja00450a079. PMID 850038.
- ^ Bhonde V. R .; Лупер Р. Э. (2011). «Стереоконтролируемый синтез (+) - сакситоксина». Журнал Американского химического общества. 133 (50): 20172–4. Дои:10.1021 / ja2098063. ЧВК 3320040. PMID 22098556.
- ^ Fleming J. J .; McReynolds M. D .; Дюбуа Ж. (2007). «(+) - Сакситоксин: стереоселективный синтез первого и второго поколения». Журнал Американского химического общества. 129 (32): 9964–75. Дои:10.1021 / ja071501o. PMID 17658800.
- ^ Справочник по токсикологии боевых отравляющих веществ. Гупта, Рамеш К. (Рамеш Чандра), 1949- (второе изд.). Лондон: Academic Press. 21 января 2015. с. 426. ISBN 978-0-12-800494-4. OCLC 903965588.CS1 maint: другие (ссылка на сайт)
- ^ Huot, R. I .; Армстронг, Д. Л .; Чан, Т.С. (июнь 1989 г.). «Защита нервной токсичности с помощью моноклональных антител к блокатору натриевых каналов тетродотоксину». Журнал клинических исследований. 83 (6): 1821–1826. Дои:10.1172 / JCI114087. ЧВК 303901. PMID 2542373.
- ^ а б Штюкен, Анке; Орр, Рассел; Келлманн, Ральф; Мюррей, Шона; Нейлан, Бретт; Якобсен, Кетилль (18 мая 2011 г.). «Открытие ядерно-кодированных генов нейротоксина сакситоксина в динофлагеллятах». PLOS ONE. 6 (5): e20096. Bibcode:2011PLoSO ... 620096S. Дои:10.1371 / journal.pone.0020096. ЧВК 3097229. PMID 21625593.
- ^ а б Kellmann, R .; Михали, Т. К .; Jeon, Y.J .; Пикфорд, Р.; Помати, Ф .; Нейлан, Б.А. (2008). «Биосинтетический промежуточный анализ и функциональная гомология выявили кластер генов сакситоксина в цианобактериях». Прикладная и экологическая микробиология. 74 (13): 4044–4053. Дои:10.1128 / AEM.00353-08. ЧВК 2446512. PMID 18487408.
- ^ Patocka J; Стредав Л. (23 апреля 2002 г.). Прайс, Ричард (ред.). «Краткий обзор природных небелковых нейротоксинов». Информационный бюллетень ASA. 02–2 (89): 16–23. ISSN 1057-9419. Получено 26 мая 2012.
- ^ Benton, B.J .; Keller, S.A .; Spriggs, D. L .; Capacio, B.R .; Чанг, Ф. К. (1998). «Восстановление после летального воздействия сакситоксина: терапевтическое окно для 4-аминопиридина (4-AP)». Токсикон. 36 (4): 571–588. Дои:10.1016 / с0041-0101 (97) 00158-х. PMID 9643470.
- ^ Chang, F.C .; Spriggs, D. L .; Benton, B.J .; Keller, S.A .; Капачио, Б. Р. (1997). «4-Аминопиридин обращает вспять кардиореспираторную депрессию, вызванную сакситоксином (STX) и тетродотоксином (TTX), у морских свинок, подвергшихся хроническому механическому лечению». Фундаментальная и прикладная токсикология. 38 (1): 75–88. Дои:10.1006 / faat.1997.2328. PMID 9268607.
- ^ Chen, H .; Lin, C .; Ван, Т. (1996). «Влияние 4-аминопиридина на интоксикацию сакситоксином». Токсикология и прикладная фармакология. 141 (1): 44–48. Дои:10.1006 / taap.1996.0258. PMID 8917674.
- ^ Стюарт, Чарльз Эдвард (2006). Пособие по оружию массовых жертв и борьбе с терроризмом. Джонс и Бартлетт Обучение. п. 175. ISBN 978-0-7637-2425-2. Получено 4 мая 2015.
- ^ а б Уилис, Марк; Рожа, Лайош; Дандо, Малкольм (2006). Смертельные культуры: биологическое оружие с 1945 года. Президент и научные сотрудники Гарвардского колледжа. п. 39. ISBN 978-0-674-01699-6. Получено 4 мая 2015.
- ^ Мауони, Альберт Дж. (2000). Борьба Америки с химико-биологической войной. 88 Post Road West, Westport, CT 06881: Praeger Publishers. п. 50. ISBN 978-0-275-96756-7. Получено 4 мая 2015.CS1 maint: location (ссылка на сайт)
внешние ссылки
- [1] Паралитическое отравление моллюсками
- [2] Нил Эдвардс. Химические лаборатории. Школа химии, физики и экологии. Университет Сассекса в Брайтоне. Сакситоксин - от пищевого отравления до химического оружия
- Токсичные цианобактерии в воде: руководство по их последствиям для здоровья населения, мониторингу и управлению. Отредактировано Ингрид Хор и Джейми Бартрам, 1999 г. Издано Всемирной организацией здравоохранения. ISBN 0-419-23930-8