Дихлорид метилфосфоновой кислоты - Википедия - Methylphosphonic acid dichloride
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Метилфосфоновой кислоты дихлорид | |
| Другие имена Дихлорид метанфосфоновой кислоты Дихлорид метанфосфоновой кислоты Метилфосфонил дихлорид | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.010.578 |
| Номер ЕС |
|
PubChem CID | |
| |
| |
| Характеристики | |
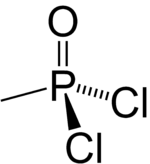
| CЧАС3Cl2Оп | |
| Молярная масса | 132.91 г · моль−1 |
| Внешность | Белое кристаллическое твердое вещество |
| Плотность | 1,468 г / мл при 20 ° C |
| Температура плавления | От 28 до 34 ° C (от 82 до 93 ° F, от 301 до 307 K) |
| Точка кипения | 163 ° С (325 ° F, 436 К) |
| Опасности | |
| Главный опасности | Очень токсичен |
| R-фразы (устарело) | R14, R23 / 24/25, R26, R34 |
| точка возгорания | > 110 ° С |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза ) | 26 промилле / 4 ч при ингаляции (крыса) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Дихлорид метилфосфоновой кислоты является фосфорорганическое соединение. Он имеет ряд потенциальных применений, но наиболее известен как предшественник нескольких химическое оружие агенты. Это белое кристаллическое твердое вещество с низкой температурой плавления. Он легко гидролизуется, и с ним нужно обращаться осторожно, поскольку он чрезвычайно токсичен.[нужна цитата ]
Синтез и реакции
Дихлорид метилфосфоновой кислоты получают окислением метилдихлорфосфин, например с сульфурилхлорид:[1]
- MePCl2 + ТАК2Cl2 → MeP (O) Cl2 + SOCl2
Его также можно производить из ряда метилфосфонатов (например, диметилметилфосфонат ) путем хлорирования тионилхлорид. Разные амины может быть использован для катализа этого процесса.[2] Он реагирует с фтороводород или же фторид натрия производить метилфосфонил дифторид, который используется в производстве зарин и зоман нервно-паралитические агенты.
Рекомендации
- ^ Svara, J .; Weferling, N .; Хофманн, Т. «Соединения фосфора, органические», В Энциклопедии промышленной химии Ульманна, Wiley-VCH, Weinheim, 2008. Дои:10.1002 / 14356007.a19_545.pub2.
- ^ Майер, Людвиг (1990). «ОРГАНИЧЕСКИЕ ФОСФОРНЫЕ СОЕДИНЕНИЯ 90.l УДОБНЫЙ, ОДНОСТУПЕНЧАТЫЙ СИНТЕЗ АЛКИЛ- И АРИЛФОСФОНИЛДИХЛОРИДОВ». Фосфор, сера, кремний и родственные элементы. 47 (3–4): 465–470. Дои:10.1080/10426509008038002.
