Dronedarone - Dronedarone
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Multaq |
| Другие имена | SR33589 |
| AHFS /Drugs.com | Монография |
| MedlinePlus | a609034 |
| Данные лицензии |
|
| Беременность категория |
|
| Маршруты администрация | Устно |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | 15% (с жирной пищей)[1] |
| Связывание с белками | >98% |
| Метаболизм | Обширный Печень (в основном CYP3A ) |
| Устранение период полураспада | 13–19 часов |
| Экскреция | Кал (84%), моча (~ 6%) |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.109.411 |
| Химические и физические данные | |
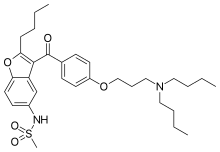
| Формула | C31ЧАС44N2О5S |
| Молярная масса | 556.76 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| | |
Dronedarone, продается под торговой маркой Multaq, это медикамент к Санофи-Авентис, в основном для указания сердечные аритмии. Он был одобрен FDA 2 июля 2009 года. Он был рекомендован в качестве альтернативы амиодарон для лечения мерцательная аритмия и трепетание предсердий у людей, сердца которых либо вернулись к нормальному ритму, либо проходят медикаментозную терапию или лечение электрическим током т.е. постоянный ток кардиоверсия (DCCV) для поддержания нормального ритма. Это антиаритмический класс III препарат, средство, медикамент.[2] В Соединенных Штатах одобренная FDA этикетка включает заявление о сокращении госпитализации, но не о снижении смертности, поскольку снижение смертности не было продемонстрировано в программе клинических исследований.[3] Испытание препарата в сердечная недостаточность было остановлено, поскольку промежуточный анализ показал возможное увеличение смертности от сердечной недостаточности у пациентов с умеренной и тяжелой ХСН.[4]
На этикетке дронедарона в США есть предупреждение в рамке, заявив, что дронедарон противопоказан пациентам с Сердечная недостаточность IV класса по NYHA, с сердечной недостаточностью II – III классов по NYHA с недавней декомпенсацией, требующей госпитализации или направления в специализированную клинику сердечной недостаточности, или с постоянной фибрилляцией предсердий ».[1] Дронедарон также связан с редкими случаями тяжелого поражения печени, включая печеночную недостаточность.[5]
Механизм действия
Дронедарон был назван «многоканальным блокатором», однако неясно, какой канал (ы) играет решающую роль в его успехе.[6] Таким образом, действие дронедарона на клеточном уровне является спорным, и большинство исследований предполагают ингибирование нескольких выходящих калиевых токов, включая быстрый выпрямитель с задержкой, медленный выпрямитель с задержкой и внутренний выпрямитель, активируемый ACh.[7] Также считается, что он уменьшает быстрый входящий внутрь ток Na и каналы Ca L-типа. В некоторых исследованиях было показано, что снижение K-тока связано с ингибированием K-ACh-канала или связанных с ним GTP-связывающих белков.[6] Уменьшение тока K + на 69% привело к увеличению продолжительности AP и увеличению эффективных рефрактерных периодов, таким образом, показано, что они подавляют кардиостимулятор потенциал СА-узла и вернуть пациентам нормальный сердечный ритм.[7] В европейском исследовании среднее время рецидива аритмии составляло 41 день в группе плацебо по сравнению с 96 днями в группе дронедарона (аналогичные результаты, полученные в неевропейском исследовании, 59 и 158 дней соответственно).[8]
Химия
Химически дронедарон представляет собой бензофуран производная, связанная с амиодарон, популярный антиаритмический. Использование амиодарона ограничено токсичностью из-за его высокой йод содержание (легочный фиброз, щитовидная железа болезнь), а также печень болезнь. В дронедароне отсутствуют фрагменты йода, что снижает токсическое воздействие на щитовидную железу и другие органы. Группа метилсульфонамида добавляется для уменьшения растворимости в жирах (липофобности) и, таким образом, уменьшения нейротоксических эффектов.[3]
Дронедарон проявляет амиодарон-подобные антиаритмический класс III активность in vitro[9] и в клинических испытаниях.[4] Препарат также проявляет активность в каждом из 4 антиаритмических классов Вогана-Вильямса.[10]
Фармакокинетика
Дронедарон менее липофильный, чем амиодарон, имеет гораздо меньший объем распределения и период полувыведения 13–19 часов, что контрастирует с периодом полувыведения амиодарона, составляющим несколько недель.[1][11] В результате этих фармакокинетических характеристик дозирование дронедарона может быть менее сложным, чем дозирование амиодарона.
Противопоказания
- Постоянная ФП (пациенты, у которых нормальный синусовый ритм не восстанавливается или не может быть восстановлен)[1]
- Недавно декомпенсированная сердечная недостаточность, требующая госпитализации, или сердечная недостаточность IV класса.[1]
- AV-блокада второй или третьей степени или синдром слабости синусового узла (кроме случаев, когда используется вместе с работающим кардиостимулятором)[1]
- Брадикардия[1]
- Одновременный прием сильного ингибитора CYP3A[1]
- Одновременный прием лекарств или растительных продуктов, которые удлиняют интервал QT и могут вызывать торсад де Пуантес[1]
- Токсичность для печени или легких, связанная с предыдущим применением амиодарона[1]
- Тяжелая печеночная недостаточность[1]
- QTc интервал Базетта ≥500 мс,[1] или использовать с лекарствами или травяными добавками, которые удлиняют интервал QT или увеличивают риск торсадных точек (антиаритмические средства I или III класса, фенотиазины, трициклические антидепрессанты, некоторые пероральные макролиды, эфедра).[нужна цитата ]
- Беременность и кормящие матери[1]
- Повышенная чувствительность к дронедарону.[1]
- Печеночный обесценение. В январе 2011 года FDA сообщило о случаях редкого, но тяжелого повреждения печени, включая два случая острой печеночной недостаточности, приведшей к трансплантации печени у пациентов, получавших дронедарон (Multaq). Неизвестно, предотвратит ли регулярный периодический мониторинг сывороточных ферментов печени (АЛТ, АСТ и щелочная фосфатаза) и билирубина у пациентов, принимающих дронедарон, развитие тяжелого поражения печени.[5]
- Интервал PR более 280 мс[нужна цитата ]
- Использование ингибиторов изофермента цитохрома P-450 (CYP) 3a (включая: кларитромицин, циклоспорин, итраконазол, кетоконазол, нефазодон, ритонавир, телитромицин, вориконазол)
Клинические испытания
В клинических испытаниях дронедарон сравнивали с плацебо и амиодароном по его способности уменьшать фибрилляцию предсердий, снижать общую смертность и смертность от сердечных причин, а также по его побочным эффектам, включая повышенную смертность.[3][12] Дронедарон - это не йодированный антиаритмический препарат III класса который помогает пациентам вернуться к нормальному состоянию синусовый ритм. Также известно, что это лечение ФП снижает ассоциированные смертность и госпитализации по сравнению с другими подобными антиаритмические средства.[13]
В испытаниях EURIDIS и ADONIS в мерцательная аритмия (2007), дронедарон был значительно более эффективным в поддержании синусового ритма, чем плацебо, без разницы в функции легких и щитовидной железы в краткосрочной перспективе.[14]
Однако в исследовании ANDROMEDA (2007) дронедарон удвоил уровень смертности по сравнению с плацебо, и испытание было прекращено досрочно.[4] ANDROMEDA включила в исследование пациентов с застойной сердечной недостаточностью от умеренной до тяжелой степени - относительно более тяжелую группу пациентов.
В более позднем мерцательная аритмия В исследовании ATHENA с участием 4628 человек дронедарон был значительно более эффективным, чем плацебо, в снижении комплексной конечной точки первой госпитализации из-за сердечно-сосудистых событий или смерти.[15] Произошло значительное снижение смертности от сердечно-сосудистых заболеваний, но не смертности от какой-либо причины.[3] Более поздний апостериорный анализ результатов ATHENA показал значительное снижение частоты инсультов.[16]
Пациенты рандомизированный дронедарону с большей вероятностью разовьется брадикардия и QT-интервал продление (но только 1 случай Торсады ). Тошнота, диарея, сыпь и повышение креатинина также чаще встречались в группе дронедарона.
Исследование PALLAS (2011) было остановлено из соображений безопасности в связи с обнаружением, что «дронедарон увеличивает частоту сердечной недостаточности, инсульта и смерти от сердечно-сосудистых причин у пациентов с постоянной фибрилляцией предсердий, которые находятся в группе риска серьезных сосудистых событий».[17] Впоследствии FDA добавило предупреждение о черном ящике, в котором говорилось, что риск смерти, инсульта и госпитализации по поводу застойной сердечной недостаточности удваивается у пациентов с постоянной фибрилляцией предсердий.
Результаты кардиоверсии постоянным током
Дронедарон был протестирован в некоторых исследованиях как способ повышения эффективности электрической кардиоверсии. В одном из таких испытаний администрацией ветеранов он использовался для подготовки пациентов к электрическому преобразованию в синусовый ритм. В исследовании ATHENA 25% пациентов начинали прием дронедарона раньше. кардиоверсия.[18] Результаты недавно завершившегося рандомизированного исследования (ELECTRA) могут прояснить безопасность и идеальные варианты использования дронедарона во время кардиоверсии.[19]
Нормативный обзор
Первоначально представленный в качестве заявки на новый препарат в 2005 году, дронедарон был рассмотрен и рекомендован для утверждения 18 марта 2009 года Консультативным комитетом Управления по контролю за продуктами и лекарствами США (FDA). FDA не связано рекомендациями комитета, но принимает их во внимание при рассмотрении заявок на новые лекарства.[20] 2 июля 2009 года FDA одобрило дронедарон.
Министерство здравоохранения Канады был вторым крупным регулирующим органом, одобрившим препарат, и дал свое одобрение 12 августа 2009 года. Утверждение предназначено для «лечения пациентов с фибрилляцией предсердий в анамнезе или текущей фибрилляции предсердий для снижения риска госпитализации по поводу сердечно-сосудистых заболеваний из-за этого состояния».[21]
В Европейское агентство по лекарствам опубликовал Резюме положительного заключения относительно дронедарона 24 сентября 2009 года, рекомендуя Европейской Комиссии предоставить разрешение на продажу в Европейском Союзе.[22]
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о «Мультакадронедарон таблетка, покрытая пленочной оболочкой». DailyMed. 15 Октябрь 2020. Получено 18 ноября 2020.
- ^ «FDA одобрило Multaq для лечения нарушений сердечного ритма» (Пресс-релиз). FDA. 2009-07-02. Получено 2 июля, 2009.[мертвая ссылка ]
- ^ а б c d Zimetbaum, PJ (2009). «Дронедарон от мерцательной аритмии - одиссея». Медицинский журнал Новой Англии. 360 (18): 1811–3. Дои:10.1056 / NEJMp0902248. PMID 19403901.
- ^ а б c Кёбер Л., Торп-Педерсен С., МакМюррей Дж. Дж. И др. (Июнь 2008 г.). «Повышенная смертность после терапии дронедароном тяжелой сердечной недостаточности». N Engl J Med. 358 (25): 2678–87. Дои:10.1056 / NEJMoa0800456. PMID 18565860.
- ^ а б «Сообщение FDA по безопасности лекарств: серьезное повреждение печени, связанное с использованием дронедарона (продается как Multaq). Объявление о безопасности». НАС. Управление по контролю за продуктами и лекарствами (FDA). 14 января 2011 г.
- ^ а б Guillemare E, Marion A, Nisato D, Gautier P, «Ингибирующие эффекты дронедарона на мускариновый ток K + в предсердных клетках морских свинок», в Journal of Cardiovascular Pharmacology, 2000 7
- ^ а б Aimond F, Beck L, Gautier P, Chérif OK, Davy JM, Lorente P, Nisato D, Vassort G, «Клеточные и in vivo электрофизиологические эффекты дронедарона у нормальных крыс и крыс после инфаркта миокарда», в Журнале фармакологии и экспериментальной терапии. 2000. 11
- ^ Сингх Б.Н., Коннолли С.Дж., Крайнс Х.Д., Рой Д., Кови П.Р., Капуччи А., Радзик Д., Алиот Е.М., Хонлозер С.Х .; Исследователи EURIDIS и ADONIS, «Дронедарон для поддержания синусового ритма при фибрилляции или трепетании предсердий», в Медицинском журнале Новой Англии, 2007. 12
- ^ Сан В., Сарма Дж. С., Сингх Б. Н. (30 ноября 1999 г.). «Электрофизиологические эффекты дронедарона (SR33589), не йодированного производного бензофурана, на сердце кролика: сравнение с амиодароном». Тираж. 100 (22): 2276–81. Дои:10.1161 / 01.CIR.100.22.2276. PMID 10578003.
- ^ http://www.medscape.com/druginfo/monograph?cid=med&drugid=152656&drugname=Multaq+Oral&monotype=monograph&print=1.
- ^ Дейл К.М., Белый CM (апрель 2007 г.). «Дронедарон: аналог амиодарона для лечения фибрилляции предсердий и трепетания предсердий». Энн Фармакотер. 41 (4): 599–605. Дои:10,1345 / т / ч. 1H524. PMID 17389667. S2CID 22339555.
- ^ Guillemare E, Marion A, Nisato D, Gautier P, «Ингибирующие эффекты дронедарона на мускариновый ток K + в предсердных клетках морских свинок», в Journal of Cardiovascular Pharmacology, 2000. 7
- ^ Коннолли С.Дж., Крайнс Х.Дж., Торп-Педерсен К., ван Эйкельс М., Годен С., Пейдж Р.Л., Хонлозер С.Х .; ATHENA Investigators, «Анализ инсульта в ATHENA: плацебо-контролируемое, двойное слепое, параллельное исследование для оценки эффективности дронедарона 400 мг два раза в сутки для предотвращения сердечно-сосудистой госпитализации или смерти от любой причины у пациентов с фибрилляцией предсердий / предсердий. флаттер », Тираж, 2009.8.
- ^ Сингх Б.Н., Коннолли С.Дж., Крайнс Х.Д. и др. (Сентябрь 2007 г.). «Дронедарон для поддержания синусового ритма при фибрилляции или трепетании предсердий». N Engl J Med. 357 (10): 987–999. Дои:10.1056 / NEJMoa054686. PMID 17804843.
- ^ Hohnloser SH, Crijns HJ, van Eickels M, et al. (Февраль 2009 г.). «Влияние дронедарона на сердечно-сосудистые заболевания при фибрилляции предсердий». N Engl J Med. 360 (7): 668–678. Дои:10.1056 / NEJMoa0803778. PMID 19213680.
- ^ Коннолли SJ; Crijns HJGM; Торп-Педерсен С; ван Эйкельс М; Gaudin C; Страница RL; Hohnloser SH (сентябрь 2009 г.). «Анализ инсульта в ATHENA: плацебо-контролируемое, двойное слепое, параллельное исследование для оценки эффективности дронедарона 400 мг два раза в сутки для предотвращения сердечно-сосудистой госпитализации или смерти от любой причины у пациентов с фибрилляцией предсердий / трепетанием предсердий». Тираж. 120 (13): 1174–80. Дои:10.1161 / CIRCULATIONAHA.109.875252. PMID 19752319.
- ^ Коннолли SJ, Camm AJ, Halperin JL, et al. (Декабрь 2011 г.). «Дронедарон при постоянной фибрилляции предсердий высокого риска» (PDF). N Engl J Med. 365 (24): 2268–2276. Дои:10.1056 / NEJMoa1109867. ЧВК 3860949. PMID 22082198.
- ^ Влияние дронедарона на сердечно-сосудистые события при фибрилляции предсердий. Стефан Х. Хонлозер, доктор медицины, Гарри Дж.Г.М. Крайнс, доктор медицины, Мартин ван Эйкельс, доктор медицины, Кристоф Годен, доктор медицины, Ричард Л. Пейдж, доктор медицины, Кристиан Торп-Педерсен, доктор медицины, и Стюарт Дж. Коннолли, доктор медицины для исследователей ATHENA. N Engl J Med 2009; 360: 668-678 12 февраля 2009 г. DOI: 10.1056 / NEJMoa0803778
- ^ http://clinicaltrials.gov/ct2/show/NCT01026090
- ^ Информационный документ FDA о дронедароне[мертвая ссылка ]
- ^ «Архивная копия». Архивировано из оригинал на 2011-07-18. Получено 2009-08-13.CS1 maint: заархивированная копия как заголовок (ссылка на сайт)
- ^ Резюме положительного заключения (получено 1 декабря 2009 г.)
внешняя ссылка
- "Дронедарон". Портал информации о наркотиках. Национальная медицинская библиотека США.
- «Дронедарона гидрохлорид». Портал информации о наркотиках. Национальная медицинская библиотека США.
