Рецептор (биохимия) - Receptor (biochemistry)
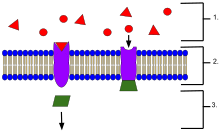
- Лиганды, находящиеся вне клетки
- Лиганды соединяются со специфическими рецепторными белками в зависимости от формы активного сайта белка.
- Рецептор высвобождает мессенджер, как только лиганд соединяется с рецептором.
В биохимия и фармакология, рецепторы химические структуры, состоящие из белок, которые получают и преобразовывать сигналы, которые могут быть интегрированы в биологические системы.[1] Эти сигналы обычно[nb 1] химические посредники, которые связываются с рецептором и вызывают некоторую форму клеточного / тканевого ответа, например изменение электрической активности клетки. Действие рецептора можно классифицировать по трем основным направлениям: ретрансляция сигнала, усиление или интеграция.[2] Ретрансляция отправляет сигнал вперед, усиление увеличивает эффект одиночного лиганд, а интеграция позволяет включить сигнал в другой биохимический путь.[2]
Рецептор белки можно классифицировать по их местонахождению. Трансмембранные рецепторы включают: связанные с ионным каналом (ионотропные) рецепторы, Связанные с G-белком (метаботропные) рецепторы гормонов, и ферментно-связанный рецепторы гормонов.[1] Внутриклеточные рецепторы находятся внутри клетки и включают цитоплазматические рецепторы и ядерные рецепторы.[1] Молекула, которая связывается с рецептором, называется лиганд, и может быть белок или же пептид (короткий белок) или другой малая молекула например, нейротрансмиттер, гормон, фармацевтический препарат, токсин, ион кальция или части внешнего вируса или микроба. Эндогенно продуцируемое вещество, которое связывается с определенным рецептором, называется его эндогенным лигандом. Например. эндогенный лиганд для никотиновый рецептор ацетилхолина является ацетилхолин, но рецептор также может быть активирован никотин[3][4] и заблокирован кураре.[5] Рецепторы определенного типа связаны со специфическими клеточными биохимическими путями, которые соответствуют сигналу. Хотя в большинстве клеток обнаружено множество рецепторов, каждый рецептор связывается только с лигандами определенной структуры. Это аналогично сравнивалось с как замки принимают только ключи особой формы. Когда лиганд связывается с соответствующим рецептором, он активирует или ингибирует биохимический путь, связанный с рецептором.
Структура

Структуры рецепторов очень разнообразны и включают, среди прочего, следующие основные категории:
- Тип 1: Ионные каналы, управляемые лигандами (ионотропные рецепторы) - Эти рецепторы обычно являются мишенями быстрых нейромедиаторов, таких как ацетилхолин (никотиновый) и ГАМК; активация этих рецепторов приводит к изменениям в движении ионов через мембрану. Они имеют гетеромерную структуру, в которой каждая субъединица состоит из внеклеточного лиганд-связывающего домена и трансмембранного домена, который включает четыре трансмембранных домена. альфа спирали. Полости, связывающие лиганд, расположены на границе раздела между субъединицами.
- Тип 2: G-белковые рецепторы (метаботропные рецепторы) - Это самое большое семейство рецепторов, которое включает рецепторы нескольких гормонов и медленных передатчиков, например дофамин, метаботропный глутамат. Они состоят из семи трансмембранных альфа-спиралей. Петли, соединяющие альфа-спирали, образуют внеклеточные и внутриклеточные домены. Сайт связывания для более крупных пептидных лигандов обычно находится во внеклеточном домене, тогда как сайт связывания для более мелких непептидных лигандов часто находится между семью альфа-спиралями и одной внеклеточной петлей.[6] Вышеупомянутые рецепторы связаны с различными внутриклеточными эффекторными системами через G белки.[7]
- Тип 3: Связанные с киназой и родственные рецепторы (см. "Рецепторная тирозинкиназа " и "Ферментно-связанный рецептор ") - Они состоят из внеклеточного домена, содержащего сайт связывания лиганда, и внутриклеточного домена, часто с ферментативной функцией, связанных одной трансмембранной альфа-спиралью. рецептор инсулина это пример.
- Тип 4: Ядерные рецепторы - Хотя их называют ядерными рецепторами, на самом деле они расположены в цитоплазма и перейти на ядро после связывания со своими лигандами. Они состоят из C-терминал лиганд-связывающая область, ядро ДНК-связывающий домен (DBD) и N-концевой домен, содержащий AF1(функция активации 1) регион. Центральная область имеет два цинковых пальца, которые отвечают за распознавание последовательностей ДНК, специфичных для этого рецептора. N-конец взаимодействует с другими клеточными факторами транскрипции лиганд-независимым образом; и, в зависимости от этих взаимодействий, он может изменять связывание / активность рецептора. Рецепторы стероидов и тироидных гормонов являются примерами таких рецепторов.[8]
Мембранные рецепторы можно выделить из клеточных мембран с помощью сложных процедур экстракции с использованием растворители, моющие средства, и / или аффинная очистка.
Структуры и действия рецепторов могут быть изучены с помощью биофизических методов, таких как Рентгеновская кристаллография, ЯМР, круговой дихроизм, и двойная поляризационная интерферометрия. Компьютерное моделирование динамического поведения рецепторов были использованы для понимания механизмов их действия.
Привязка и активация
Связывание лиганда - это равновесие процесс. Лиганды связываются с рецепторами и отделяются от них в соответствии с закон массового действия в следующем уравнении для лиганда L и рецептора R. Скобки вокруг химических соединений обозначают их концентрации.
Одним из показателей того, насколько хорошо молекула подходит к рецептору, является ее аффинность связывания, которая обратно пропорциональна константа диссоциации Kd. Хорошая посадка соответствует высокому сродству и низкому Kd. Окончательный биологический ответ (например, каскад второго мессенджера, сокращение мышц), достигается только после активации значительного числа рецепторов.
Сродство - это мера тенденции лиганда связываться со своим рецептором. Эффективность - это мера связанного лиганда для активации его рецептора.
Агонисты против антагонистов
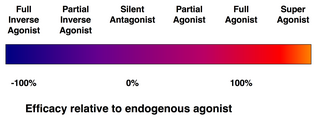
Не каждый лиганд, который связывается с рецептором, также активирует этот рецептор. Существуют следующие классы лигандов:
- (Полный) агонисты способны активировать рецептор и вызывать сильный биологический ответ. Естественный эндогенный лиганд с наибольшим эффективность для данного рецептора по определению является полным агонистом (эффективность 100%).
- Частичные агонисты не активируют рецепторы с максимальной эффективностью, даже при максимальном связывании, вызывая частичные ответы по сравнению с полными агонистами (эффективность от 0 до 100%).
- Антагонисты связываются с рецепторами, но не активируют их. Это приводит к блокаде рецепторов, ингибируя связывание агонистов и обратных агонистов. Антагонисты рецептора могут быть конкурентными (или обратимыми) и конкурировать с агонистом рецептора, или они могут быть необратимыми антагонистами, которые образуют ковалентные связи (или нековалентные связи с чрезвычайно высоким сродством) с рецептором и полностью его блокируют. Ингибитор протонной помпы омепразол является примером необратимого антагониста. Эффекты необратимого антагонизма можно обратить вспять только путем синтеза новых рецепторов.
- Обратные агонисты снижают активность рецепторов, подавляя их конститутивную активность (отрицательная эффективность).
- Аллостерические модуляторы: Они не связываются с участком связывания агониста рецептора, а вместо этого связываются со специфическими аллостерическими участками связывания, через которые они модифицируют действие агониста. Например, бензодиазепины (BZD) связываются с сайтом BZD на ГАМКА рецептор и усиливают действие эндогенной ГАМК.
Обратите внимание, что идея агонизма и антагонизма рецепторов относится только к взаимодействию между рецепторами и лигандами, а не к их биологическим эффектам.
Учредительная деятельность
Говорят, что рецептор, который способен вызывать биологический ответ в отсутствие связанного лиганда, проявляет «конститутивную активность».[9] Конститутивная активность рецептора может быть заблокирована обратный агонист. Лекарства от ожирения римонабант и таранабант являются обратными агонистами каннабиноидов Рецептор CB1 и хотя они привели к значительной потере веса, оба были исключены из-за высокой частоты депрессии и тревоги, которые, как полагают, связаны с ингибированием конститутивной активности каннабиноидного рецептора.
В ГАМКА рецептор имеет конститутивную активность и проводит базальный ток в отсутствие агониста. Это позволяет бета-карболин действовать как обратный агонист и уменьшать ток ниже базальные уровни.
Мутации рецепторов, которые приводят к повышенной конститутивной активности, лежат в основе некоторых наследственных заболеваний, таких как преждевременное половое созревание (из-за мутаций рецепторов лютеинизирующего гормона) и гипертиреоз (из-за мутаций рецепторов тиреотропного гормона).
Теории взаимодействия лекарственного средства с рецептором
Род занятий
Центральная догма рецепторной фармакологии состоит в том, что действие лекарства прямо пропорционально количеству занятых рецепторов.[нужна цитата ] Кроме того, действие лекарства прекращается по мере диссоциации комплекса лекарство-рецептор.
Ариенс & Stephenson ввел термины «аффинность» и «эффективность» для описания действия лигандов, связанных с рецепторами.[10][11]
- Близость: Способность лекарства соединяться с рецептором с образованием комплекса лекарство-рецептор.
- Эффективность: Способность комплекса лекарство-рецептор вызывать реакцию.
Ставка
В отличие от принятых Теория оккупацииТеория скорости предполагает, что активация рецепторов прямо пропорциональна общему числу встреч лекарства с его рецепторами в единицу времени. Фармакологическая активность прямо пропорциональна скорости диссоциации и ассоциации, нет количество занятых рецепторов:[12]
- Агонист: препарат с быстрой ассоциацией и быстрой диссоциацией.
- Частичный агонист: препарат с промежуточной ассоциацией и промежуточной диссоциацией.
- Антагонист: препарат с быстрой ассоциацией и медленной диссоциацией.
Индуцированная посадка
Когда лекарство приближается к рецептору, рецептор изменяет конформацию своего сайта связывания с образованием комплекса лекарство-рецептор.
Запасные рецепторы
В некоторых рецепторных системах (например, ацетилхолин в нервно-мышечном соединении гладких мышц) агонисты способны вызывать максимальный ответ при очень низких уровнях занятости рецепторов (<1%). Таким образом, у этой системы есть запасные рецепторы или рецепторный резерв. Такое расположение обеспечивает экономию производства и выпуска нейротрансмиттеров.[8]
Рецепторная регуляция
Клетки могут увеличиваться (активизировать ) или уменьшить (подавлять ) количество рецепторов к данному гормон или же нейротрансмиттер изменять их чувствительность к разным молекулам. Это местно действующий Обратная связь механизм.
- Изменение конформации рецептора таким образом, что связывание агониста не активирует рецептор. Это видно на рецепторах ионных каналов.
- Разъединение рецептора эффекторные молекулы наблюдается с рецептором пары G-белков.
- Рецептор секвестрация (интернализация).[13] например в случае рецепторов гормонов.
Примеры и лиганды
Лиганды рецепторов столь же разнообразны, как и их рецепторы. GPCR (7TM) - это особенно обширное семейство, насчитывающее не менее 810 членов. Это также LGIC по меньшей мере для дюжины эндогенных лигандов и для многих других рецепторов, возможных через различные композиции субъединиц. Некоторые общие примеры лигандов и рецепторов включают:[14]
Ионные каналы и рецепторы, связанные с G-белком
Некоторые примеры ионотропных (LGIC) и метаботропных (в частности, GPCR) рецепторов показаны в таблице ниже. Основными нейротрансмиттерами являются глутамат и ГАМК; другие нейротрансмиттеры нейромодулирующий. Этот список ни в коем случае не является исчерпывающим.
| Эндогенный лиганд | Рецептор ионного канала (LGIC) | Рецептор, связанный с G-белком (GPCR) | ||||
|---|---|---|---|---|---|---|
| Рецепторы | Ионный ток[nb 2] | Экзогенный лиганд | Рецепторы | G протеин | Экзогенный лиганд | |
| Глутамат | iGluRs: NMDA, AMPA, и Каинатные рецепторы | Na+, К+, Ca2+ [14] | Кетамин | Рецепторы глутамата: mGluRs | Gq или Gi / o | - |
| ГАМК | ГАМКА (включая ГАМКА-ро ) | Cl− > HCO−3 [14] | Бензодиазепины | ГАМКB рецептор | Gi / o | Баклофен |
| Ацетилхолин | нАЧР | Na+, К+, Ca2+[14] | Никотин | МАЧР | Gq или Gi | Мускарин |
| Глицин | Рецептор глицина (GlyR) | Cl− > HCO−3 [14] | Стрихнин | - | - | - |
| Серотонин | 5-HT3 рецептор | Na+, К+ [14] | Цереулид | 5-HT1-2 или 4-7 | Gs, Gi / o или Gq | - |
| АТФ | Р2Х рецепторы | Ca2+, Na+, Mg2+ [14] | БзАТП[нужна цитата ] | P2Y рецепторы | Gs, Gi / o или Gq | - |
| Дофамин | Нет ионных каналов[нужна цитата ] | - | - | Рецепторы допамина | GS или Gi / o | - |
Рецепторы, связанные с ферментом
Рецепторы, связанные с ферментом, включают: рецепторные тирозинкиназы (RTK), серин / треонин-специфическая протеинкиназа, как в костном морфогенетическом протеине и гуанилатциклаза, как в рецепторе предсердного натрийуретического фактора. Было определено 20 классов RTK, членами которых являются 58 различных RTK. Некоторые примеры показаны ниже:
| Класс RTK / Семейство рецепторов | Член | Эндогенный лиганд | Экзогенный лиганд |
|---|---|---|---|
| я | EGFR | EGF | Гефитиниб |
| II | Рецептор инсулина | Инсулин | Хетохромин |
| IV | VEGFR | VEGF | Ленватиниб |
Внутриклеточные рецепторы
Рецепторы можно классифицировать по их механизму или по положению в клетке. Ниже показаны 4 примера внутриклеточного LGIC:
| Рецептор | Лиганд | Ионный ток |
|---|---|---|
| циклические нуклеотидные ионные каналы | cGMP (зрение ), лагерь и cGTP (обоняние ) | Na+, К+ [14] |
| IP3 рецептор | IP3 | Ca2+ [14] |
| Внутриклеточный АТФ рецепторы | АТФ (закрывает канал)[14] | K+ [14] |
| Рецептор рианодина | Ca2+ | Ca2+ [14] |
Роль в генетических нарушениях
Много генетические нарушения связаны с наследственными дефектами рецепторных генов. Часто бывает трудно определить, является ли рецептор нефункциональным или гормон производится на пониженном уровне; это дает начало "псевдогипо" группе эндокринные расстройства, где, по-видимому, наблюдается пониженный гормональный уровень, хотя на самом деле рецептор недостаточно реагирует на гормон.
В иммунной системе
Основные рецепторы в иммунная система находятся рецепторы распознавания образов (PRR), толл-подобные рецепторы (TLR), убийца активирован и рецепторы ингибиторов киллеров (KARs и KIRs), рецепторы комплемента, Рецепторы Fc, Рецепторы В-клеток и Рецепторы Т-клеток.[15]
Смотрите также
- Kя База данных
- Рецепторы, связанные с ионным каналом
- Нейропсихофармакология
- Регресс Шильда для ингибирования рецептора лиганда
- Передача сигнала
- Маркер стволовых клеток
- Список кодов MeSH (D12.776)
- Теория рецепторов
Примечания
- ^ В случае Рецептор родопсина, вход - это фотон, а не химический
- ^ Разные LGIC проводят токи разных ионы. Это достигается с помощью фильтров селективности, как и в случае фильтр селективности канала К +
Рекомендации
- ^ а б c Холл, Дж. Э. (2016). Учебник медицинской физиологии Гайтона и Холла. Филадельфия, Пенсильвания: Elsevier Saunders. С. 930–937. ISBN 978-1-4557-7005-2.
- ^ а б Альбертс Б., Брей Д., Хопкин К., Джонсон А., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2014). Эссенциальная клеточная биология (Четвертое изд.). Нью-Йорк, Нью-Йорк, США: Garland Science. п. 534. ISBN 978-0-8153-4454-4.
- ^ Готти, Сесилия; Маркс, Майкл. J .; Миллар, Нил С .; Воннакотт, Сьюзен (16 сентября 2019 г.). «Никотиновые ацетилхолиновые рецепторы (версия 2019.4)». IUPHAR / BPS Руководство по фармакологии CITE. 2019 (4). Дои:10.2218 / gtopdb / F76 / 2019.4. Получено 17 ноября 2020.
- ^ Маленка Р.К., Нестлер Э.Дж., Хайман С.Е. (2009). «Глава 9: Автономная нервная система». В Sydor A, Brown RY (ред.). Молекулярная нейрофармакология: основа клинической неврологии (2-е изд.). Нью-Йорк: McGraw-Hill Medical. п. 234. ISBN 9780071481274.
Никотин ... это природный алкалоид табака. Лобелин - природный алкалоид индийского табака. Оба препарата являются агонистами никотиновых холинорецепторов ...
- ^ https://www.drugs.com/mmx/curare.html
- ^ Конгрив М., Маршалл Ф. (март 2010 г.). «Влияние структур GPCR на фармакологию и дизайн лекарств на основе структуры». Британский журнал фармакологии. 159 (5): 986–96. Дои:10.1111 / j.1476-5381.2009.00476.x. ЧВК 2839258. PMID 19912230.
- ^ Цинь К., Донг С., Ву Г., Ламберт Н.А. (август 2011 г.). «Предварительная сборка в неактивном состоянии рецепторов, связанных с G (q), и гетеротримеров G (q)». Природа Химическая Биология. 7 (10): 740–7. Дои:10.1038 / nchembio.642. ЧВК 3177959. PMID 21873996.
- ^ а б Позвонил HP, Дейл М.М., Риттер Дж. М., Флауэр Р. Дж., Хендерсон Дж. (2012). Фармакология Рэнга и Дейла (7-е изд.). Эльзевьер Черчилль Ливингстон. ISBN 978-0-7020-3471-8.
- ^ Миллиган Джи (декабрь 2003 г.). «Конститутивная активность и обратные агонисты рецепторов, связанных с G-белком: текущая перспектива». Молекулярная фармакология. 64 (6): 1271–6. Дои:10.1124 / моль.64.6.1271. PMID 14645655.
- ^ Ариенс EJ (сентябрь 1954 г.). «Аффинити и внутренняя активность в теории конкурентного торможения. I. Проблемы и теория». Archives Internationales de Pharmacodynamie et de Therapie. 99 (1): 32–49. PMID 13229418.
- ^ Стивенсон Р.П. (декабрь 1956 г.). «Модификация рецепторной теории». Британский журнал фармакологии и химиотерапии. 11 (4): 379–93. Дои:10.1111 / j.1476-5381.1956.tb00006.x. ЧВК 1510558. PMID 13383117.
- ^ Сильверман РБ (2004). "3.2.C Теории взаимодействий лекарств и рецепторов". Органическая химия дизайна лекарств и действия лекарств (2-е изд.). Амстердам: Elsevier Academic Press. ISBN 0-12-643732-7.
- ^ Boulay G, Chrétien L, Richard DE, Guillemette G (ноябрь 1994 г.). «Кратковременная десенсибилизация рецептора ангиотензина II клеток клубочков надпочечников крупного рогатого скота соответствует сдвигу от высокого к низкому аффинному состоянию». Эндокринология. 135 (5): 2130–6. Дои:10.1210 / en.135.5.2130. PMID 7956936.
- ^ а б c d е ж грамм час я j k л Boulpaep EL, Boron WF (2005). Медицинская физиология: клеточный и молекулярный подход. Сент-Луис, Миссури: Elsevier Saunders. п. 90. ISBN 1-4160-2328-3.
- ^ Уолтенбо С., Доан Т., Мелволд Р., Визелли С. (2008). Иммунология. Филадельфия: Wolters Kluwer Health / Lippincott Williams & Wilkins. п.20. ISBN 978-0-7817-9543-2.
внешняя ссылка
- База данных IUPHAR GPCR и сборник ионных каналов
- Рецептом плазматической мембраны человека
- Клетка + поверхность + рецепторы в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)

![{ displaystyle {[{ ce {L}}] + [{ ce {R}}] { ce {<=> [{K_ {d}}]}} [{ text {LR}}]} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8bc59879baab1d42236bb74c50da94e2ceef5afd)