Фактор роста эндотелия сосудов - Vascular endothelial growth factor
Фактор роста эндотелия сосудов (VEGF), первоначально известный как фактор проницаемости сосудов (VPF),[1] это сигнальный белок, вырабатываемый клетками, который стимулирует образование кровеносных сосудов. Чтобы быть конкретным, VEGF является подсемейством факторы роста, то фактор роста тромбоцитов семья цистиновый узел факторы роста. Они являются важным сигналом белки участвует в обоих васкулогенез (в de novo формирование эмбрионального сердечно-сосудистая система ) и ангиогенез (рост кровеносных сосудов из уже существующей сосудистой сети).
Это часть системы, которая восстанавливает снабжение тканей кислородом при недостаточном кровообращении, например, в условиях гипоксии.[2] Концентрация VEGF в сыворотке крови бронхиальная астма и сахарный диабет.[3]Нормальная функция VEGF - создание новых кровеносных сосудов во время эмбриональное развитие, новые кровеносные сосуды после травмы, мышцы после упражнений и новые сосуды (коллатеральное кровообращение ) для обхода закупоренных сосудов, что может способствовать развитию болезни. Солидный рак не может вырасти за пределы ограниченного размера без адекватного кровоснабжения; раковые образования, которые могут экспрессировать VEGF, способны расти и метастазировать. Сверхэкспрессия VEGF может вызвать сосудистые заболевания в сетчатка глаза и других частей тела. Такие препараты как афлиберцепт, бевацизумаб, ранибизумаб, и пегаптаниб может ингибировать VEGF и контролировать или замедлять эти заболевания.
История
В 1970 г. Иуда Фолкман и другие. описал фактор, секретируемый опухолями, вызывающими ангиогенез, и назвал его фактор ангиогенеза опухоли.[4] В 1983 году Зенгер и другие. идентифицировал фактор проницаемости сосудов секретируется опухолями у морских свинок и хомяков.[1] В 1989 году Феррара и Хензель описали идентичный фактор в фолликулярных клетках гипофиза крупного рогатого скота, который они очистили, клонировали и назвали VEGF. [5] Аналогичный альтернативный сплайсинг VEGF был обнаружен Тишером. и другие. в 1991 г.[6] Между 1996 и 1997 годами Кристинджер и Де Вос получили кристаллическую структуру VEGF, сначала с разрешением 2,5 Å, а затем с разрешением 1,9 Å.[7][8][9]
Fms-подобная тирозинкиназа-1 Феррара показала, что (flt-1) является рецептором VEGF. и другие. в 1992 г.[10] В рецептор домена вставки киназы (KDR), как было показано Терманом, является рецептором VEGF. и другие. и в 1992 году.[11] В 1998 г. нейропилин 1 и нейропилин 2 было показано, что они действуют как рецепторы VEGF.[12]
Классификация
У млекопитающих семейство VEGF состоит из пяти членов: VEGF-A, фактор роста плаценты (PGF ), VEGF-B, VEGF-C и VEGF-D. Последние члены были обнаружены после VEGF-A; до их открытия VEGF-A был известен как VEGF. Ряд белков, связанных с VEGF, кодируемых вирусами (VEGF-E ) и в яде некоторых змей (VEGF-F ) также были обнаружены.
| Тип | Функция |
|---|---|
| VEGF-A |
|
| VEGF-B | Эмбриональный ангиогенез (ткань миокарда, а именно)[13] |
| VEGF-C | Лимфангиогенез[нужна цитата ] |
| VEGF-D | Необходим для развития лимфатической сосудистой сети, окружающей бронхиолы легких.[нужна цитата ] |
| PlGF | Важен для васкулогенеза, также необходим для ангиогенеза при ишемии, воспалении, заживлении ран и раке.[нужна цитата ] |
Активность VEGF-A, как следует из названия, в основном изучалась на клетках сосудов. эндотелий, хотя он действительно влияет на ряд других типов клеток (например, на стимуляцию моноцит /макрофаг миграция, нейроны, раковые клетки, эпителиальные клетки почек). In vitro было показано, что VEGF-A стимулирует эндотелиальные клетки. митогенез и миграция клеток. VEGF-A также является сосудорасширяющим средством и увеличивает проницаемость микрососудов и первоначально назывался фактором проницаемости сосудов.
Изоформы

Существует несколько изоформ VEGF-A, которые возникают в результате альтернативное сращивание из мРНК с сингла, 8-экзон VEGFA ген. Они подразделяются на две группы, которые называются в соответствии с их сайтом сплайсинга концевого экзона (экзон 8): проксимальный сайт сплайсинга (обозначаемый VEGFххх) или дистальный сайт сплайсинга (VEGFхххб). Кроме того, альтернативное сплайсинг экзонов 6 и 7 изменяет их гепарин аффинность связывания и количество аминокислот (у людей: VEGF121, VEGF121б, VEGF145, VEGF165, VEGF165б, VEGF189, VEGF206; ортологи этих белков грызунов содержат на одну аминокислоту меньше). Эти домены имеют важные функциональные последствия для вариантов сплайсинга VEGF, так как терминальный (экзон 8) сайт сплайсинга определяет, являются ли белки проангиогенными (проксимальный сайт сплайсинга, экспрессируемый во время ангиогенеза) или антиангиогенными (дистальный сайт сплайсинга, выраженный в нормальном состоянии). ткани). Кроме того, включение или исключение экзонов 6 и 7 опосредуют взаимодействия с гепарансульфат протеогликаны (HSPG) и нейропилин корецепторы на поверхности клетки, повышая их способность связывать и активировать Рецепторы VEGF (VEGFR).[14] Недавно было показано, что VEGF-C является важным индуктором нейрогенеза в субвентрикулярной зоне мыши, не оказывая ангиогенных эффектов.[15]
Механизм
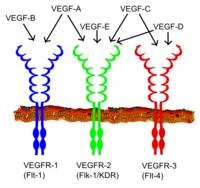
Все члены семейства VEGF стимулируют клеточные ответы, связываясь с тирозинкиназа рецепторы ( VEGFR ) на поверхности клетки, вызывая их димеризацию и активацию через трансфосфорилирование, хотя на разных сайтах, в разное время и в разных масштабах. Рецепторы VEGF имеют внеклеточную часть, состоящую из 7 иммуноглобулиноподобных доменов, единственную трансмембранную охватывающую область и внутриклеточную часть, содержащую расщепленный тирозинкиназа домен. VEGF-A связывается с VEGFR-1 (Flt-1 ) и VEGFR-2 (KDR / Flk-1 ).[17] VEGFR-2, по-видимому, опосредует почти все известные клеточные ответы на VEGF. Функция VEGFR-1 менее четко определена, хотя считается, что он модулирует передачу сигналов VEGFR-2.[18] Другая функция VEGFR-1 может заключаться в том, чтобы действовать как фиктивный / ложный рецептор, изолируя VEGF от связывания VEGFR-2 (это, по-видимому, особенно важно во время васкулогенеза у эмбриона). VEGF-C и VEGF-D, но не VEGF-A, являются лигандами для третьего рецептора (VEGFR-3 / Flt4 ), который является посредником лимфангиогенез. Рецептор (VEGFR3) представляет собой сайт связывания основных лигандов (VEGFC и VEGFD), который опосредует постоянное действие и функцию лигандов на клетках-мишенях. Фактор роста эндотелия сосудов С может стимулировать лимфангиогенез (через VEGFR3) и ангиогенез через VEGFR2. Фактор роста эндотелия сосудов-R3 был обнаружен в лимфатических эндотелиальных клетках при ХЛ многих видов, крупного рогатого скота, буйволов и приматов.[19]
Помимо привязки к VEGFR, VEGF связывается с рецепторными комплексами, состоящими из обоих нейропилины и VEGFR. Этот рецепторный комплекс имеет повышенную сигнальную активность VEGF в эндотелиальный клетки (кровеносный сосуд ).[20][21] Нейропилины (NRP) являются плейтрофный рецепторы и, следовательно, другие молекулы могут мешать передаче сигналов комплексов рецепторов NRP / VEGFR. Например, класс 3 семафорины конкурировать с VEGF165 для связывания NRP и, следовательно, может регулировать VEGF-опосредованный ангиогенез.[22]
Выражение
Продукция VEGF-A может быть индуцирована в клетке, которая не получает достаточно кислород.[17] Когда клетке не хватает кислорода, она производит HIF, фактор, индуцируемый гипоксией, фактор транскрипции. HIF стимулирует высвобождение VEGF-A, помимо других функций (включая модуляцию эритропоэза). Циркулирующий VEGF-A затем связывается с рецепторами VEGF на эндотелиальных клетках, запуская тирозинкиназа путь, ведущий к ангиогенезу.[требуется разъяснение ] Выражение ангиопоэтин-2 в отсутствие VEGF приводит к гибели эндотелиальных клеток и регрессии сосудов.[23] И наоборот, проведенное в Германии исследование in vivo обнаружили, что концентрации VEGF фактически снизились после 25% снижения потребления кислорода в течение 30 минут.[24] HIF1 альфа и HIF1 бета производятся постоянно, но HIF1 альфа очень высока.2 лабильный, поэтому в аэробных условиях он деградирует. Когда клетка становится гипоксической, HIF1 альфа сохраняется, а комплекс HIF1альфа / бета стимулирует высвобождение VEGF. Комбинированное использование микровезикул и 5-FU привело к повышенной химиочувствительности клеток плоскоклеточной карциномы в большей степени, чем использование только 5-FU или микровезикул. Кроме того, подавление экспрессии гена VEGF было связано со снижением экспрессии гена CD1.[25]
Клиническое значение
В болезни
VEGF-A и соответствующие рецепторы быстро активируются после травматического повреждения Центральная нервная система (ЦНС). VEGF-A высоко экспрессируется в острой и подострой стадиях повреждения ЦНС, но со временем экспрессия белка снижается. Этот промежуток времени экспрессии VEGF-A соответствует эндогенному реваскуляризация работоспособность после травмы.[22] Это предполагает, что VEGF-A / VEGF165 может использоваться в качестве мишени для стимуляции ангиогенеза после травм ЦНС. Однако существуют противоречивые научные отчеты об эффектах лечения VEGF-A на моделях повреждений ЦНС.[22]
VEGF-A имеет плохой прогноз в рак молочной железы. Многочисленные исследования показывают снижение общей выживаемости и выживаемости без заболеваний в опухолях, сверхэкспрессирующих VEGF. Сверхэкспрессия VEGF-A может быть ранним шагом в процессе метастаз, шаг, который участвует в «ангиогенном» переключении. Хотя VEGF-A коррелирует с плохой выживаемостью, точный механизм его действия на прогрессирование опухолей остается неясным.[нужна цитата ].
VEGF-A также выпускается в ревматоидный артрит в ответ на TNF-α, увеличивая проницаемость эндотелия и набухание, а также стимулируя ангиогенез (образование капилляров)[нужна цитата ].
VEGF-A также важен для диабетическая ретинопатия (ДР). Проблемы с микроциркуляцией в сетчатке глаза у людей с сахарный диабет может вызвать ишемию сетчатки, которая приводит к высвобождению VEGF-A и переключению баланса проангиогенного VEGFххх изоформы по сравнению с нормально экспрессируемым VEGFхххb изоформы. VEGFххх может затем вызвать образование новых кровеносных сосудов в сетчатке и в других местах глаза, предвещая изменения, которые могут угрожать зрению.
VEGF-A играет роль в патологии влажной формы возрастная дегенерация желтого пятна (AMD), которая является основной причиной слепоты у пожилых людей в промышленно развитом мире. Сосудистая патология AMD имеет определенное сходство с диабетической ретинопатией, хотя причина заболевания и типичный источник неоваскуляризации у этих двух заболеваний различаются.
Уровни VEGF-D в сыворотке значительно повышены у пациентов с ангиосаркома.[26]
После выпуска VEGF-A может вызвать несколько ответов. Это может вызвать клетка выжить, переехать или дифференцироваться дальше. Следовательно, VEGF является потенциальной мишенью для лечения рак. Первый препарат против VEGF, a моноклональное антитело названный бевацизумаб, был одобрен в 2004 г. Примерно 10–15% пациентов получают пользу от терапии бевацизумабом; однако биомаркеры эффективности бевацизумаба еще не известны.
Текущие исследования показывают, что VEGF не являются единственными промоторами ангиогенеза. Особенно, FGF2 и HGF являются мощными ангиогенными факторами.
Было обнаружено, что у пациентов, страдающих эмфиземой легких, уровень VEGF в легочных артериях снижен.
Также было показано, что VEGF-D сверхэкспрессируется в лимфангиолейомиоматоз и в настоящее время используется в качестве диагностического биомаркера при лечении этого редкого заболевания. [27].
в почка, повышенная экспрессия VEGF-A в клубочки непосредственно вызывает гипертрофию клубочков, которая связана с протеинурией.[28]
Изменения VEGF могут быть предиктором раннего начала преэклампсия.[29]
Генная терапия при рефрактерной стенокардии устанавливают экспрессию VEGF в эпикардиальных клетках, чтобы способствовать ангиогенезу.[30]
Смотрите также
- Протеазы в ангиогенезе
- Витаферин А, мощный ингибитор ангиогенеза
Рекомендации
- ^ а б Senger, DR; Галли, SJ; Дворжак, AM; Перруцци, Калифорния; Харви, ВС; Дворжак, Х.Ф. (25 февраля 1983 г.). «Опухолевые клетки выделяют фактор проницаемости сосудов, который способствует накоплению асцитной жидкости». Наука. 219 (4587): 983–5. Bibcode:1983Sci ... 219..983S. Дои:10.1126 / science.6823562. PMID 6823562.
- ^ Палмер, Бифф Ф .; Клегг, Дебора Дж. (2014). «Ощущение кислорода и метаболический гомеостаз». Молекулярная и клеточная эндокринология. 397 (1–2): 51–57. Дои:10.1016 / j.mce.2014.08.001. PMID 25132648.
- ^ Купер, Марк; Димитрия Вранес; Шериф Юсеф; Стивен А. Стакер; Элисон Дж. Кокс; Бишой Ризкалла; Дэвид Дж. Кэсли; Леон А. Бах; Даррен Дж. Келли; Ричард Э. Гилберт (ноябрь 1999 г.). «Повышенная экспрессия в почках фактора роста эндотелия сосудов (VEGF) и его рецептора VEGFR-2 при экспериментальном диабете» (PDF). Сахарный диабет. 48 (11): 2229–2239. Дои:10.2337 / диабет.48.11.2229. PMID 10535459. Получено 6 ноября 2013.
- ^ Фолкман, Дж (1 февраля 1971 г.). «Выделение опухолевого фактора, ответственного за ангиогенез». Журнал экспериментальной медицины. 133 (2): 275–288. Дои:10.1084 / jem.133.2.275. ЧВК 2138906. PMID 4332371.
- ^ Феррара, Северная Каролина; Henzel, WJ (15 июня 1989 г.). «Фолликулярные клетки гипофиза секретируют новый гепарин-связывающий фактор роста, специфичный для эндотелиальных клеток сосудов». Сообщения о биохимических и биофизических исследованиях. 161 (2): 851–8. Дои:10.1016 / 0006-291x (89) 92678-8. PMID 2735925.
- ^ Тишер, Э; Mitchell, R; Хартман, Т; Сильва, М; Gospodarowicz, D; Fiddes, JC; Абрахам, Дж. А (25 июня 1991 г.). «Человеческий ген фактора роста эндотелия сосудов. Множественные белковые формы кодируются посредством альтернативного сплайсинга экзонов». Журнал биологической химии. 266 (18): 11947–54. PMID 1711045.
- ^ Christinger, Hans W .; Muller, Yves A .; Berleau, Lea T .; Кейт, Брюс А .; Каннингем, Брайан Ч .; Феррара, Наполеоне; де Вос, Абрахам М. (ноябрь 1996 г.). «Кристаллизация рецепторсвязывающего домена фактора роста эндотелия сосудов». Белки: структура, функции и генетика. 26 (3): 353–357. Дои:10.1002 / (SICI) 1097-0134 (199611) 26: 3 <353 :: AID-PROT9> 3.0.CO; 2-E. PMID 8953654.
- ^ Мюллер, Ю.А. Ли, Б; Кристинджер, HW; Уэллс, JA; Каннингем, Британская Колумбия; де Вос, AM (8 июля 1997 г.). «Фактор роста эндотелия сосудов: кристаллическая структура и функциональное картирование сайта связывания рецептора киназного домена». Труды Национальной академии наук Соединенных Штатов Америки. 94 (14): 7192–7. Bibcode:1997ПНАС ... 94.7192М. Дои:10.1073 / пнас.94.14.7192. ЧВК 23789. PMID 9207067.
- ^ Мюллер, Ю.А. Кристинджер, HW; Кейт, BA; де Вос, AM (15 октября 1997 г.). «Кристаллическая структура фактора роста эндотелия сосудов (VEGF) улучшена до разрешения 1,93 A: гибкость множественных копий и связывание с рецептором». Структура. 5 (10): 1325–38. Дои:10.1016 / s0969-2126 (97) 00284-0. PMID 9351807.
- ^ де Фрис, C; Escobedo, JA; Ueno, H; Houck, K; Феррара, Северная Каролина; Уильямс, LT (21 февраля 1992 г.). «Fms-подобная тирозинкиназа, рецептор фактора роста эндотелия сосудов». Наука. 255 (5047): 989–91. Bibcode:1992Sci ... 255..989D. Дои:10.1126 / наука.1312256. PMID 1312256.
- ^ Терман, Б.И.; Dougher-Vermazen, M; Carrion, ME; Димитров, Д; Армеллино, округ Колумбия; Gospodarowicz, D; Бёлен, П. (30 сентября 1992 г.). «Идентификация тирозинкиназы KDR в качестве рецептора фактора роста эндотелиальных клеток сосудов». Сообщения о биохимических и биофизических исследованиях. 187 (3): 1579–86. Дои:10.1016 / 0006-291x (92) 90483-2. PMID 1417831.
- ^ Сокер, S; Такашима, S; Мяо, штаб-квартира; Neufeld, G; Клагсбрун, М. (20 марта 1998 г.). «Нейропилин-1 экспрессируется эндотелиальными и опухолевыми клетками в качестве изоформ-специфичного рецептора фактора роста эндотелия сосудов». Клетка. 92 (6): 735–45. Дои:10.1016 / s0092-8674 (00) 81402-6. PMID 9529250.
- ^ Клаэссон-Уэлш, Л. (20 августа 2008 г.). "VEGF-B в нашем сердце: специфический эффект VEGF-B при ишемии миокарда". Артериосклероз, тромбоз и биология сосудов. 28 (9): 1575–1576. Дои:10.1161 / ATVBAHA.108.170878. PMID 18716319.
- ^ Cébe Suarez, S; Пьерен, М; Cariolato, L; Arn, S; Hoffmann, U; Богуцкий, А; Манлий, C; Дерево, Дж; Баллмер-Хофер, К. (2006). «Вариант сплайсинга VEGF-A, дефектный по связыванию гепарансульфата и нейропилина-1, демонстрирует ослабленную передачу сигналов через VEGFR-2» (PDF). Клеточные и молекулярные науки о жизни. 63 (17): 2067–2077. Дои:10.1007 / s00018-006-6254-9. PMID 16909199.
- ^ Шин, Ю. Дж .; Choi, J. S .; и другие. (2010). «Индукция мРНК рецептора-3 фактора роста эндотелия сосудов в глиальных клетках после очаговой церебральной ишемии у крыс». J Нейроиммунол. 229 (1–2): 81–90. Дои:10.1016 / j.jneuroim.2010.07.008. PMID 20692049.
- ^ Cancepublications.com.
- ^ а б Холмс, Кэтрин; Робертс, Оуайн Л.Л .; Thomas, Angharad M .; Кросс, Майкл Дж. (2007). «Рецептор фактора роста эндотелия сосудов-2: структура, функция, внутриклеточная передача сигналов и терапевтическое ингибирование». Сотовая связь. 19 (10): 2003–12. Дои:10.1016 / j.cellsig.2007.05.013. PMID 17658244.
- ^ Karkkainen, M.J .; Петрова, Т.В. (2000). «Рецепторы фактора роста эндотелия сосудов в регуляции ангиогенеза и лимфангиогенеза». Онкоген. 19 (49): 5598–5605. Дои:10.1038 / sj.onc.1203855. PMID 11114740.
- ^ Али, Ибне; и другие. (2013). «Экспрессия и локализация локально продуцируемых факторов роста, регулирующих лимфангиогенез на разных стадиях эстрального цикла в желтом теле буйвола» (Bubalus bubalis) ». Териогенология. 81 (3): 428–436. Дои:10.1016 / j.theriogenology.2013.10.017. PMID 24246422.
- ^ Soker, S .; Takashima, S .; Miao, H. Q .; Neufeld, G .; Клагсбрун, М. (1998). «Нейропилин-1 экспрессируется эндотелиальными и опухолевыми клетками в качестве изоформ-специфичного рецептора фактора роста эндотелия сосудов». Клетка. 92 (6): 735–745. Дои:10.1016 / s0092-8674 (00) 81402-6. ISSN 0092-8674. PMID 9529250.
- ^ Herzog, B; Pellet-Many, C; Britton, G; Харцулакис, В; Захари И.С. (2011). «Связывание VEGF с NRP1 необходимо для стимуляции VEGF миграции эндотелиальных клеток, образования комплекса между NRP1 и VEGFR2 и передачи сигналов через фосфорилирование FAK Tyr407». Молекулярная биология клетки. 22 (15): 2766–2776. Дои:10.1091 / mbc.E09-12-1061. ISSN 1939-4586. ЧВК 3145551. PMID 21653826.
- ^ а б c Mecollari, V; Nieuwenhuis, B; Verhaagen, J (2014). «Перспектива роли передачи сигналов семафорина класса III в травме центральной нервной системы». Границы клеточной неврологии. 8: 328. Дои:10.3389 / fncel.2014.00328. ЧВК 4209881. PMID 25386118.
- ^ Харми, Джудит (2004). VEGF и рак. Джорджтаун, Техас: Landes Bioscience / Eurekah.com New York, N.Y. Kluwer Academic / Plenum Publishers. ISBN 978-0-306-47988-5.
- ^ Oltmanns, K. M .; Геринг, H; Рудольф, S; Шультес, В; Хакенберг, К; Schweiger, U; Родился, Дж; Fehm, H.L .; Петерс, А (2006). «Острая гипоксия снижает концентрацию VEGF в плазме у здоровых людей». AJP: Эндокринология и метаболизм. 290 (3): E434–9. Дои:10.1152 / ajpendo.00508.2004. PMID 16219663.
- ^ Гада А. Абд Эль Латиф, Иман М. Абушади и Дина Сабри Снижение экспрессии генов VEGF и циклина D1 повышает химиочувствительность клеток плоскоклеточного рака человека к микровезикулам, полученным из 5-фторурацила и / или мезенхимальных стволовых клеток E.D.J. Vol. 65, 2, стр. 1217–1228; 2019. DOI: 10.21608 / EDJ.2019.72197
- ^ Amo, Y .; Masuzawa, M .; Hamada, Y .; Кацуока, К. (2004). «Сывороточные концентрации фактора роста эндотелия сосудов-D у пациентов с ангиосаркомой». Британский журнал дерматологии. 150 (1): 160–1. Дои:10.1111 / j.1365-2133.2004.05751.x. PMID 14746640.
- ^ Янг, Л. Р .; Inoue, Y .; Маккормак, Ф. X. (2008). «Диагностический потенциал сывороточного VEGF-D для лимфангиолейомиоматоза». Медицинский журнал Новой Англии. 358 (2): 199–200. Дои:10.1056 / NEJMc0707517. ЧВК 3804557. PMID 18184970.
- ^ Liu, E .; Моримото, М .; Kitajima, S .; Koike, T .; Yu, Y .; Shiiki, H .; Nagata, M .; Watanabe, T .; Фан, Дж. (2007). «Повышенная экспрессия фактора роста эндотелия сосудов в почках приводит к прогрессирующему нарушению клубочковых функций». Журнал Американского общества нефрологов. 18 (7): 2094–104. Дои:10.1681 / ASN.2006010075. PMID 17554151.
- ^ Andraweera, P.H .; Деккер, Г. А .; Робертс, К. Т. (2012). «Семейство факторов роста эндотелия сосудов при неблагоприятных исходах беременности». Обновление репродукции человека. 18 (4): 436–457. Дои:10.1093 / humupd / dms011. PMID 22495259.
- ^ «Генная терапия при рефрактерной стенокардии». Геномный контекст. 16 октября 2019 г.. Получено 16 октября 2019.
дальнейшее чтение
- Bengoetxea H, Argandoña EG, Lafuente JV (2008). «Влияние визуального опыта на экспрессию фактора роста эндотелия сосудов во время постнатального развития зрительной коры головного мозга крысы». Кора головного мозга. 18 (7): 1630–39. Дои:10.1093 / cercor / bhm190. ЧВК 2430152. PMID 17986606.
- Zan L, Wu H, Jiang J, Zhao S, Song Y, Teng G, Li H, Jia Y, Zhou M, Zhang X, Qi J, Wang J (2011). «Временной профиль Src, SSeCKS и ангиогенных факторов после очаговой церебральной ишемии: корреляция с ангиогенезом и отеком мозга». Neurochem. Int. 58 (8): 872–9. Дои:10.1016 / j.neuint.2011.02.014. ЧВК 3100427. PMID 21334414.
- Zan L, Zhang X, Xi Y, Wu H, Song Y, Teng G, Li H, Qi J, Wang J (2014). «Src регулирует ангиогенные факторы и проницаемость сосудов после очаговой церебральной ишемии-реперфузии». Неврология. 262: 118–28. Дои:10.1016 / j.neuroscience.2013.12.060. ЧВК 3943922. PMID 24412374.
- Ван Дж, Фу Х, Цзян Ц., Ю Л, Ван М, Хань В, Лю Л, Ван Дж (2014). «Трансплантация мононуклеарных клеток костного мозга способствует терапевтическому ангиогенезу за счет усиления сигнального пути VEGF-VEGFR2 в модели сосудистой деменции у крыс». Behav. Brain Res. 265: 171–80. Дои:10.1016 / j.bbr.2014.02.033. ЧВК 4000455. PMID 24589546.
- Феррара Н., Гербер HP (2002). «Роль фактора роста эндотелия сосудов в ангиогенезе». Acta Haematol. 106 (4): 148–56. Дои:10.1159/000046610. PMID 11815711.
- Орпана А, Сальвен П. (2003). «Ангиогенные и лимфангиогенные молекулы при гематологических злокачественных новообразованиях». Лейк. Лимфома. 43 (2): 219–24. Дои:10.1080/10428190290005964. PMID 11999550.
- Афувапе А.О., Кириакидис С., Палеолог Е.М. (2003). «Роль ангиогенной молекулы VEGF в патогенезе ревматоидного артрита». Histol. Гистопатол. 17 (3): 961–72. PMID 12168808.
- де Бонт ES, Neefjes VM, Rosati S, et al. (2003). «Образование новых сосудов и аберрантная передача сигналов VEGF / VEGFR при остром лейкозе: имеет ли это значение?». Лейк. Лимфома. 43 (10): 1901–9. Дои:10.1080/1042819021000015844. PMID 12481883.
- Риа Р., Роккаро А.М., Мерчионн Ф. и др. (2003). «Фактор роста эндотелия сосудов и его рецепторы при множественной миеломе». Лейкемия. 17 (10): 1961–6. Дои:10.1038 / sj.leu.2403076. PMID 14513045.
- Колдуэлл Р.Б., Бартоли М., Бехзадиан М.А. и др. (2004). «Фактор роста эндотелия сосудов и диабетическая ретинопатия: патофизиологические механизмы и перспективы лечения». Диабет Метаб. Res. Rev. 19 (6): 442–55. Дои:10.1002 / дмрр.415. PMID 14648803.
- Патан, Сибилла (2004). «Васкулогенез и ангиогенез». Ангиогенез при опухолях головного мозга. Лечение рака и исследования. 117. С. 3–32. Дои:10.1007/978-1-4419-8871-3_1. ISBN 978-1-4613-4699-9. PMID 15015550.
- Machein, Марсия Регина; Plate, Карл Хайнц (2004). «Роль VEGF в ангиогенезе развития и в ангиогенезе опухолей в головном мозге». Ангиогенез при опухолях головного мозга. Лечение рака и исследования. 117. С. 191–218. Дои:10.1007/978-1-4419-8871-3_13. ISBN 978-1-4613-4699-9. PMID 15015562.
- Еремина В, Кваггин С.Е. (2004). «Роль VEGF-A в развитии и функции клубочков». Curr. Мнение. Нефрол. Гипертоническая болезнь. 13 (1): 9–15. Дои:10.1097/00041552-200401000-00002. PMID 15090854.
- Сторкебаум Э, Ламбрехтс Д, Кармелиет П (2004). «VEGF: когда-то рассматривался как специфический ангиогенный фактор, теперь вовлеченный в нейрозащиту». BioEssays. 26 (9): 943–54. Дои:10.1002 / bies.20092. PMID 15351965.
- Рибатти Д. (2005). «Решающая роль фактора проницаемости сосудов / фактора роста эндотелия сосудов в ангиогенезе: исторический обзор». Br. J. Haematol. 128 (3): 303–9. Дои:10.1111 / j.1365-2141.2004.05291.x. PMID 15667531.
- Лоурейро Р.М., Д'Амор, Пенсильвания (2005). «Транскрипционная регуляция фактора роста эндотелия сосудов при раке». Фактор роста цитокинов Rev. 16 (1): 77–89. Дои:10.1016 / j.cytogfr.2005.01.005. PMID 15733833.
- Хербст Р.С., Онн А., Сандлер А. (2005). «Ангиогенез и рак легких: прогностические и терапевтические последствия». J. Clin. Онкол. 23 (14): 3243–56. Дои:10.1200 / JCO.2005.18.853. PMID 15886312.
- Пуфе Т., Курц Б., Петерсен В. и др. (2006). «Влияние биомеханических параметров на экспрессию VEGF и эндостатина в костно-суставной системе». Анна. Анат. 187 (5–6): 461–72. Дои:10.1016 / j.aanat.2005.06.008. PMID 16320826.
- Тонг Дж. П., Яо Ю. Ф. (2006). «Вклад VEGF и PEDF в хориоидальный ангиогенез: необходимость сбалансированного выражения». Clin. Биохим. 39 (3): 267–76. Дои:10.1016 / j.clinbiochem.2005.11.013. PMID 16409998.
- Lambrechts D, Carmeliet P (2007). «VEGF на нервно-сосудистом интерфейсе: терапевтические последствия для заболевания двигательных нейронов». Биохим. Биофиз. Acta. 1762 (11–12): 1109–21. Дои:10.1016 / j.bbadis.2006.04.005. PMID 16784838.
- Мацумото Т., Мугишима Х (2006). «Передача сигнала через рецепторы фактора роста эндотелия сосудов (VEGF) и их роль в атерогенезе». J. Atheroscler. Тромб. 13 (3): 130–5. Дои:10.5551 / jat.13.130. PMID 16835467.
- Богерт Э, Ван Дамм П, Ван ден Бош Л., Робберехт В. (2006). «Фактор роста эндотелия сосудов при боковом амиотрофическом склерозе и других нейродегенеративных заболеваниях». Мышечный нерв. 34 (4): 391–405. Дои:10.1002 / mus.20609. PMID 16856151.
- Меркурио AM, Lipscomb EA, Bachelder RE (2006). «Неангиогенные функции VEGF при раке груди». Журнал биологии и неоплазии молочных желез. 10 (4): 283–90. CiteSeerX 10.1.1.476.2778. Дои:10.1007 / s10911-006-9001-9. PMID 16924371.
- Макинде Т., Мерфи РФ, Агравал Д.К. (2007). «Иммуномодулирующая роль фактора роста эндотелия сосудов и ангиопоэтина-1 в ремоделировании дыхательных путей». Curr. Мол. Med. 6 (8): 831–41. Дои:10.2174/156652406779010795. PMID 17168735.
- Рини Б.И., Ратмелл В.К. (2007). «Биологические аспекты и стратегии связывания фактора роста эндотелия сосудов при почечно-клеточной карциноме». Clin. Рак Res. 13 (2 Pt 2): 741s – 746s. Дои:10.1158 / 1078-0432.CCR-06-2110. PMID 17255303.
- Цзян Ц., Цзо Ф, Ван И, Лу Х, Ян Цюй, Ван Дж (2016). «Прогестерон изменяет экспрессию VEGF и BDNF и способствует нейрогенезу после ишемического инсульта». Мол. Нейробиол. 54: 571–581. Дои:10.1007 / s12035-015-9651-y. ЧВК 4938789. PMID 26746666.
- Роджерс Л.С., Лалани С., Харди К.М., Сян X, Брока Д., Антин П.Б., Камениш Т.Д. (2006). «Деполимеризованный гиалуронан индуцирует фактор роста эндотелия сосудов, негативный регулятор трансформации эпителия в мезенхиму в процессе развития». Circ. Res. 99 (6): 583–9. Дои:10.1161 / 01.RES.0000242561.95978.43. PMID 16931798.
- Qaum, T; Сюй, Q; Joussen, AM; и другие. (2001). «Нарушение гемато-ретинального барьера при раннем диабете, инициированное VEGF». Инвестируйте офтальмол Vis Sci. 42 (10): 2408–2413. PMID 11527957.
внешняя ссылка
- Сосудистые + эндотелиальные + факторы роста + в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Протеопедия Сосудистый эндотелиальный фактор роста - Структура фактора роста эндотелия сосудов в интерактивном 3D

