Мускарин - Muscarine
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 2,5-Ангидро-1,4,6-тридеокси-6- (триметиламмонио) -D-рибо-гекситол | |
| Другие имена L- (+) - мускарин, мускарин, (2S,4р,5S) - (4-гидрокси-5-метилтетрагидрофуран-2-илметил) -триметиламмоний | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.005.541 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C9ЧАС20НЕТ2+ | |
| Молярная масса | 174,26 г / моль |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |

Мускарин, L- (+) - мускарин, или же мускарин это натуральный продукт найдено в некоторых грибы, особенно в Inocybe и Клитоцибе виды, такие как смертельные C. dealbata. Грибы в родах Энтолома и Микена также было обнаружено, что они содержат уровни мускарина, который может быть опасен при проглатывании. Мускарин был обнаружен в безвредных следовых количествах в Подберезовик, Гигроциба, Лактарий и Russula. Следовые концентрации мускарина также обнаруживаются в Мухомор мухомор, хотя фармакологически более подходящим соединением из этого гриба является Z-препарат -подобный алкалоид мусцимол. A. muscaria плодовые тела содержат переменную дозу мускарина, обычно около 0,0003% сырого веса. Это очень мало, и симптомы токсичности возникают очень редко. Inocybe и Клитоцибе содержат мускарин в концентрации до 1,6%.[1]
Мускарин - неселективный агонист из мускариновые рецепторы ацетилхолина.
История
Название мускарин происходит от Мухомор мухомор, из которого он был впервые выделен немецкими химиками Освальд Шмидеберг и Ричард Коппе в Дерптский университет, которые сообщили о своих открытиях в 1869 году.[2] Грибной конкретное имя в свою очередь исходит из латинский Musca для мухи, потому что гриб часто использовался для привлечения и ловли мух, отсюда и его обычное название «мухомор».
Мускарин был первым парасимпатомиметик вещество, когда-либо изученное и вызывает глубокую активацию периферийный парасимпатическая нервная система это может закончиться нарушением кровообращения и смертью. Быть четвертичная аммониевая соль, мускарин менее полно всасывается из желудочно-кишечный тракт чем третичные амины, и не пересекает гематоэнцефалический барьер.[3]Мускариновые агонисты активируют мускариновые рецепторы, а никотиновые агонисты активируют никотиновые рецепторы. Оба являются холиномиметиками прямого действия; они производят свои эффекты, связываясь с холинергическими рецепторами и активируя их. Окончательное доказательство структуры было дано Францем Еллинеком и его коллегами в 1957 году с помощью дифракция рентгеновских лучей анализ;[4] Еллинек далее описал трехмерную структуру молекулы, используя хлорид мускарина.[5] Эти новые открытия положили начало исследованиям фармакологии мускарина и мускариноподобных веществ, структурно связанных с ацетилхолин.
Структура и реакционная способность
Мускарин имитирует функцию природного нейротрансмиттера ацетилхолина в мускариновой части холинергической нервной системы, несмотря на менее гибкую структуру из-за пятичленного кольца в молекулярном скелете. За исключением кислорода с двойной связью, вся структура ацетилхолина присутствует в правой нижней части мускарина (см. Рисунок 3 ниже для сравнения обеих структур).[6]
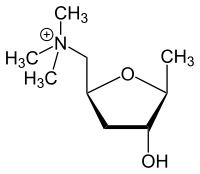
Есть две зеркальные формы мускарина, названные: 2S-мускарин и 2R-мускарин.

Рисунок 1. Структурная формула 2S-мускарина.
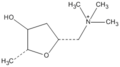
Рисунок 2. Структурная формула 2R-мускарина.

Рисунок 3. Ацетилхолин для сравнения.
Эффективный синтез (+) - мускарина
На схеме ниже представлен очень эффективный способ синтеза (+) - мускарина, согласно данным ученых Чана и Ли в канадском химическом журнале в 1992 году.[7]S - (-) - Этиллактат (2) (рис. 4) превращается в 2,6-дихлорбензиловый эфир (3). Гидрид диизобутилалюминия (DIBAL) восстановление 2,6-дихлорбензилового эфира дает альдегид (4). Обработка неочищенного альдегида аллилбромидом и цинкового порошка в воде с помощью NH4Cl в качестве катализатора дает анти: син-смесь 5a и 5b. Лечение 5a йодом при СН3CN при 0 ° C дает циклизованный продукт 6a. Наконец, обработка 6a избытком триметиламина в этаноле дала (+) - мускарин (2S, 4R, 5S). Аналогичная последовательность реакций с 5b дает (+) - эпимускарин (7).[7]

Другие синтезы
Его можно синтезировать разными способами из совершенно разных веществ,[8][9][10][11][12][13][14][15][16][17] особенно из 2,5-диметил-3-карбоксиметилфлюрана.
Фармакология
Фармакодинамика
Мускарин имитирует действие нейротрансмиттер ацетилхолин к мучительный мускариновые рецепторы ацетилхолина. Эти рецепторы были названы в честь мускарина, чтобы отличать их от других. ацетилхолин рецепторы (никотиновые рецепторы ), которые сравнительно не реагируют на мускарин. Есть 5 различных типов мускариновых рецепторов; M1, M2, M3, M4 и M5. Большинство тканей выражают смесь подтипов.2 И м3 подтипы опосредуют мускариновые ответы на периферические вегетативные ткани. M1 И м4 подтипы более многочисленны в мозг и вегетативные ганглии.Рецепторы с нечетными номерами, M1, М3 И м5, взаимодействовать с граммq белки для стимуляции гидролиза фосфоинозитидов и высвобождения внутриклеточного кальция. И наоборот, рецепторы с четным номером M2 И м4, взаимодействовать с граммя белки для ингибирования аденилатциклазы, что приводит к снижению внутриклеточной концентрации циклического аденозинмонофосфата (цАМФ). Большинство агонистов мускариновых рецепторов не являются селективными для подтипов.[18]
Мускариновые рецепторы также передают сигналы другими путями, например, через G бета-гамма комплекс модуляция калиевые каналы. Это позволяет мускарину модулировать клеточную возбудимость через мембранный потенциал.
Метаболизм
Существует мало исследований метаболизма мускарина в организме человека, предполагающих, что это соединение не метаболизируется человеком. Хотя в области метаболизма ацетилхолина проводились обширные исследования. ацетилхолинэстераза, мускарин не метаболизируется этим ферментом, что частично объясняет потенциальную токсичность соединения. Мускарин хорошо растворяется в воде. Наиболее вероятный путь выхода мускарина из крови - это почечный клиренс; в конечном итоге он выйдет из организма с мочой.[19]
Медицинское использование
Эта секция нужно больше медицинские справки за проверка или слишком сильно полагается на основные источники. (Ноябрь 2019) |
Мускариновые агонисты используются в качестве лекарств при лечении глаукома, послеоперационный кишечная непроходимость, врожденный мегаколон, задержка мочи и ксеростомия. Мускарин противопоказан у людей с заболеваниями, которые делают их восприимчивыми к парасимпатической стимуляции, у людей с астма или же ХОБЛ, или людей, у которых язвенная болезнь болезнь. Также люди с препятствием в желудочно-кишечный или же мочеиспускательный канал не назначают мускарин, потому что он усугубит непроходимость, вызывая повышение давления, которое может привести к перфорации.
Эффективность
Поскольку мускарин действует на мускариновый рецептор ацетилхолина, лучшее сравнение можно провести с ацетилхолином, который обычно воздействует на этот рецептор. Чистый мускарин по сравнению с чистым ацетилхолином в большинстве случаев более эффективен, его действие всегда медленнее, но дольше, чем у ацетилхолина. Возможным объяснением этого длительного поведения может быть то, что мускарин не гидролизуется ацетилхолинэстеразой в синаптической щели.[20]
Токсикология
Отравление мускарином характеризуется: миоз, помутнение зрения, повышенное слюноотделение, излишний потливость, слезотечение, бронхиальный секрет, бронхоспазм, брадикардия, спазмы в животе, повышенная секреция желудочной кислоты, диарея и полиурия. Если мускарин достигает мозга, он может вызвать тремор, судороги и переохлаждение.Сердечные желудочки содержать мускариновые рецепторы которые опосредуют уменьшение силы сокращений, что приводит к снижению артериального давления. Если мускарин вводится внутривенно, мускарин может вызвать острый нарушение кровообращения с остановка сердца.[1]Симптомы отравления грибами, богатыми мускарином, особенно Inocybe, очень типичны: симптомы проявляются рано, через четверть-два часа, с головной болью, тошнотой, рвотой и сжатием глотка. Затем наступает слюноотделение, слезотечение и диффузное потоотделение в сочетании с миозом, нарушенным. проживание, и снижение зрения. Желудок и тонкий кишечник колики приводит к диарее и болезненным позывам к мочеиспусканию. Бронхоспазм приводит к астматическим приступам и тяжелым одышка, и брадикардия в сочетании с выраженными гипотония и расширение сосудов приводит к циркуляторный шок. Смерть через 8-9 часов регистрируется примерно в 5% случаев, но ее можно полностью избежать с помощью своевременной диагностики и лечения атропин.[21]
Противоядие
Антимускариновые препараты Такие как атропин может использоваться как противоядие к мускарину. Атропин, как и мускарин, является алкалоидом, но в отличие от мускарина является антагонистом мускариновых рецепторов. Следовательно, он подавляет действие ацетилхолина. расширить зрачок и расслабляют цилиарную мышцу, используются при лечении воспалительного увеита и ассоциированы с глаукомой. Они также используются для лечения недержания мочи и заболеваний, характеризующихся повышенной подвижностью кишечника, таких как синдром раздраженного кишечника.Мускариновые антагонисты часто называют парасимпатолитики потому что они имеют тот же эффект, что и агенты, блокирующие постганглионарные парасимпатические нервы.
Рекомендации
- ^ а б Лурье, Y; Вассер, ИП; Таха, М; Shehade, H; Ниджим, Дж; Hoffmann, Y; Базис, F; Варди, М; Лавон, О; Суаед, S; Бишарат, Б; Бентур, Y (июль 2009 г.). «Отравление грибами видами рода Inocybe (гриб с волокнистой головкой): серия случаев с точной видовой идентификацией ». Клиническая токсикология. 47 (6): 562–5. Дои:10.1080/15563650903008448. PMID 19566380. S2CID 205902282.
- ^ Schmiedeberg, O .; Коппе, Р. (1869). Das Muscarin, das giftige Alkaloid des Fliegenpilzes (Agaricus muscarius L.), seine Darstellung, chemischen Eigenschaften, physologischen Wirkungen ,xicologische Bedeutung und sein Verhältniss zur Pilzvergiftung im allgemeinen [Мускарин, ядовитый алкалоид мухомора (Agaricus muscarius L.), его приготовление, химические свойства, физиологические эффекты, токсикологическое значение и его отношение к отравлению грибами в целом.]. Лейпциг: Verlag von F.C.W. Фогель.
- ^ Паппано Ахиллес Дж. «Глава 7. Лекарства, активирующие холинорецепторы и ингибирующие холинэстеразу» (Глава). Кацунг Б.Г.: Основы и клиническая фармакология, 11e В архиве 2009-09-10 на Wayback Machine
- ^ Kögl, F .; Салеминк, C.A .; Schouten, H .; Еллинек, Ф. (1957). «Убер Мускарин. III». Recueil des Travaux Chimiques des Pays-Bas (на немецком). 76 (2): 109–127. Дои:10.1002 / recl.19570760204.
- ^ Еллинек, Ф. (1957). «Строение мускарина». Acta Crystallographica. 10 (4): 277–280. Дои:10.1107 / S0365110X57000845.
- ^ Frydenvang, K .; Дженсен Б. (15 мая 1993 г.). «Структуры пикрата мускарина и тетрафенилбората мускарина». Acta Crystallographica Раздел C. 49 (5): 985–990. Дои:10.1107 / S0108270192012198.
- ^ а б Chan, T. H .; Ли, К. Дж. (Ноябрь 1992 г.). «Краткий синтез (+) - мускарина». Канадский химический журнал. 70 (11): 2726–2729. Дои:10.1139 / v92-346.
- ^ Kögl, F .; Салеминк, К. А .; Schouten, H .; Еллинек, Ф. (2010). «Убер Мускарин. III». Recueil des Travaux Chimiques des Pays-Bas. 76 (2): 109. Дои:10.1002 / recl.19570760204.
- ^ Kögl, F .; Cox, H.C .; Салеминк, К. А. (1957). «Убер Мускарин». Experientia. 13 (4): 137–8. Дои:10.1007 / BF02158130. PMID 13447893. S2CID 38142806.
- ^ Corrodi, H .; Hardegger, E .; Kögl, F .; Зеллер, П. (1957). "Synthese von Stereoisomeren des Muscarins". Experientia. 13 (4): 138–9. Дои:10.1007 / BF02158131. PMID 13447894. S2CID 28914321.
- ^ Cox, H.C .; Hardegger, E .; Kögl, F .; Liechti, P .; Lohse, F .; Салеминк, К. А. (1958). "Uber Muscarin. 9. Mitteilung. Uber die Synthese von racemischem Muscarin, seine Spaltung in die Antipoden und die Herstellung von (-) - Muscarin aus D-Glucosamin". Helvetica Chimica Acta. 41: 229–234. Дои:10.1002 / hlca.660410129.
- ^ Matsumoto, T .; Ichihara, A .; Ито, Н. (1969). «Простой стереоспецифический синтез dl-мускарина и dl-алломускарина». Тетраэдр. 25 (24): 5889. Дои:10.1016 / S0040-4020 (01) 83096-9.
- ^ Тем не менее, W. C .; Шнайдер, Дж. А. (1980). «Хелатно-контролируемый синтез (. + -.) - мускарина». Журнал органической химии. 45 (16): 3375. Дои:10.1021 / jo01304a056.
- ^ Whiting, J .; Au-Young, Y. -K .; Белло, Б. (1972). «Удобный синтез L (+) - мускарина». Канадский химический журнал. 50 (20): 3322. Дои:10.1139 / v72-532.
- ^ Мубарак, А. М .; Браун, Д. М. (1980). «Простой стереоспецифический синтез (+) - мускарина». Буквы Тетраэдра. 21 (25): 2453. Дои:10.1016 / S0040-4039 (00) 93174-5.
- ^ Мубарак, А. М .; Браун, Д. М. (1982). «Стереоспецифический синтез (+) - мускарина». Журнал химического общества, Perkin Transactions 1: 809. Дои:10.1039 / P19820000809.
- ^ Pochet, S .; Хюинь Динь Там (1982). «Стереоспецифический синтез мускаринов и алломускаринов в D- и L-сериях». Журнал органической химии. 47 (2): 193. Дои:10.1021 / jo00341a003.
- ^ Теодор М. Броуди; Джозеф Ларнер; Кеннет П. Миннеман, ред. (1998). «Глава 9». Фармакология человека: от молекулярного до клинического (3-е изд.). Сент-Луис, Миссури: Мосби. ISBN 0815124562.
- ^ Робертс Бартолоу, «Практический трактат по Материи медике и терапии», 1908 г., ISBN 978-1-143-46767-7,
- ^ Фрейзер, П.Дж. (март 1957 г.). «Фармакологическое действие чистого мускарина хлорида». Br J Pharmacol Chemother. 12 (1): 47–52. Дои:10.1111 / j.1476-5381.1957.tb01361.x. ЧВК 1509643. PMID 13413151.
- ^ Питер Г. Васер; Химия и фармакология мускарина, мускарона и некоторых родственных соединений; Факультет фармакологии, Цюрихский университет, Швейцария, 1961 г.



