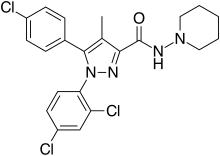
Римонабант - Rimonabant
 | |
 | |
| Клинические данные | |
|---|---|
| AHFS /Drugs.com | Информация о лекарствах для потребителей |
| Данные лицензии | |
| Беременность категория |
|
| Маршруты администрация | Устный |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | Неопределенный |
| Связывание с белками | Почти 100% |
| Метаболизм | Печеночный, CYP3A4 участвует |
| Устранение период полураспада | Переменная: От 6 до 9 дней с нормальным ИМТ 16 дней, если ИМТ> 30 |
| Экскреция | Фекальный (86%) и почечный (3%) |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.210.978 |
| Химические и физические данные | |
| Формула | C22ЧАС21Cl3N4О |
| Молярная масса | 463.79 г · моль−1 |
| 3D модель (JSmol ) | |
| |
| |
| (проверять) | |
Римонабант (также известен как SR141716; торговые наименования Acomplia, Зимулти)[3] является аноректический лекарство от ожирения он был впервые одобрен в Европе в 2006 году, но был отменен во всем мире в 2008 году из-за серьезных психических побочных эффектов; он никогда не был одобрен в Соединенных Штатах.[1][2] Римонабант - это обратный агонист для каннабиноидный рецептор CB1 и был первым препаратом, одобренным в этом классе.[4][5]
История
Римонабант - селективный CB1 рецептор блокиратор и был обнаруженный и развитый к Санофи-Авентис;[6]
21 июня 2006 г. Европейская комиссия одобрила продажу римонабанта в тогдашнем 25 членах Европейского Союза в качестве лекарственного средства, отпускаемого по рецепту, для использования в сочетании с диетой и физическими упражнениями для пациентов с индекс массы тела (ИМТ) более 30 кг / м2, или пациенты с ИМТ более 27 кг / м2 со связанными факторами риска, такими как тип 2 сахарный диабет или же дислипидемия.[7] Он был первым в своем классе, получившим одобрение в любой точке мира.[5]
Римонабант был отправлен в Управление по контролю за продуктами и лекарствами (FDA) для утверждения в США в 2005 г .; В 2007 году Консультативный комитет FDA по эндокринным и метаболическим препаратам (EMDAC) пришел к выводу, что Санофи-Авентис не смог продемонстрировать безопасность римонабанта, и проголосовал против рекомендации препарата против ожирения для утверждения.[8] а через две недели компания отозвала заявку.[9]
Препарат был одобрен в Бразилии в апреле 2007 года.[2]
В октябре 2008 г. Европейское агентство по лекарствам рекомендовал отменить Acomplia после Комитет по лекарственным средствам для человека (CHMP) определила, что риски Acomplia перевесили его преимущества из-за риска серьезных психических проблем, включая самоубийство.[10] В ноябре 2008 года консультативный комитет в Бразилии также рекомендовал приостановку, и в том же месяце Санофи-Авентис приостановила продажу препарата по всему миру.[2] Одобрение EMA было отозвано в январе 2009 года.[11][12] В 2009 году Индия запретила производство и продажу препарата.[13]
Побочные эффекты
Данные клинических испытаний, представленные регулирующим органам, показали, что римонабант вызывает депрессивные расстройства или изменения настроения у 10% пациентов и суицидальные мысли примерно у 1%, а в Европе он противопоказан людям с любым психическим расстройством, включая депрессивных или суицидальных людей. .[7]
Кроме того, очень частыми побочными эффектами были тошнота и инфекции верхних дыхательных путей (встречающиеся у более чем 10% людей); общие побочные эффекты (встречающиеся у 1–10% людей) включены гастроэнтерит, беспокойство, раздражительность, бессонница и другие нарушения сна, приливы, диарея, рвота, сухость или зуд кожи, тендинит, мышечные судороги и спазмы, усталость, симптомы гриппа и повышенный риск падения.
Консультативный комитет FDA выразил обеспокоенность тем, что, основываясь на данных о животных, оказалось, что терапевтическое окно в отношении токсичности ЦНС и, в частности, судорог практически не было; терапевтическая доза и доза, вызывающая судороги у животных, оказались одинаковыми.[2][14][15]
Когда EMA рассмотрело постмаркетинговое наблюдение данных, было обнаружено, что риск психических расстройств у людей, принимающих римонабант, был удвоен.[2]
Химия
Химический синтез римонабанта описывается следующим образом:[16][неудачная проверка ]

Исследование
Наряду с клиническими исследованиями ожирения, в результате которых были получены данные, представленные в регулирующие органы,[17] римонабант также изучался в клинических испытаниях как потенциальное средство для лечения других заболеваний,[2] включая диабет, атеросклероз и отказ от курения.[18][19]
Рекомендации
- ^ а б Сэм, AH; Салем, V; Гатеи, Массачусетс (2011). «Римонабант: от РИО до запрета». Журнал ожирения. 2011: 432607. Дои:10.1155/2011/432607. ЧВК 3136184. PMID 21773005.
- ^ а б c d е ж грамм Морейра, Ф.А.; Криппа, Дж. А. (июнь 2009 г.). «Психиатрические побочные эффекты римонабанта». Revista Brasileira de Psiquiatria. 31 (2): 145–53. Дои:10.1590 / с1516-44462009000200012. PMID 19578688.
- ^ «Римонабант». AdisInsight. Получено 21 февраля 2017.
- ^ Фонг TM, Хеймсфилд С.Б. (сентябрь 2009 г.). «Обратные агонисты рецептора каннабиноида-1: современное понимание механизма действия и оставшиеся без ответа вопросы». Международный журнал ожирения. 33 (9): 947–55. Дои:10.1038 / ijo.2009.132. PMID 19597516.
- ^ а б «Европейское одобрение для компании Sanofi-Aventis 'Acomplia придет рано». IHS. 23 июня 2006 г.
- ^ Barth, F .; Ринальди-Кармона, М. (1999), «Развитие антагонистов каннабиноидов», Современная лекарственная химия, 6 (8): 745–755, PMID 10469889
- ^ а б "Acomplia EPAR" (PDF). EMA. 30 января 2009 г. Из Индексная страница EMA
- ^ Сол, Стефани (14 июня 2007 г.). «Группа F.D.A. отвергает лекарство от ожирения». Нью-Йорк Таймс.
- ^ «Капли Санофи-Авентис для приема лекарств». Нью-Йорк Таймс. 30 июня 2007 г.
- ^ «Европейское агентство по лекарственным средствам рекомендует приостановить действие регистрационного удостоверения Acomplia». Европейское агентство по лекарственным средствам. 23 октября 2008 г.. Получено 18 января 2016.
- ^ «Приостановлено употребление лекарств от ожирения». Новости BBC. 23 октября 2008 г.. Получено 4 марта 2010.
- ^ «Публичное заявление об отзыве разрешения на продажу препарата Acomplia (римонабант) в Европейском Союзе» (PDF). Европейское агентство по лекарственным средствам. 30 января 2009 г.. Получено 18 января 2016.
- ^ «Наркотики запрещены в Индии». Центральная организация по контролю за стандартами лекарственных средств, Dte.GHS, Министерство здравоохранения и благополучия семьи, Правительство Индии. Получено 2013-09-17.
- ^ «Информационный документ FDA NDA 21-888 Zimulti (римонабант), таблетки, 20» (PDF). FDA. 13 июня 2007 г.
- ^ Дэвис-Бруно, Карен (13 июня 2007 г.). «Доклинический обзор: токсичность для ЦНС римонабантом». FDA, подразделение продуктов метаболизма и эндокринологии.
- ^ Йошиока, Т .; и другие. (1989). «Исследования затрудненных фенолов и аналогов. 1. Гиполипидемические и гипогликемические средства со способностью ингибировать перекисное окисление липидов». Журнал медицинской химии. 32 (2): 421–8. Дои:10.1021 / jm00122a022. PMID 2913302.
- ^ Пи-Суньер FX, Аронн Л.Дж., Хешмати Х.М., Девин Дж., Розенсток Дж. (Февраль 2006 г.). «Влияние римонабанта, блокатора рецепторов каннабиноида-1, на вес и кардиометаболические факторы риска у пациентов с избыточным весом или ожирением: РИО-Северная Америка: рандомизированное контролируемое исследование». JAMA. 295 (7): 761–75. Дои:10.1001 / jama.295.7.761. PMID 16478899.
- ^ Кэхилл, К; Ашер, MH (16 марта 2011 г.). «Антагонисты рецепторов каннабиноидов 1 типа для прекращения курения». Кокрановская база данных систематических обзоров (3): CD005353. Дои:10.1002 / 14651858.CD005353.pub4. ЧВК 6486173. PMID 21412887.
- ^ Мальдонадо Р., Вальверде О., Беррендеро Ф. (2006). «Вовлечение эндоканнабиноидной системы в наркозависимость». Тенденции в неврологии. 29 (4): 225–32. Дои:10.1016 / j.tins.2006.01.008. PMID 16483675. S2CID 16125335.
