Эйкозаноид - Eicosanoid
Эйкозаноиды находятся сигнальные молекулы сделано ферментативный или неферментативный окисление из арахидоновая кислота или другой полиненасыщенные жирные кислоты (ПНЖК), которые, как и арахидоновая кислота, имеют длину 20 углеродных единиц. Эйкозаноиды - это подкатегория оксилипины, т.е. окисленные жирные кислоты с различной длиной углеродных единиц, и отличаются от других оксилипинов своей огромной важностью как клеточная сигнализация молекулы. Эйкозаноиды действуют в различных физиологических системах и патологических процессах, таких как: нарастание или подавление воспаление, аллергия, высокая температура и другие иммунные ответы; регулирование аборт беременности и нормальных роды; способствуя восприятию боль; регулирующий рост клеток; контролирующий артериальное давление; и модулирование регионального кровотока к тканям. Выполняя эти роли, эйкозаноиды чаще всего действуют как аутокринная сигнализация агентов для воздействия на их исходные клетки или в качестве паракринная передача сигналов агенты для воздействия на клетки в непосредственной близости от их исходных клеток. Эйкозаноиды также могут действовать как эндокринный агенты для контроля функции отдаленных клеток.
Существует несколько подсемейств эйкозаноидов, в том числе наиболее заметно простагландины, тромбоксаны, лейкотриены, липоксины, резолвины, и эоксины. Для каждого подсемейства существует возможность иметь по крайней мере 4 отдельных ряда метаболитов, два ряда производных от ω-6 ПНЖК (арахидоновая и дигомо-гамма-линоленовая кислоты), один ряд производных от ω-3 ПНЖК (эйкозапентаеновая кислота) и одна серия, полученная из ω-9 ПНЖК (медовая кислота). Это подсемейное различие важно. Млекопитающие, включая человека, неспособны преобразовывать ω-6 в ω-3 ПНЖК. Как следствие, тканевые уровни ω-6 и ω-3 ПНЖК и их соответствующих эйкозаноидных метаболитов напрямую связаны с количеством потребляемых с пищей ω-6 и ω-3 ПНЖК.[1] Поскольку некоторые метаболиты из ряда ω-6 и ω-3 ПНЖК обладают почти диаметрально противоположной физиологической и патологической активностью, часто высказывалось предположение, что пагубные последствия, связанные с потреблением рациона, богатого ω-6 ПНЖК, отражают чрезмерное производство и активность. эйкозаноидов, производных ω-6 ПНЖК, в то время как положительные эффекты, связанные с потреблением рациона, богатого ω-3 ПНЖК, отражают чрезмерное производство и активность эйкозаноидов, производных ω-3 ПНЖК.[2][3][4][5] С этой точки зрения, противоположные эффекты эйкозаноидов, производных ω-6 и ω-3 PUFA, на ключевые клетки-мишени лежат в основе пагубного и положительного воздействия диет, богатых ω-6 и ω-3 PUFA на воспаление и аллергия реакции, атеросклероз, гипертония, рост рака и множество других процессов.
Номенклатура
Источники жирных кислот
«Эйкозаноид» (eicosa-, Греческий на «двадцать»; увидеть икосаэдр ) - собирательный термин[6] для прямая цепь полиненасыщенные жирные кислоты (ПНЖК) длиной 20 углеродных единиц, которые метаболизируются или иным образом превращаются в кислородсодержащие продукты. К предшественникам ПНЖК эйкозаноидов относятся:
- Арахидоновая кислота (AA), т.е. 5Z, 8Z,11Z,14Z-эйкозатетраеновая кислота - это ω-6 жирная кислота, с четырьмя двойные связи в конфигурации cis (см. Цис-транс-изомерия ), каждый из которых расположен между 5-6, 8-9, 11-12 и 14-15 атомами углерода.
- Адреновая кислота (AdA), 7,10,13,16-докозатетраеновая кислота, представляет собой ω-6 жирную кислоту с четырьмя двойными цис-связями, каждая из которых расположена между атомами углерода 7-8, 10-11, 13-14 и 17-18.
- Эйкозапентаеновая кислота (EPA), т.е. 5Z, 8Z,11Z,14Z,17Z-эйкозапентаеновая кислота представляет собой ω-3 жирную кислоту с пятью цис-двойными связями, каждая из которых расположена между атомами углерода 5-6, 8-9, 11-12, 14-15 и 17-18.
- Дигомо-гамма-линоленовая кислота (DGLA), 8Z, 11Z,14Z-эйкозатриеновая кислота представляет собой ω-6 жирную кислоту с тремя двойными цис-связями, каждая из которых расположена между атомами углерода 8-9, 11-12 и 14-15.
- Медовая кислота, т.е. 5Z,8Z,11Z-эйкозатриеновая кислота представляет собой ω-9 жирную кислоту, содержащую три двойные цис-связи, каждая из которых расположена между атомами углерода 5-6, 8-9 и 11-12.
Сокращение
Конкретный эйкозаноид обозначается четырехзначной аббревиатурой, состоящей из:
- его двухбуквенное сокращение (LT, EX или PG, как описано выше),[7]
- одна буква последовательности A-B-C,[8]
- Подстрочный индекс или номер простого шрифта, следующий за тривиальным именем обозначенного эйкозаноида, указывает номер его двойные связи. Примеры:
- Простаноиды, полученные из EPA, имеют три двойные связи (например, PGG3 или PGG3), тогда как лейкотриены, полученные из EPA, имеют пять двойных связей (например, LTB5 или LTB5).
- Простаноиды, производные от АК, имеют две двойные связи (например, PGG2 или PGG2), в то время как их лейкотриены, производные от АК, имеют четыре двойные связи (например, LTB4 или LTB4).
- Гидроперокси-, гидроксил- и оксо-эйкозаноиды содержат заместители гидроперокси (-OOH), гидрокси (-OH) или атома кислорода (= O), связанные с углеродом PUFA одинарной (-) или двойной (=) связью. Их тривиальные названия обозначают заместитель как: Hp или HP для гидропероксильного остатка (например, 5-гидропероокси-эйкозатраеновая кислота или 5-Л.с.ETE или 5-HPETE); H для гидроксильного остатка (например, 5-гидрокси-эйкозатетраеновая кислота или 5-ЧАСETE); и оксо- для оксо-остатка (например, 5-оксо-эйкозатетраенионовая кислота или 5-оксо-ETE или 5-оксоETE). Количество их двойных связей обозначено их полными и тривиальными названиями: гидроксиметаболиты, производные от АА, имеют четыре (т. Е. Тетра или Т) двойные связи (например, 5-гидрокси-эйкозатетраеновая кислота или 5-ОНТE; Гидроксиметаболиты, производные от EPA, имеют пять («пента» или «P») двойных связей (например, 5-гидрокси-эйкозапентаеновая кислота или 5-ОНпE); и гидрокси-метаболиты, производные DGLA, имеют три ('три' или 'Tr') двойные связи (например, 5-гидрокси-эйкозатриеновая кислота или 5-ОНТрE).
В стереохимия образующихся эйкозаноидных продуктов может отличаться в зависимости от пути. Для простагландинов это часто обозначается греческими буквами (например, PGF2α по сравнению с PGF2β). Для гидроперокси и гидроксиэйкозаноидов S или р обозначает хиральность их заместителей (например, 5S-гидрокси-эйкозатетераеновая кислота [также обозначаемая как 5 (S) -, 5S-гидрокси- и 5 (S) -гидрокси-эйкозатетраеновая кислота] даны тривиальные названия 5S-HETE, 5 (S) -HETE, 5S-HETE или 5 (S) -HETE). Поскольку ферменты, образующие эйкозаноиды, обычно вызывают S изомер продукты либо с явным предпочтением, либо исключительно, использование S/р обозначения часто опускались (например, 5S-HETE это 5-HETE). Тем не менее, некоторые пути образования эйкозаноидов действительно образуют R-изомеры и их S против р изомерные продукты могут проявлять совершенно разную биологическую активность.[9] Отсутствие указания S/р изомеры могут вводить в заблуждение. Здесь все гидроперокси и гидроксизаместители имеют S конфигурации, если не указано иное.
Классические эйкозаноиды
Текущее использование ограничивает термин эйкозаноид:
- Эйкозаноиды серии ω-6, полученные из арахидоновой кислоты:
- Гидроксиэйкозатетраеновые кислоты (HETE) включают следующие метаболиты арахидоновой кислоты:
- 5-HETE, 12-НЕТЕ, 15-гидроксиэйкозатетраеновая кислота (т.е. 15-HETE), 20-гидроксиэйкозатетраеновая кислота (т.е. 20-HETE) и 19-HETE (см. 20-гидроксиэйкозатетраеновая кислота ).
- Лейкотриены (LT) включают следующие метаболиты арахидоновой кислоты:
- Эоксины (EX) включают следующие метаболиты арахидноевой кислоты:
- Простаноиды состоящий из нескольких разных типов:
- Простагландины (PG) включают следующие метаболиты арахидоновой кислоты:
- PGG2, PGH2, PGE2, PGD2, PGF2alpha, PGA2, PGB2, (см. Простаноид и Специализированные медиаторы, способствующие рассасыванию # простагландины и изопростаны ).
- Простациклины включают:
- PGI2 (увидеть простациклин ).
- Тромбоксаны (TX) включают следующие метаболиты ацидоновой кислоты:
- Циклопентеноновые простагландины включают следующие метаболиты арахидоновой кислоты:
- PGA1, PGA2 (см.простаноид, PGJ2, Δ12-PGJ2 и 15-дезокси-Δ12,14-PGJ2.[10]
- Простагландины (PG) включают следующие метаболиты арахидоновой кислоты:
- Гидроксиэйкозатетраеновые кислоты (HETE) включают следующие метаболиты арахидоновой кислоты:
- Эйкозаноиды серии ω-6, полученные из дигомо-гамма-линоленовой кислоты. Эти метаболиты являются аналогами эйкозаноидов, производных арахидоновой кислоты, но лишены двойной связи между атомами углерода 5 и 6 и, следовательно, имеют на 1 двойную связь меньше, чем их аналоги, производные арахидоновой кислоты. Они следующие:
- Эйкозаноиды серии ω-3:
- Resolvins серии E (RvE) (Резольвины серии D (RvD являются метаболитами 22-углеродной ω-3 жирной кислоты докозагексаеновая кислота; увидеть Специализированные про-рассасывающиеся медиаторы # Резолвины на основе ДГК ). RvE включают следующие метаболиты эйкозапентаеновой кислоты:
- RvE1, 18S-RvE1, RvE2 и RvE3.
- Другие эйкозаноиды, производные эйкозапентаеновой кислоты серии ω-3, являются аналогами метаболитов, производных ω-6 жирных кислот, но содержат двойную связь между углеродом 17 и 18 и, следовательно, имеют на одну двойную связь больше, чем их аналоги, производные арахидоновой кислоты. К ним относятся (HEPE - гидрокси-эйксапентаеновая кислота):
- 5-HEPE (см. Арахидонат-5-липоксигеназа # эйкозапентаеновая кислота ), 12-HEPE,[13] 15-HEPE,[14] и 20-HETE;[15] LTA5, LTB5 (см. Взаимодействие с незаменимыми жирными кислотами # противодействие ), LTC5, LTD5 и LTE5 (см. Арахидонат 5-липоксигеназа # эйкозапентаеновая кислота );[16] PGE3, PGD3, PGF3α и Δ (17) -6-кето PGF1α;[16][17] PGI3 (см. Взаимодействие с незаменимыми жирными кислотами # противодействие );[16] и TXA3 и TXB3 (см. Взаимодействия незаменимых жирных кислот # номенклатура ).[16]
- Resolvins серии E (RvE) (Резольвины серии D (RvD являются метаболитами 22-углеродной ω-3 жирной кислоты докозагексаеновая кислота; увидеть Специализированные про-рассасывающиеся медиаторы # Резолвины на основе ДГК ). RvE включают следующие метаболиты эйкозапентаеновой кислоты:
- Эйкозаноиды серии ω-9
- Гидрокси являются производными от медовой кислоты, метаболизируются до содержащего 3 двойные связи аналога 5-HETE, а именно 5-HETrE (см. арахидонат-5-липоксигеназа # медовая кислота ).
Гидроксиэйкозатетраеновые кислоты, лейкотриены, эоксины и простаноиды иногда называют «классическими эйкозаноидами».[18][19][20]
Неклассические эйкозаноиды
В отличие от классических эйкозаноидов, несколько других классов метаболитов ПНЖК были названы «новыми», «эйкозаноидоподобными» илинеклассические эйкозаноиды '.[21][22][23][24] К ним относятся следующие классы:
- Оксоэйкозаноиды (оксо-ETE) включают следующие метаболиты:
- 5-оксо-эйкозатетраеновая кислота (5-оксо-ETE), 12-оксо-ETE (см. 12-HETE # Дальнейший метаболизм ) и 15-оксо-ЭТЕ, которые являются метаболитами арахидоновой кислоты (см. 15-гидроксиэйкозатетраеновая кислота ) и 5-оксо-ETrE, который является метаболитом медовой кислоты (см. арахидонат-5-липоксигеназа # медовая кислота ).
- Гепоксилины (Hx) включают следующие метаболиты арахидоновой кислоты:
- HxA3 и HxB3 (см. Гепоксилины ).
- Липоксины (Lx) включают следующие метаболиты арахидоновой кислоты:
- LxA4 и LxB4 (см. Специализированные посредники по разрешению споров ).
- Эпи-липоксины (эпи-Lx) включают следующие метаболиты арахидоновой кислоты:
- 15-epi-LxA4 (также называемый AT-LxA4) и 15-epi-LxB4 (также обозначаемый как AT-LxB4) (см. Специализированные посредники по разрешению споров ).
- Эпоксиэйкозатриеновые кислоты (восточноевропейское время) включают следующие метаболиты арахидоновой кислоты:
- 5,6-EET, 8,9-EET, 11,12-EET и 14,15-EET (см. эпоксиэйкозатриеновая кислота ).
- Эпоксиэйкозатетраеновая кислота (EEQ) включают следующие метаболиты эйкозапентаеновой кислоты:
- 5,6-EEQ, 8,9-EEQ, 11,12-EEQ, 14,15-EEQ и 15,16-EEQ (см. эпоксиэйкозатетраеновая кислота ).
- Изопростаны (isoP) являются неферментативно образованными производными полиненасыщенные жирные кислоты изучены как маркеры окислительный стресс; они включают следующие изоР, производные арахидоновой кислоты, которые названы на основе их структурного сходства с PG:[25][26]
- D2-isoP, E2-isoP, A2-isoPs и J2-isoPs; и два эпоксидсодержащих isoP, 5,6-эпоксиизопростан E2 и 5,6-эпоксиизопростан A2. Было показано, что некоторые из этих isoP обладают противовоспалительной активностью (см. Специализированные медиаторы, способствующие разрешению проблемы # Простагландины и изопростаны ).
- Изофураны представляют собой неферментативные производные полиненасыщенных жирных кислот, которые обладают Фуран кольцевая структура; они изучаются как маркеры окислительного стресса. Существует 256 потенциально различных изомеров, содержащих фурановое кольцо, которые могут быть производными арахидоновой кислоты.[27]
- Эндоканнабиноиды уверены глицеролипиды или дофамин, этерифицированные до полиненасыщенных жирных кислот, которые активируют каннабиноидные рецепторы. Они включают следующие агенты, этерифицированные арахидоновой кислотой:
Метаболизм эйкозапентаеновой кислоты до HEPE, лейкотриенов, простаноидов и эпоксиэйкозатетраеновых кислот, а также метаболизм дигомо-гамма-линоленовой кислоты до простаноидов и медовой кислоты до 5 (S) -гидрокси-6E, 8Z, 11-Z-эйкозовой кислоты HETrE), 5-оксо-6,8,11-эйкозатриеновая кислота (5-оксо-ETrE), LTA3 и LTC3 задействуют те же ферментативные пути, что и их аналоги на основе арахидоновой кислоты.
Биосинтез
Эйкозаноиды обычно не хранятся в клетках, а скорее синтезированный как требуется. Они происходят из жирные кислоты которые составляют клеточная мембрана и ядерная мембрана. Эти жирные кислоты должны высвобождаться из своих мембран, а затем сначала метаболизироваться до продуктов, которые чаще всего далее метаболизируются различными путями с образованием большого количества продуктов, которые мы признаем биоактивными эйкозаноидами.
Мобилизация жирных кислот
Биосинтез эйкозаноидов начинается, когда клетка активируется механической травмой, ишемия, другие физические возмущения, атака патогены, или стимулы, создаваемые соседними клетками, тканями или патогенами, такими как хемотаксические факторы, цитокины, факторы роста и даже некоторые эйкозаноиды. Затем активированные клетки мобилизуют ферменты, называемые фосфолипаза А2 (PLA2s), способный высвобождать ω-6 и ω-3 жирные кислоты из мембранного накопителя. Эти жирные кислоты связаны в сложный эфир связь с SN2 положение мембраны фосфолипиды; PLA2действуют как эстеразы высвободить жирную кислоту. Есть несколько классов PLA2с цитозольной PLA IV типа2s (cPLA2s) кажется ответственным за высвобождение жирных кислот при многих условиях активации клеток. CPLA2действуют специфически на фосфолипиды, которые содержат AA, EPA или GPLA в их положении SN2. cPLA2 может также высвобождать лизофосфолипид, который становится фактор активации тромбоцитов.[28]
Перекисное окисление и активные формы кислорода
Затем свободная жирная кислота насыщается кислородом по любому из нескольких путей; увидеть Пути Таблица. Пути эйкозаноидов (через липоксигеназа или СОХ ) Добавить молекулярный кислород (O2). Хотя жирная кислота симметричный, образующиеся эйкозаноиды хиральный; окисление протекает с высокой стереоселективность (ферментативные окисления считаются практически стереоспецифический ).
Четыре семьи ферменты инициируют или способствуют инициированию катализа жирных кислот до эйкозаноидов:
- Циклооксигеназы (СОХ): СОХ-1 и СОХ-2 инициировать метаболизм арахидоновая кислота к простаноиды которые содержат две двойные связи, т.е. простагландины (например, PGE2), простациклин (т.е. PGI2), и тромбоксаны (например, TXA2). Два фермента ЦОГ также инициируют метаболизм: а) эйкозапентаеновая кислота, который имеет 5 двойных связей по сравнению с 4 двойными связями арахидоновой кислоты, с простаноидами, простациклином и продуктами тромбоксана, которые имеют три двойные связи, например PGE3, PGI3 и TXA3 и б) Дигомо-γ-линоленовая кислота, который имеет три двойные связи, с продуктами простаноида, простациклина и тромбоксана, которые имеют только одну двойную связь, например PGE1, PGI1 и TXA1.[29]
- Липоксигеназы (LOX): 5-липоксигеназа (5-LOX или ALOX5) инициирует метаболизм арахидоновой кислоты до 5-гидропероксиэйкозатетраеновой кислоты (5-HpETE), которая затем может быстро восстановиться до 5-гидроксиэйкозатетраеновая кислота (5-HETE) или далее метаболизируется до лейкотриены (например, LTB4 и LTC4 ); 5-HETE может быть окислен до 5-оксо-эйкозатетраеновая кислота (5-оксо-ETE). Подобным образом 15-липоксигеназа (15-липоксигеназа 1, 15-LOX, 15-LOX1 или ALOX15) инициирует метаболизм арахидоновой кислоты до 15-HpETE, 15-HETE, эоксины, 8,15-дигидроксиэйкозатетраеновая кислота (т.е. 8,15-DiHETE) и 15-оксо-ETE и 12-липоксигеназа (12-LOX или ALOX12) инициирует метаболизм арахидоновой кислоты до 12-HpETE, 12-HETE, гепоксилины и 12-оксо-ETE. Эти ферменты также инициируют метаболизм; а) эйкозапентаеновая кислота с аналогами метаболитов арахидоновой кислоты, которые содержат 5, а не четыре двойные связи, например 5-гидрокси-эйкозапентаеновая кислота (5-HEPE), LTB5, LTC5, 5-оксо-EPE, 15-HEPE и 12-HEPE; б) дигомо-γ-линоленовой кислоты, содержащей три двойные связи, с продуктами, содержащими 3 двойные связи, например 8-гидрокси-эйкозатриеновая кислота (8-HETrE), 12-HETrE и 15-HETrE (эта жирная кислота не может быть преобразована в лейкотриены); и медовая кислота, содержащая три двойные связи (посредством ALOX5), с 5-гидроперокси-эйкозатриеновой кислотой (5-HpETrE), 5-HETrE и 5-оксо-HETrE. В наиболее изученных из этих путей ALOX5 метаболизирует эйкозапентаеновую кислоту до 5-гидропероксиэйкозапентаеновой кислоты (5-HpEPE), 5-HEPE, LTB5 и 5-оксо-EPE, которые все менее активны, чем аналоги арахидоновой кислоты. Поскольку эйкозапентаеновая кислота конкурирует с арахидоновой кислотой за ALOX5, продукция метаболитов эйкозапентаеновой кислоты приводит к снижению метаболитов эйкозатетраеноата и, следовательно, снижению передачи сигналов последних метаболитов.[29][30] Исходные моногидроперокси и моногидроксипродукты, полученные с помощью вышеупомянутых липоксигеназ, имеют гидроперозию и гидроксильные остатки, расположенные в S хиральный конфигурации и более правильное название 5S-HpETE, 5S-HETE, 12S-HpETE, 12S-HETE, 15S-HpETE и, 15S-HETE. ALOX12B (т.е. арахидонат-12-липоксигеназа, тип 12R) образует р продукты хиральности, т.е. 12р-HpETE и 12р-HETE. Так же, ALOXE3 (т.е. липоксигеназа 3 эпидермисного типа или eLOX3) метаболизирует арахидоновую кислоту до 12р-HpETE и 12р-HETE; однако это второстепенные продукты, которые этот фермент образует только при ограниченном наборе условий. ALOXE3 предпочтительно метаболизирует арахидоновую кислоту до гепоксилинов.
- Эпоксигеназы: Эти цитохром P450 ферменты, которые производят неклассический эйкозаноид эпоксиды полученный из: а) арахидоновая кислота, а именно 5,6-эпокси-эйкозатриеновая кислота (5,6-EET), 8,9-EET, 11,12-EET и 14,15-EET (см. Эпоксиэйкозатриеновая кислота ); б) эйкозапентаеновая кислота, а именно 5,6, -эпокси-эйкозатетраеновая кислота (5,6-EEQ), 8,9-EEQ, 11,12-EEQ, 14,15-EEQ и 17,18-EEQ (см. Эпоксиэйкозатетраеновая кислота ); в) дигомо-γ-линоленовая кислота, а именно 8,9-эпокси-эйкозадиеновая кислота (8,9-EpEDE), 11,12-EpEDE и 14,15-EpEDE; и г) адреновая кислота, а именно 7,8-эпокс-эйкозатриеновая кислота (7,8-EpETrR), 10,11-EpTrE, 13,14-EpTrE и 16,17-EpETrE. Все эти эпоксиды иногда быстро превращаются в свои дигидроксиметаболиты различными клетками и тканями. Например, 5,6-EET превращается в 5,6-дигидроксиэйкозатриеновую кислоту (5,6-DiHETrE), 8,9-EEQ в 8,9-дигидроксиэйкозатетраеновую кислоту (8,9-DiHETE, 11, 12-EpEDE к 11,12-дигидрокси-эйкозадиеновой кислоте (11,12DiHEDE) и 16,17-EpETrE к 16,17-дигидрокси-эйкозатриеновой кислоте (16,17-DiETrE[29]
- Цитохром P450 микросома ω-гидроксилазы: CYP4A11, CYP4A22, CYP4F2, и CYP4F3 метаболизировать арахидоновую кислоту в первую очередь до 20-гидроксиэйкозатетраеновая кислота (20-HETE), но также и для 16-HETE, 17-HETE, 18-HETE и 19-HETE; они также метаболизируют эйкозапентаеновую кислоту, прежде всего, до 20-гидрокси-эйкозапентаеновой кислоты (20-HEPE), но также и до 19-HEPE.[29]
Два разных фермента могут последовательно воздействовать на ПНЖК с образованием более сложных метаболитов. Например, ALOX5 действует с ALOX12 или COX-2, обработанным аспирином, для метаболизма арахидоновой кислоты до липоксины и с монооксигеназа цитохрома P450 (s), бактериальный цитохром P450 (в инфицированных тканях) или COX2, обработанный аспирином, для метаболизма эйкозапентаеновой кислоты до E серии резолвины (RvEs) (см. Специализированные посредники по разрешению споров ). Когда это происходит с ферментами, расположенными в разных типах клеток, и включает перенос продукта одного фермента в клетку, которая использует второй фермент для производства конечного продукта, это называется трансцеллюлярным метаболизмом или трансцеллюлярным биосинтезом.[31]
Окисление липидов опасно для клеток, особенно в непосредственной близости от ядра. Существуют тщательно продуманные механизмы для предотвращения нежелательного окисления. ЦОГ, липоксигеназы и фосфолипазы строго контролируются - по крайней мере восемь белков активированы для координации генерации лейкотриенов. Некоторые из них существуют в нескольких изоформы.[5]
Окисление за счет выброса ЦОГ или липоксигеназы активные формы кислорода (ROS) и исходные продукты образования эйкозаноидов сами по себе обладают высокой реакционной способностью. перекиси. LTA4 может сформировать аддукты с тканью ДНК. Другие реакции липоксигеназ вызывают повреждение клеток; мышиный модели вовлекают 15-липоксигеназу в патогенез из атеросклероз.[32][33]Окисление при образовании эйкозаноидов разделено на части; это ограничивает повреждение пероксидов. ферменты, которые биосинтезируют эйкозаноиды (например, глутатион-S-трансферазы, эпоксид гидролазы, и белки-носители ) принадлежат к семействам, функции которых в основном связаны с клеточной детоксикацией. Это предполагает, что передача сигналов эйкозаноидов могла развиться в результате детоксикации ROS.
Клетка должна осознавать некоторую выгоду от генерации гидропероксидов липидов рядом с ее ядром. PG и LT могут сигнализировать или регулировать ДНК-транскрипция там; LTB4 лиганд для PPARα.[3](См. Диаграмму на PPAR ).
 |  |  | |
| Простагландин E1. Пятичленное кольцо характерно для этого класса. | Тромбоксан А2. Кислородные вышли на ринг. | Лейкотриен B4. Обратите внимание на 3 сопряженные двойные связи. | |
 |  | ||
| Простациклин I2. Второе кольцо отличает его от простагландинов. | Лейкотриен E4, пример цистеиниллейкотриена. | ||
Простаноидные пути
И СОХ1, и СОХ2 (также называемые простагландин-эндопероксидсинтазой-1 (PTGS1 ) и PTGS2 соответственно) метаболизируют арахидоновую кислоту, добавляя молекулярный O2 между атомами углерода 9 и 11, чтобы сформировать эндопероксид мост между этими двумя атомами углерода, добавляя молекулярный O2 с углеродом 15 с образованием 15-гидроперокси-продукта, создавая углерод-углеродную связь между атомами углерода 8 и 12, чтобы создать циклопентан кольцо в середине жирной кислоты, и в процессе получения PGG2, продукта, который имеет на две двойные связи меньше, чем арахидоновая кислота. 15-гидроперокси-остаток PGG2 затем восстанавливается до 15-гогидроксил остаток, тем самым образуя PGH2. PGH2 является родительским простаноидом для всех других простаноидов. Метаболизируется (см. Диаграмму в Простаноиды: а) то Синтаза простагландина Е путь, в котором любой из трех изоферменты, ПТГЭС, ПТГЭС2, или ПТГЭС3, конвертировать PGH2 в PGE2 (последующие продукты этого пути включают PGA2 и PGB2 (см. Простаноид # Биосинтез ); б) PGF-синтаза, которая превращает PGH2 в PGF2α; в) Синтаза простагландина D2 который превращает PGH2 в PGD2 (последующие продукты в этом пути включают 15-dPGJ2 (см. Циклопентенон простагландин ); г) тромбоксансинтаза который превращает PGH2 в TXA2 (последующие продукты на этом пути включают TXB2); и д) Простациклинсинтаза который превращает PGH2 в PGI2 (последующие продукты в этом пути включают 6-кето-PGFα.[34][35] Было показано, или в некоторых случаях предполагается, что эти пути метаболизируют эйкозапентаеновую кислоту до эйкозаноидных аналогов указанных продуктов, которые имеют три, а не две двойные связи и, следовательно, содержат число 3 вместо 2, прикрепленное к их названиям (например, PGE3 вместо PGE2) .[36]
Продукты PGE2, PGE1 и PGD2, образующиеся в только что упомянутых путях, могут подвергаться спонтанной реакция дегидратации для формирования PGA2, PGA1 и PGJ2 соответственно; PGJ2 может затем подвергаться спонтанной изомеризации с последующей реакцией дегидратации с образованием последовательно Δ12-PGJ2 и 15-дезокси-Δ12,14-PGJ2.[37]
PGH2 имеет 5-углеродное кольцо, соединенное мостиком молекулярного кислорода. Его производные PGS утратили этот кислородный мостик и содержат одно ненасыщенное 5-углеродное кольцо, за исключением тромбоксана А2, который имеет 6-членное кольцо, состоящее из одного кислорода и 5 атомов углерода. 5-углеродное кольцо простациклина соединено со вторым кольцом, состоящим из 4 атомов углерода и одного атома кислорода. И 5-членное кольцо простагландинов циклопентенона обладает ненасыщенной связью в сопряженная система с карбонил группа, которая заставляет эти PGs образовывать связи с разнообразным набором биоактивных белков (подробнее см. диаграммы на Простаноид ).
Гидроксиэйкозатетраеноатный (HETE) и лейкотриеновый (LT) пути
Увидеть Лейкотриен # Биосинтез, Гидроксиэйкозатетраеновая кислота, и Эоксин # Биосинтез человека.
Фермент 5-липоксигеназа (5-LO или ALOX5) преобразует арахидоновая кислота в 5-гидропероксиэйкозатетраеновая кислота (5-HPETE), который может быть выпущен и быстро уменьшенный к 5-гидроксиэйкозатетраеновая кислота (5-HETE) повсеместно глутатион -зависимый пероксидазы.[38] Альтернативно, ALOX5 использует свою активность LTA-синтазы для преобразования 5-HPETE в лейкотриен А4 (LTA4). LTA4 затем метаболизируется либо до LTB.4 от Лейкотриен А4 гидролаза или Лейкотриен C4 (LTC4) либо LTC4-синтаза или микросомальный глутатион S-трансфераза 2 (MGST2 ). Любой из двух последних ферментов присоединяет серу цистеина. тио- (т.е. SH) группа в трипептиде глутамат -цистеин -глицин с углеродом 6 LTA4, тем самым образуя LTC4. После высвобождения из его родительской клетки остатки глутамата и глицина LTC4 удаляются поэтапно путем гамма-глутамилтрансфераза и дипептидаза с образованием последовательно LTD4 и LTE4.[39][40] Решение сформировать LTB4 по сравнению с LTC4 зависит от относительного содержания гидролазы LTA4 по сравнению с LTC4-синтазой (или глутатион-S-трансферазой в клетках; Эозинофилы, тучные клетки, и альвеолярный макрофаги обладают относительно высокими уровнями LTC4-синтазы и, соответственно, образуют LTC4, а не LTB4 или в гораздо большей степени. 5-LOX может также работать последовательно с оксигеназами цитохрома P450 или COX2, обработанным аспирином, с образованием Resolvins RvE1, RvE2 и 18S-RvE1 (см. Специализированные про-разрешающие медиаторы # Резолвины, производные от EPA ).
Фермент арахидонат-12-липоксигеназа (12-LO или ALOX12) метаболизирует арахидоновую кислоту до S стереоизомер 12-гидропероксиэйкозатетраеновой кислоты (12-HPETE), который быстро восстанавливается клеточными пероксидазами до S стереоизомер 12-гидроксиэйкозатетраеновая кислота (12-HETE) или далее метаболизируется до гепоксилины (Hx), например HxA3 и HxB.[41][42]
Ферменты 15-липоксигеназа -1 (15-ЛО-1 или ALOX15 ) и 15-липоксигеназа-2 (15-LO-2, ALOX15B ) метаболизируют арахидоновую кислоту до S стереоизомер 15-гидропероксиэйкозатетраеновой кислоты (15 (S) -HPETE), который быстро восстанавливается клеточными пероксидазами до S стереоизомер 15-гидроксикозатетраеновая кислота (15 (S) -HETE).[43][44] 15-липоксигеназы (особенно ALOX15) могут также действовать последовательно с 5-липоксигеназой, 12-липоксигеназой или COX2, обработанным аспирином, с образованием липоксинов и эпилипоксинов, или с оксигеназами P450 или COX2, обработанными аспирином, с образованием Resolvin E3 (см. Специализированные про-разрешающие медиаторы # Резолвины, производные от EPA.
Подмножество цитохром P450 (CYP450) микросома -связанные ω-гидроксилазы (см. 20-гидроксиэйкозатетраеновая кислота ) метаболизируют арахидоновую кислоту до 20-гидроксиэйкозатетраеновая кислота (20-HETE) и 19-гидроксиэйкозатетраеновая кислота посредством омега-окисление реакция.[45]
Эпоксиэйкозаноидный путь
Эпоксигеназы цитохрома P450 (CYP) человека, CYP1A1, CYP1A2, CYP2C8, CYP2C9, CYP2C18, CYP2C19, CYP2E1, CYP2J2 и CYP2S1 метаболизируют арахидоновую кислоту до неклассической Эпоксиэйкозатриеновые кислоты (EET) путем преобразования одной из жирных кислот двойные связи к его эпоксид для формирования одного или нескольких из следующих EET, 14,15-ETE, 11,12-EET, 8,9-ETE и 4,5-ETE.[46][47] 14,15-EET и 11,12-EET являются основными EET, продуцируемыми тканями млекопитающих, включая человека.[47][48][49][50][51] Те же CYP, но также метаболизируются CYP4A1, CYP4F8 и CYP4F12 эйкозапентаеновая кислота до пяти эпоксидных эпоксиэйкозатетраеновых кислот (EEQ), а именно 17,18-EEQ, 14,15-EEQ, 11,12-EEQ. 8,9-EEQ и 5,6-EEQ (см. эпоксиэйкозатетраеновая кислота ).[52]
Функция, фармакология и клиническое значение
В следующей таблице перечислены основные эйкозаноиды, обладающие клинически значимой биологической активностью, - клеточные рецепторы (см. Рецептор клеточной поверхности ), что они стимулируют или, если отмечено, противодействуют достижению этой активности, некоторые из основных функций, которые они регулируют (либо стимулируют, либо ингибируют) в моделях людей и мышей, а также некоторые из их значимости для болезней человека.
| Эйкозаноид | Целевые рецепторы | Функции регулируются | Клиническая значимость |
|---|---|---|---|
| PGE2 | PTGER1, PTGER2, PTGER3, PTGER4 | воспаление; высокая температура; восприятие боли; аллодиния; роды | НПВП подавить его производство, чтобы уменьшить воспаление, жар и боль; используется для поощрения родов; ан Абортивное средство[35][53][54] |
| PGD2 | Рецептор простагландина DP1 1, Рецептор простагландина DP2 | аллергия реакции; аллодиния; рост волос | НПВП могут быть нацелены на подавление аллодинии и выпадение волос по мужскому типу[35][55][56][57][58] |
| TXA2 | Рецептор тромбоксана α и β | кровь тромбоцит агрегация; свертывание крови; аллергические реакции | НПВП подавляют его производство, чтобы снизить частоту возникновения удары и сердечные приступы[35][59] |
| PGI2 | Рецептор простациклина | агрегация тромбоцитов, сокращение гладких мышц сосудов | Аналоги PGI2, используемые для лечения сосудистых заболеваний, таких как легочная гипертензия, Рейно синдром и Болезнь Бюргера[60][61][62] |
| 15-д-Δ12,14-PGJ2 | PPARγ, Рецептор простагландина DP2 | подавляет воспаление и рост клеток | Подавляет различные воспалительные реакции на животных моделях; структурная модель для разработки противовоспалительных агентов[10][57][58] |
| 20-HETE | ? | вазоконстрикция, угнетает тромбоциты | инактивирующие мутации в ферменте, образующем 20-HETE, CYP2U1, связан с Наследственная спастическая параплегия[63] |
| 5-Oxo-ETE | OXER1 | хемотаксический фактор и активатор эозинофилов | исследования, необходимые для определения того, подавляет ли ингибирование его производства или действия аллергические реакции[30] |
| LTB4 | LTB4R, LTB4R2 | хемотаксический фактор и активатор лейкоцитов; воспаление | на сегодняшний день исследования не показали явных преимуществ антагонистов рецептора LTB4 при воспалительных заболеваниях человека.[64][65][66] |
| LTC4 | CYSLTR1, CYSLTR2, GPR17 | сосудистая проницаемость; сокращение гладких мышц сосудов; аллергия | антагонисты CYSLTR1, используемые при астме, а также других аллергических и аллергических реакциях[67][68] |
| LTD4 | CYSLTR1, CYSLTR2, GPR17 | сосудистая проницаемость; сокращение гладких мышц сосудов; аллергия | антагонисты CYSLTR1, используемые при астме, а также других аллергических и аллергических реакциях[64] |
| LTE4 | GPR99 | увеличивает проницаемость сосудов и дыхательных путей муцин секреция | считается, что способствует астме, а также другим аллергическим и аллергическим реакциям[69] |
| LxA4 | FPR2 | подавляет функции провоспалительных клеток | Класс специализированных про-рассасывающихся медиаторов супрессоров воспалительной реакции[70][71] |
| LxB4 | FPR2, GPR32, AHR | подавляет функции провоспалительных клеток | Класс специализированных про-рассасывающихся медиаторов супрессоров воспалительной реакции[70][71] |
| RvE1 | CMKLR1, подавляет BLT, TRPV1, TRPV3, NMDAR, TNFR | подавляет функции провоспалительных клеток | Класс специализированных про-рассасывающихся медиаторов супрессоров воспалительной реакции; также подавляет восприятие боли[72][73][74] |
| RvE2 | CMKLR1, антагонист рецепторов из BLT | подавляет функции провоспалительных клеток | Класс специализированных про-рассасывающихся медиаторов супрессоров воспалительной реакции[70][71][74][75] |
| 14,15-EET | ? | расширение сосудов, подавляет тромбоциты и провоспалительные клетки | роль (и) в заболевании человека еще не доказана[76][77] |
Простаноиды
Известно, что многие простаноиды опосредуют местные симптомы воспаление: вазоконстрикция или расширение сосудов, коагуляция, боль, и высокая температура. Ингибирование ЦОГ-1 и / или индуцибельных изоформ ЦОГ-2 является отличительной чертой НПВП (нестероидные противовоспалительные препараты), такие как аспирин. Простаноиды также активируют PPARγ члены стероидного / тиреоидного семейства рецепторы ядерных гормонов, и напрямую влияют транскрипция гена.[78]Простаноиды имеют множество других значений для клинической медицины как свидетельство их использования, использования их более стабильных фармакологических аналогов, использования их антагонистов рецепторов, как показано в следующей таблице.
| Лекарство | Тип | Состояние здоровья или использование | Лекарство | Тип | Состояние здоровья или использование | |
|---|---|---|---|---|---|---|
| Алпростадил | PGE1 | Эректильная дисфункция, поддерживая открытый артериальный проток в плод | Берапрост | PGI1 аналог | Легочная гипертензия, избегая реперфузионная травма | |
| Биматопрост | PGF2α аналог | Глаукома, глазная гипертензия | Карбопрост | PGF2α аналог | Индукция родов, абортивное средство на ранних сроках беременности | |
| Динопростон | PGE2 | индукция родов | Илопрост | Аналог PGI2 | легочная артериальная гипертензия | |
| Латанопрост | PGF2α аналог | Глаукома, глазная гипертензия | Мизопростол | Аналог PGE1 | язва желудка индукция родов, абортивное средство | |
| Травопрост | PGF2α аналог | Глаукома, глазная гипертензия | U46619 | Более долгоживущий аналог TX Более долгоживущий аналог TX | Только исследования |
Циклопентеноновые простагландины
PGA1, PGA2, PGJ2, Δ12-PGJ2 и 15-deox-Δ12,14-PGJ2 проявляют широкий спектр противовоспалительных и снимающих воспаление действий на различных животных моделях.[37] Таким образом, они функционируют аналогично Специализированные посредники по разрешению споров хотя один из механизмов их действия, формирование ковалентных связей с ключевыми сигнальными белками, отличается от механизмов действия специализированных про-разрешающих медиаторов.
HETE и оксо-ETE
Как указано на их отдельных страницах в Википедии, 5-гидроксиэйкозатетраеновая кислота (который, как и 5-оксо-эйкозатетраеновая кислота, действует через рецептор OXER1), 5-оксо-эйкозатетраеновая кислота, 12-гидроксиэйкозатетраеновая кислота, 15-гидроксиэйкозатетраеновая кислота, и 20-гидроксиэйкозатетраеновая кислота проявляют многочисленные активности в клетках животных и человека, а также в моделях животных, которые связаны, например, с воспалением, аллергическими реакциями, ростом раковых клеток, кровотоком в тканях и / или кровяным давлением. Однако их функция и актуальность для физиологии и патологии человека еще не доказаны.
Лейкотриены
Три цистеиниллейкотриена, LTC4, LTD4 и LTE4, являются мощными бронхоконстрикторами, увеличивающими проницаемость сосудов в посткапиллярной венулы, и стимуляторы слизь секреты, которые выделяются из ткани легких астматиков, подвергающихся воздействию определенных аллергенов. Они играют патофизиологическую роль в различных типах немедленная гиперчувствительность реакции.[79] Препараты, блокирующие активацию ими CYSLTR1 рецептор, а именно, монтелукаст, зафирлукаст, и пранлукаст, клинически используются в качестве поддерживающего лечения аллерген-индуцированных астма и ринит; нестероидный противовоспалительный препарат -индуцированная астма и ринит (см. Аспирин-индуцированная астма ); астма, вызванная физическими упражнениями и холодным воздухом (см. Бронхоспазм, вызванный физической нагрузкой ); и детство апноэ во сне вследствие гипертрофии аденотонзилляра (см. Приобретенная невоспалительная миопатия # Миопатия, вызванная диетой и травмой ).[80][81][82][83] В сочетании с антигистаминный препарат лекарственная терапия, они также оказываются полезными для лечения крапивница такие болезни, как крапивница.[84]
Липоксины и эпи-липоксины
LxA4, LxB4, 15-epi-LxA4 и 15-epi-LXB4, как и другие представители специализированные посредники по разрешению споров ) класс эйкозаноидов, обладают противовоспалительным и противовоспалительным действием. В рандомизированное контролируемое исследование, AT-LXA4 и сравнительно стабильный аналог LXB4, 15R / S-метил-LXB4, снижает выраженность экзема в исследовании 60 младенцев[85] и, в другом исследовании, вдыхание LXA4 снижает бронхопровокацию, инициированную LTC4, у пациентов с астмой.[86]
Эоксины
Эоксины (EXC4, EXD4, EXE5) описаны заново. Они стимулируют проницаемость сосудов в модельной системе эндотелия сосудов человека ex vivo.[87] и в небольшом исследовании с участием 32 добровольцев продукция EXC4 эозинофилами, изолированными от тяжелых астматиков и пациентов с непереносимостью аспирина, была выше, чем у здоровых добровольцев и пациентов с легкой астмой; Предполагается, что эти данные указывают на то, что эоксины обладают провоспалительным действием и, следовательно, потенциально участвуют в различных аллергических реакциях.[88] Производство эоксинов клетками Рида-Штернбурга также привело к предположению, что они участвуют в Болезнь Ходжкина.[89] Однако клиническое значение эоксинов еще не доказано.
Резолвин метаболиты эйкозапентаеновой кислоты
RvE1, 18S-RvE1, RvE2 и RvE3, как и другие представители класса эйкозаноидов (специализированных про-разрешающих медиаторов), обладают противовоспалительной и разрешающей воспаление активностью. Синтетический аналог RvE1 проходит клиническую фазу III тестирования (см. Этапы клинических исследований ) для лечения воспалений на основе синдром сухого глаза; Наряду с этим исследованием продолжаются другие клинические испытания (NCT01639846, NCT01675570, NCT00799552 и NCT02329743) с использованием аналога RvE1 для лечения различных глазных состояний.[86] RvE1 также проходит клинические исследования для лечения нейродегенеративных заболеваний и потери слуха.[90]
Другие метаболиты эйкозапентаеновой кислоты
Метаболиты эйкозапентаеновой кислоты, которые являются аналогами их простаноидов, полученных из арахидоновой кислоты, HETE и LT, включают: простаноиды 3-го ряда (например, PGE3, PGD3, PGF3α, PGI3 и TXA3), гидроксиэйкозапентаеновые кислоты (например, 5-HEPE , 12-HEPE, 15-HEPE и 20-HEPE) и LTE 5-й серии (например, LTB5, LTC5, LTD5 и LTE5). Многие из простаноидов 3-й серии, гидроксиэйкозапентаеновые кислоты и LT 5-й серии оказались более слабыми стимуляторами своих клеток-мишеней и тканей, чем их аналоги, производные арахидоновой кислоты. Им предлагается уменьшить действие их аналогов, производных от ацидоната, путем замены их производства более слабыми аналогами.[91][92] Аналоги эоксинов, производные эйкозапентаеновой кислоты, не описаны.
Эпоксиэйкозаноиды
Эпокси-эйкостриеновые кислоты (или EET) - и, предположительно, эпокси-эйкозатетраеновые кислоты - оказывают сосудорасширяющее действие на сердце, почки и другие кровеносные сосуды, а также на реабсорбцию почками натрия и воды и снижают кровяное давление и вызывают ишемию. и другие травмы сердца, мозга и других тканей; они также могут уменьшать воспаление, способствовать росту и метастазированию некоторых опухолей, способствовать росту новых кровеносных сосудов, в центральной нервной системе регулировать высвобождение нейропептид гормоны, а в периферической нервной системе подавляют или уменьшают восприятие боли.[46][47][49]
Серии ω-3 и ω-6
Снижение количества эйкозаноидов, производных от АК, и пониженная активность альтернативных продуктов, генерируемых из жирных кислот ω-3, служат основой для объяснения некоторых положительных эффектов увеличения потребления ω-3.
— Кевин Фриче, жирные кислоты как модуляторы иммунного ответа[93]
Арахидоновая кислота (AA; 20: 4 ω-6) находится во главе «каскада арахидоновой кислоты» - более двадцати опосредованных эйкозаноидами сигнальные пути контролирует широкий спектр клеточных функций, особенно регулирующих воспаление, иммунитет и Центральная нервная система.[4]
При воспалительной реакции две другие группы пищевых жирных кислот образуют каскады, которые параллельны каскаду арахидоновой кислоты и конкурируют с ним. EPA (20: 5 ω-3) обеспечивает наиболее важный конкурирующий каскад. ДГЛА (20: 3 ω-6) обеспечивает третий, менее заметный каскад. Эти два параллельных каскада смягчают воспалительные эффекты АК и его продуктов. Низкое потребление с пищей этих менее вызывающих воспаление жирных кислот, особенно ω-3, было связано с несколькими заболеваниями, связанными с воспалением, и, возможно, некоторыми психические заболевания.
Соединенные штаты. Национальные институты здоровья и Национальная медицинская библиотека заявить, что есть Доказательства уровня `` А '' что повышенный уровень ω-3 в рационе улучшает результаты гипертриглицеридемия, вторичный сердечно-сосудистые заболевания профилактика и гипертония Имеются доказательства уровня «B» («хорошие научные доказательства») увеличения содержания ω-3 в рационе. первичная профилактика сердечно-сосудистых заболеваний, ревматоидный артрит, и защита от токсичность циклоспорина в трансплантация органа Они также отмечают дополнительные предварительные данные, показывающие, что диетический ω-3 может облегчить симптомы некоторых психических расстройств.[94]
Помимо влияния на эйкозаноиды, пищевые полиненасыщенные жиры модулируют иммунный ответ посредством трех других молекулярных механизмов. Они (а) изменяют состав и функция мембраны, в том числе в составе липидные рафты; (б) изменить цитокин биосинтез; и (c) непосредственно активировать транскрипцию гена.[93] Из них лучше всего изучено действие на эйкозаноиды.
Механизмы действия ω-3
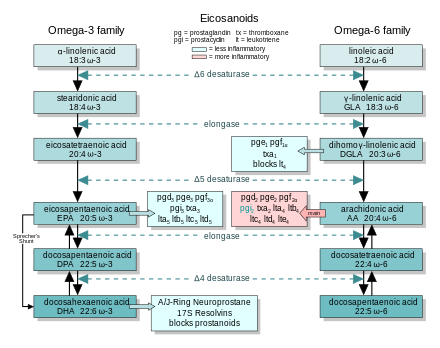
В целом эйкозаноиды, полученные из АК, способствуют воспалению, а эйкозаноиды из ЭПК и GLA (через DGLA) менее воспалительные, или неактивные, или даже противовоспалительные и прорешающий.
На рисунке показаны цепи синтеза ω-3 и -6, а также основные эйкозаноиды из AA, EPA и DGLA.
Диетический ω-3 и ГЛК противодействуют воспалительным эффектам эйкозаноидов АА тремя способами, в соответствии с эйкозаноидными путями:
- Смещение- Пищевой ω-3 снижает концентрацию АК в тканях, поэтому образуется меньше ω-6 эйкозаноидов.
- Конкурентное торможение—DGLA и EPA конкурируют с AA за доступ к ферментам циклооксигеназы и липоксигеназы. Таким образом, присутствие DGLA и EPA в тканях снижает выход эйкозаноидов АК.
- Противодействие- Некоторые эйкозаноиды, полученные из DGLA и EPA, противодействуют своим аналогам, полученным из АА.
Роль в воспалении
С древности, основные признаки воспаления были известны как: калорийность (тепло), dolor (боль), опухоль (опухоль) и rubor (покраснение). Эйкозаноиды связаны с каждым из этих признаков.
Покраснение - Укус насекомого вызывает классический воспалительный ответ. Короткое действие сосудосуживающие средства - TXA2- быстро освобождены после травмы. Сайт может на мгновение побледнеть. Тогда TXA2 опосредует выпуск вазодилататоры PGE2 и LTB4. Кровеносные сосуды набухают, и рана краснеет.
Припухлость —LTB4 делает кровеносные сосуды более проницаемыми. Плазма просачивается в соединительные ткани, и они набухают. В процессе также теряются провоспалительные цитокины.
Боль —The цитокины увеличить активность ЦОГ-2. Это повышает уровень PGE2, сенсибилизирующие болевые нейроны.
Высокая температура —PGE2 также является сильнодействующим пиретическим агентом. Аспирин и НПВП - препараты, которые блокируют пути ЦОГ и останавливают синтез простаноидов - ограничивают лихорадку или жар локализованного воспаления.
История
В 1930 году гинеколог Рафаэль Курцрок и фармаколог Чарльз Лейб описали простагландин В период с 1929 по 1932 год Бёрр и Бёрр показали, что ограничение употребления жиров в рационе животных приводит к болезни, вызванной дефицитом, и впервые описали незаменимые жирные кислоты.[95]В 1935 г. фон Эйлер идентифицировали простагландин. В 1964 г. Бергстрём и Самуэльссон связали эти наблюдения, когда они показали, что «классические» эйкозаноиды были производными арахидоновой кислоты, которая ранее считалась одной из незаменимых жирных кислот.[96]В 1971 г. Флюгер показали, что аспирин и аналогичные препараты подавляют синтез простагландинов.[97] Фон Эйлер получил Нобелевская премия в медицине в 1970 году, которую Самуэльссон, Вейн и Бергстрем также получили в 1982 году.Э. Дж. Кори получил его по химии в 1990 году в основном за синтез простагландинов.
Смотрите также
использованная литература
- ^ Эдвардс IJ, О'Флаэрти JT (2008). «Омега-3 жирные кислоты и PPAR-гамма при раке». PPAR исследования. 2008: 358052. Дои:10.1155/2008/358052. ЧВК 2526161. PMID 18769551.
- ^ ДеКатерина, Р. Баста, Г. (июнь 2001 г.). «Жирные кислоты n-3 и воспалительная реакция - биологический фон» (PDF). Добавки European Heart Journal. 3, приложение D: D42 – D49. Дои:10.1016 / S1520-765X (01) 90118-X. Получено 2006-02-10.
- ^ а б Функ, Колин Д. (30 ноября 2001 г.). «Простагландины и лейкотриены: достижения в биологии эйкозаноидов». Наука. 294 (5548): 1871–1875. Bibcode:2001Научный ... 294.1871F. Дои:10.1126 / science.294.5548.1871. PMID 11729303.
- ^ а б Пиомелли, Даниэле (2000). "Арахидоновая кислота". Нейропсихофармакология: пятое поколение прогресса. Архивировано из оригинал на 2006-07-15. Получено 2006-03-03.
- ^ а б Соберман, Рой Дж .; Рождество, Питер (2003). «Организация и последствия эйкозаноидной сигнализации». J. Clin. Вкладывать деньги. 111 (8): 1107–1113. Дои:10.1172 / JCI18338. ЧВК 152944. PMID 12697726.
- ^ Бир-Роджерс (2001). «Лексикон липидного питания ИЮПАК» (PDF). Получено 1 июня, 2006.
- ^ Простациклин - PGI - ранее классифицировался как простагландин и сохраняет свой старый PGI2 идентификатор.
- ^ Эйкозаноиды с разными буквами имеют размещение двойных связей и разные функциональные группы прикреплен к молекулярному скелету. Буквы указывают примерно на порядок, в котором эйкозаноиды были впервые описаны в литературе. Диаграммы для PG [A – H] см. Киберлипид Центр. «Простаноиды». Архивировано из оригинал на 2007-02-08. Получено 2007-02-05.
- ^ Росси А.Г., Томас MJ, О'Флаэрти JT (1988). «Стереоспецифические действия 5-гидроксиэйкозатетраеноата». Письма FEBS. 240 (1–2): 163–6. Дои:10.1016/0014-5793(88)80360-0. PMID 3191990.
- ^ а б Страус Д.С., Стекло СК (2001). «Циклопентеноновые простагландины: новое понимание биологической активности и клеточных мишеней». Обзоры медицинских исследований. 21 (3): 185–210. Дои:10.1002 / med.1006.abs. PMID 11301410.
- ^ Prasad KN, Hovland AR, Cole WC, Prasad KC, Nahreini P, Edwards-Prasad J, Andreatta CP (2000). «Множественные антиоксиданты в профилактике и лечении болезни Альцгеймера: анализ биологического обоснования». Клиническая нейрофармакология. 23 (1): 2–13. Дои:10.1097/00002826-200001000-00002. PMID 10682224.
- ^ Сюй Y, Цянь SY (2014). «Противораковая активность ω-6 полиненасыщенных жирных кислот». Биомедицинский журнал. 37 (3): 112–9. Дои:10.4103/2319-4170.131378. ЧВК 4166599. PMID 24923568.
- ^ Gomolka B, Siegert E, Blossey K, Schunck WH, Rothe M, Weylandt KH (2011). «Анализ образования липидных метаболитов жирных кислот омега-3 и омега-6 в образцах крови человека и мыши». Простагландины и другие липидные медиаторы. 94 (3–4): 81–7. Дои:10.1016 / j.prostaglandins.2010.12.006. PMID 21236358.
- ^ Зульфакар MH, Эдвардс M, Херд CM (2007). «Есть ли роль эйкозапентаеновой кислоты для местного применения в лечении псориаза?». Европейский журнал дерматологии. 17 (4): 284–91. Дои:10.1684 / ejd.2007.0201 (неактивно 01.09.2020). PMID 17540633.CS1 maint: DOI неактивен по состоянию на сентябрь 2020 г. (ссылка на сайт)
- ^ Карамия Дж. (2012). «[Незаменимые жирные кислоты и липидные медиаторы. Эндоканнабиноиды]». La Pediatria Medica e Chirurgica: Медицинская и хирургическая педиатрия (на итальянском). 34 (2): 65–72. Дои:10.4081 / pmc.2012.2. PMID 22730630.
- ^ а б c d Wiktorowska-Owczarek A, Berezińska M, Nowak JZ (2015). «ПНЖК: структуры, метаболизм и функции». Достижения клинической и экспериментальной медицины. 24 (6): 931–41. Дои:10.17219 / acem / 31243. PMID 26771963.
- ^ Танака Н., Ямагути Х., Фуруген А., Огура Дж., Кобаяши М., Ямада Т., Мано Н., Исэки К. (2014). «Количественная оценка внутриклеточных и внеклеточных простаноидов 3-й серии, производных эйкозапентаеновой кислоты, методом тандемной масс-спектрометрии с жидкостной хроматографией / ионизацией электрораспылением». Простагландины, лейкотриены и незаменимые жирные кислоты. 91 (3): 61–71. Дои:10.1016 / j.plefa.2014.04.005. PMID 24996760.
- ^ Ван Дайк TE, Серхан CN (2003). «Разрешение воспаления: новая парадигма патогенеза заболеваний пародонта». J. Dent. Res. 82 (2): 82–90. Дои:10.1177/154405910308200202. PMID 12562878. S2CID 40812937.
- ^ Серхан К.Н., Готлингер К., Хонг С., Арита М. (2004). «Резолвины, докозатриены и нейропротектины, новые медиаторы, производные омега-3, и их эндогенные эпимеры, запускаемые аспирином: обзор их защитных ролей при катабазе». Простагландины Другие липидные препараты. 73 (3–4): 155–72. Дои:10.1016 / j.prostaglandins.2004.03.005. PMID 15290791.
- ^ Андерле П., Фермер П., Бергер А., Робертс М.А. (2004). «Нутригеномный подход к пониманию механизмов, с помощью которых пищевые длинноцепочечные жирные кислоты индуцируют генные сигналы и механизмы контроля, участвующие в канцерогенезе». Питание (Бербанк, округ Лос-Анджелес, Калифорния). 20 (1): 103–8. Дои:10.1016 / j.nut.2003.09.018. PMID 14698023.
- ^ Эванс А.Р., Юнгер Х., Саутхолл М.Д. и др. (2000). «Изопростаны, новые эйкозаноиды, которые вызывают ноцицепцию и повышают чувствительность сенсорных нейронов крыс». J. Pharmacol. Exp. Ther. 293 (3): 912–20. PMID 10869392.
- ^ О'Брайен В.Ф., Краммер Дж., О'Лири Т.Д., Мастроджианнис Д.С. (1993). «Влияние парацетамола на выработку простациклина у беременных». Am. J. Obstet. Гинеколь. 168 (4): 1164–9. Дои:10.1016 / 0002-9378 (93) 90362-м. PMID 8475962.
- ^ Берендт Х., Каше А., Эбнер фон Эшенбах С., Рисе Ю., Хасс-Марп Дж., Ринг Дж. (2001). «Секреция провоспалительных эйкозаноидоподобных веществ предшествует высвобождению аллергена из пыльцевых зерен в начале аллергической сенсибилизации» (PDF). Int. Arch. Аллергия Иммунол. 124 (1–3): 121–5. Дои:10.1159/000053688. PMID 11306946. S2CID 53331.
- ^ Сарау Х.М., Фоули Дж. Дж., Шмидт Д. Б. и др. (1999). «Фармакологическая характеристика in vitro и in vivo SB 201993, эйкозаноидоподобного антагониста рецептора LTB4 с противовоспалительной активностью». Простагландины лейкот. Ессент. Жирные кислоты. 61 (1): 55–64. Дои:10.1054 / plef.1999.0074. PMID 10477044.
- ^ Czerska M, Zieliński M, Gromadzińska J (2016). «Изопростаны - новая основная группа маркеров окислительного стресса». Международный журнал медицины труда и гигиены окружающей среды. 29 (2): 179–90. Дои:10.13075 / ijomeh.1896.00596. PMID 26670350.
- ^ Фридли О, Фрейган С (2016). «Циклопентенон-содержащие окисленные фосфолипиды и их изопростаны в качестве пролонгирующих медиаторов воспаления». Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов. 1862 (4): 382–392. Дои:10.1016 / j.bbalip.2016.07.006. PMID 27422370.
- ^ Cuyamendous C, de la Torre A, Lee YY, Leung KS, Guy A, Bultel-Poncé V, Galano JM, Lee JC, Oger C, Durand T (2016). «Новизна фитофуранов, изофуранов, дигомо-изофуранов и нейрофуранов: открытие, синтез и потенциальное применение» (PDF). Биохимия. 130: 49–62. Дои:10.1016 / j.biochi.2016.08.002. PMID 27519299.
- ^ Медицинский центр Канзасского университета (2004 г.). «Эйкозаноиды и воспаление» (PDF). Архивировано из оригинал (PDF) на 2005-05-16. Получено 2007-01-05.
- ^ а б c d Габбс М., Ленг С., Девасси Дж. Г., Монируджаман М., Аукема Х.М. (2015). «Достижения в нашем понимании оксилипинов, полученных из пищевых ПНЖК». Достижения в области питания (Bethesda, Мэриленд).. 6 (5): 513–40. Дои:10.3945 / ан.114.007732. ЧВК 4561827. PMID 26374175.
- ^ а б Пауэлл WS, Рокач Дж (2015). «Биосинтез, биологические эффекты и рецепторы гидроксиэйкозатетраеновых кислот (HETE) и оксоэйкозатетраеновых кислот (оксо-ETE), полученных из арахидоновой кислоты». Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов. 1851 (4): 340–55. Дои:10.1016 / j.bbalip.2014.10.008. ЧВК 5710736. PMID 25449650.
- ^ Капра В., Ровати Г.Э., Мангано П., Буччеллати С., Мерфи Р.К., Сала А (2015). «Трансцеллюлярный биосинтез эйкозаноидных липидных медиаторов». Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов. 1851 (4): 377–82. Дои:10.1016 / j.bbalip.2014.09.002. PMID 25218301.
- ^ Сайрус, Тиллманн; Witztum, Joseph L .; Рейдер, Дэниел Дж .; Тангирала, Раджендра; Фацио, Серхио; Linton, Macrae F .; Функ, Колин Д. (июнь 1999 г.). «Нарушение гена 12/15-липоксигеназы снижает атеросклероз у мышей с дефицитом апо E». J Clin Invest. 103 (11): 1597–1604н. Дои:10.1172 / JCI5897. ЧВК 408369. PMID 10359569.
- ^ Шеве Т. (март – апрель 2002 г.). «15-липоксигеназа-1: прооксидантный фермент». Биол. Chem. 383 (3–4): 365–74. Дои:10.1515 / BC.2002.041. PMID 12033428. S2CID 7487557.
- ^ Korbecki J, Baranowska-Bosiacka I, Gutowska I, Chlubek D (2014). «Циклооксигеназные пути». Acta Biochimica Polonica. 61 (4): 639–49. Дои:10.18388 / abp.2014_1825. PMID 25343148.
- ^ а б c d Клаар Д., Hartert TV, Peebles RS (2015). «Роль простагландинов при аллергическом воспалении легких и астме». Экспертный обзор респираторной медицины. 9 (1): 55–72. Дои:10.1586/17476348.2015.992783. ЧВК 4380345. PMID 25541289.
- ^ Симопулос А.П. (2010). «Генетические варианты метаболизма омега-6 и омега-3 жирных кислот: их роль в определении потребностей в питании и риска хронических заболеваний». Экспериментальная биология и медицина (Мэйвуд, Нью-Джерси). 235 (7): 785–95. Дои:10.1258 / ebm.2010.009298. PMID 20558833. S2CID 207195131.
- ^ а б Surh YJ, Na HK, Пак JM, Lee HN, Kim W, Yoon IS, Kim DD (2011). «15-дезокси-Δ¹², ¹⁴-простагландин J₂, электрофильный липидный медиатор противовоспалительной и про-разрешающей передачи сигналов». Биохимическая фармакология. 82 (10): 1335–51. Дои:10.1016 / j.bcp.2011.07.100. PMID 21843512.
- ^ Powell, W. S .; Рокач, Дж (2013). «Хемоаттрактант эозинофилов 5-оксо-ETE и рецептор OXE». Прогресс в исследованиях липидов. 52 (4): 651–65. Дои:10.1016 / j.plipres.2013.09.001. ЧВК 5710732. PMID 24056189.
- ^ Родмарк О, Верц О, Штайнхильбер Д., Самуэльссон Б. (2015). «5-липоксигеназа, ключевой фермент биосинтеза лейкотриенов при здоровье и болезнях». Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов. 1851 (4): 331–9. Дои:10.1016 / j.bbalip.2014.08.012. PMID 25152163.
- ^ Ахмад С., Туласингам М., Паломбо И., Дейли Д.О., Джонсон К.А., Моргенштерн Р., Хеггстрём Дж.З., Ринальдо-Маттис А. (2015). «Тримерная микросомальная глутатионтрансфераза 2 демонстрирует одну треть реакционной способности сайтов». Biochimica et Biophysica Acta (BBA) - Белки и протеомика. 1854 (10 Pt A): 1365–71. Дои:10.1016 / j.bbapap.2015.06.003. PMID 26066610.
- ^ Пейс-Ашиак, К. Р. (2009). «Гепоксилины и некоторые аналоги: обзор их биологии». Британский журнал фармакологии. 158 (4): 972–81. Дои:10.1111 / j.1476-5381.2009.00168.x. ЧВК 2785520. PMID 19422397.
- ^ Добрян, А.Д .; Lieb, D.C .; Cole, B.K .; Тейлор-Фишвик, Д. А .; Chakrabarti, S.K .; Надлер, Дж. Л. (2011). «Функциональная и патологическая роль 12- и 15-липоксигеназ». Прогресс в исследованиях липидов. 50 (1): 115–31. Дои:10.1016 / j.plipres.2010.10.005. ЧВК 3012140. PMID 20970452.
- ^ Иванов, I; Kuhn, H; Хейдек, Д. (2015). «Структурная и функциональная биология 15-липоксигеназы-1 арахидоновой кислоты (ALOX15)». Ген. 573 (1): 1–32. Дои:10.1016 / j.gene.2015.07.073. ЧВК 6728142. PMID 26216303.
- ^ Виттвер, Дж; Херсбергер, М. (2007). «Две стороны 15-липоксигеназы при атеросклерозе». Простагландины, лейкотриены и незаменимые жирные кислоты. 77 (2): 67–77. Дои:10.1016 / j.plefa.2007.08.001. PMID 17869078.
- ^ Кроц Д.Л., Сюй Ф. (2005). «Регулирование и ингибирование омега-гидроксилаз арахидоновой кислоты и образования 20-HETE». Ежегодный обзор фармакологии и токсикологии. 45: 413–38. Дои:10.1146 / annurev.pharmtox.45.120403.100045. PMID 15822183.
- ^ а б Ян, Л; Мяки-Петая, К; Чериян, Дж; McEniery, C; Уилкинсон, И. Б. (2015). «Роль эпоксиэйкозатриеновой кислоты в сердечно-сосудистой системе». Британский журнал клинической фармакологии. 80 (1): 28–44. Дои:10.1111 / bcp.12603. ЧВК 4500322. PMID 25655310.
- ^ а б c Spector, A. A .; Ким, Х.Ю. (2015). «Цитохром P450 эпоксигеназный путь метаболизма полиненасыщенных жирных кислот». Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов. 1851 (4): 356–65. Дои:10.1016 / j.bbalip.2014.07.020. ЧВК 4314516. PMID 25093613.
- ^ Фер, М; Dréano, Y; Лукас, Д; Corcos, L; Salaün, J. P .; Berthou, F; Амет, Y (2008). «Метаболизм эйкозапентаеновой и докозагексаеновой кислот рекомбинантными человеческими цитохромами P450». Архивы биохимии и биофизики. 471 (2): 116–25. Дои:10.1016 / j.abb.2008.01.002. PMID 18206980.
- ^ а б Шахаби, П; Siest, G; Meyer, U.A .; Visvikis-Siest, S (2014). «Эпоксигеназы цитохрома P450 человека: изменчивость экспрессии и роль в заболеваниях, связанных с воспалением». Фармакология и терапия. 144 (2): 134–61. Дои:10.1016 / j.pharmthera.2014.05.011. PMID 24882266.
- ^ Frömel, T; Kohlstedt, K; Попп, Р; Инь, X; Аввад, К; Barbosa-Sicard, E; Thomas, A. C .; Lieberz, R; Майр, М; Флеминг, I (2013). «Цитохром P4502S1: новая эпоксигеназа жирных кислот моноцитов / макрофагов в атеросклеротических бляшках человека». Фундаментальные исследования в кардиологии. 108 (1): 319. Дои:10.1007 / s00395-012-0319-8. PMID 23224081. S2CID 9158244.
- ^ Флеминг, I (2014). «Фармакология оси цитохром Р450 эпоксигеназа / растворимая эпоксидгидролаза в сосудистой сети и сердечно-сосудистых заболеваниях». Фармакологические обзоры. 66 (4): 1106–40. Дои:10.1124 / пр.113.007781. PMID 25244930. S2CID 39465144.
- ^ Вестфаль, К; Конкель, А; Шунк, В. Х. (2011). «CYP-эйкозаноиды - новое звено между омега-3 жирными кислотами и сердечными заболеваниями?». Простагландины и другие липидные медиаторы. 96 (1–4): 99–108. Дои:10.1016 / j.prostaglandins.2011.09.001. PMID 21945326.
- ^ Мацуока Т., Нарумия С. (2007). «Передача сигналов рецептора простагландина при болезни». Журнал ScienceWorld. 7: 1329–47. Дои:10.1100 / tsw.2007.182. ЧВК 5901339. PMID 17767353.
- ^ Томас Дж., Фэркло А., Кавана Дж., Келли А. Дж. (2014). «Вагинальный простагландин (PGE2 и PGF2a) для индукции родов в срок». Кокрановская база данных систематических обзоров (6): CD003101. Дои:10.1002 / 14651858.CD003101.pub3. ЧВК 7138281. PMID 24941907.
- ^ Росси А., Анзалоне А., Фортуна М.С., Каро Дж., Гарелли В., Прантеда Дж., Карлезимо М. (2016). «Мульти-терапия андрогенетической алопеции: обзор и клинический опыт». Дерматологическая терапия. 29 (6): 424–432. Дои:10.1111 / dth.12390. HDL:11573/877469. PMID 27424565.
- ^ Гарза Л.А., Лю Й., Ян З., Алагесан Б., Лоусон Дж. А., Норберг С. М., Лой Д. Е., Чжао Т., Блатт Х. Б., Стэнтон, округ Колумбия, Карраско Л., Ахлувалия Г., Фишер С. М., Фицджеральд Г. А., Котсарелис Г. (2012). «Простагландин D2 подавляет рост волос и его уровень повышен на лысине у мужчин с андрогенной алопецией». Научная трансляционная медицина. 4 (126): 126ra34. Дои:10.1126 / scitranslmed.3003122. ЧВК 3319975. PMID 22440736.
- ^ а б Хата А.Н., Брейер Р.М. (2004). «Фармакология и передача сигналов рецепторов простагландина: множественные роли в воспалении и иммунной модуляции». Фармакология и терапия. 103 (2): 147–66. Дои:10.1016 / j.pharmthera.2004.06.003. PMID 15369681.
- ^ а б Фигейредо-Перейра М.Э., Корвин С., Бабич Дж. (2016). «Простагландин J2: потенциальная мишень для остановки нейродегенерации, вызванной воспалением». Летопись Нью-Йоркской академии наук. 1363 (1): 125–37. Bibcode:2016НЯСА1363..125Ф. Дои:10.1111 / nyas.12987. ЧВК 4801700. PMID 26748744.
- ^ Ходжа М., Буччеллати С., Капра В., Гарелла Д., Сина С., Роландо Б., Фруттеро Р., Карневали С., Сала А., Ровати Г.Э., Бертинария М. (2016). «Фармакологическая оценка in vitro многоцелевых агентов для антагонизма тромбоксановых простаноидных рецепторов и ингибирования ЦОГ-2» (PDF). Фармакологические исследования. 103: 132–43. Дои:10.1016 / j.phrs.2015.11.012. HDL:2318/1551575. PMID 26621246.
- ^ Cruz JE, Ward A, Anthony S, Chang S, Bae HB, Hermes-DeSantis ER (2016). «Доказательства использования эпопростенола для лечения феномена Рейно с цифровыми язвами или без них: обзор литературы». Летопись фармакотерапии. 50 (12): 1060–1067. Дои:10.1177/1060028016660324. PMID 27465880. S2CID 38333954.
- ^ О'Коннелл С., Амар Д., Букли А., Савале Л., Жаис Х, Чомейс М.С., Монтани Д., Умбер М., Симонно Г., Ситбон О. (2016). «Сравнительная безопасность и переносимость простациклинов при легочной гипертензии». Безопасность лекарств. 39 (4): 287–94. Дои:10.1007 / s40264-015-0365-х. PMID 26748508. S2CID 24852012.
- ^ Cacione, Daniel G .; Macedo, Cristiane R .; ду Карму Новаес, Фредерико; Баптиста-Силва, Хосе Кс (4 мая 2020 г.). «Фармакологическое лечение болезни Бюргера». Кокрановская база данных систематических обзоров. 5: CD011033. Дои:10.1002 / 14651858.CD011033.pub4. ISSN 1469-493X. ЧВК 7197514. PMID 32364620.
- ^ Читтерио А., Арнольди А., Панцери Е, Д'Анджело М.Г., Филосто М., Дилена Р., Арригони Ф., Кастелли М., Магини С., Герминиази С., Менни Ф., Мартинуцци А., Брезолин Н., Басси М. Т. (2014). «Мутации в генах CYP2U1, DDHD2 и GBA2 являются редкими причинами сложных форм наследственного спастического парапареза» (PDF). Журнал неврологии. 261 (2): 373–81. Дои:10.1007 / s00415-013-7206-6. HDL:2434/421160. PMID 24337409. S2CID 19189811.
- ^ а б Лю М., Йокомизо Т. (2015). «Роль лейкотриенов при аллергических заболеваниях». Allergology International. 64 (1): 17–26. Дои:10.1016 / j.alit.2014.09.001. PMID 25572555.
- ^ Бэк М., Далин С.Е., Дразен Дж. М., Эванс Дж. Ф., Серхан К. Н., Шимицу Т., Йокомизо Т., Ровати Г.Е. (2011). «Международный союз фундаментальной и клинической фармакологии. LXXXIV: номенклатура лейкотриеновых рецепторов, распределение и патофизиологические функции». Фармакологические обзоры. 63 (3): 539–84. Дои:10.1124 / пр.110.004184. PMID 21771892. S2CID 5563700.
- ^ Бэк М., Пауэлл В.С., Далин С.Е., Дразен Дж. М., Эванс Дж. Ф., Серхан С. Н., Шимицу Т., Йокомизо Т., Ровати Г.Е. (2014). «Обновленная информация о лейкотриеновых, липоксиновых и оксоэйкозаноидных рецепторах: обзор 7 IUPHAR». Британский журнал фармакологии. 171 (15): 3551–74. Дои:10.1111 / bph.12665. ЧВК 4128057. PMID 24588652.
- ^ Cingi C, Muluk NB, Ipci K, ahin E (2015). «Антилейкотриены при воспалительных заболеваниях верхних дыхательных путей». Текущие отчеты об аллергии и астме. 15 (11): 64. Дои:10.1007 / s11882-015-0564-7. PMID 26385352. S2CID 38854822.
- ^ Неттис Э., Д'Эразмо М., Ди Лео Э., Калогиури Дж., Монтинаро В., Ферраннини А., Вакка А. (2010). «Применение антагонистов лейкотриенов при кожных заболеваниях из области аллергологии». Медиаторы воспаления. 2010: 1–6. Дои:10.1155/2010/628171. ЧВК 2945673. PMID 20886028.
- ^ Канаока Ю., Маэкава А., Остин К.Ф. (2013). «Идентификация белка GPR99 как потенциального третьего рецептора цистеинил лейкотриена с предпочтением лейкотриенового лиганда E4». Журнал биологической химии. 288 (16): 10967–72. Дои:10.1074 / jbc.C113.453704. ЧВК 3630866. PMID 23504326.
- ^ а б c Романо М, Чианчи Э, Симиеле Ф, Реккиути А (2015). «Липоксины и липоксины, вызываемые аспирином в разрешении воспаления». Европейский журнал фармакологии. 760: 49–63. Дои:10.1016 / j.ejphar.2015.03.083. PMID 25895638.
- ^ а б c Чианг Н., Серхан К.Н., Дален С.Е., Дразен Дж. М., Хэй Д. В., Ровати Г. Э., Шимицу Т., Йокомидзо Т., Бринк С. (2006). «Рецептор липоксина ALX: сильные лиганд-специфические и стереоселективные действия in vivo». Фармакологические обзоры. 58 (3): 463–87. Дои:10.1124 / пр.58.3.4. PMID 16968948. S2CID 6496181.
- ^ Цюй Кью, Сюань В., Фан Г.Х. (2015). «Роль резолвинов в разрешении острого воспаления». Cell Biology International. 39 (1): 3–22. Дои:10.1002 / cbin.10345. PMID 25052386.
- ^ Лим Дж.Й., Пак С.К., Хван С.В. (2015). «Биологическая роль резолвина и родственных веществ в разрешении боли». BioMed Research International. 2015: 830930. Дои:10.1155/2015/830930. ЧВК 4538417. PMID 26339646.
- ^ а б Серхан К.Н., Чианг Н., Далли Дж., Леви Б.Д. (2015). «Липидные медиаторы в разрешении воспаления». Перспективы Колд-Спринг-Харбор в биологии. 7 (2): a016311. Дои:10.1101 / cshperspect.a016311. ЧВК 4315926. PMID 25359497.
- ^ Серхан Ч.Н., Чианг Н. (2013). «Фаза разрешения липидных медиаторов воспаления: агонисты разрешения». Текущее мнение в фармакологии. 13 (4): 632–40. Дои:10.1016 / j.coph.2013.05.012. ЧВК 3732499. PMID 23747022.
- ^ Ян Л., Маки-Петая К., Чериян Дж., МакЭниери К., Уилкинсон И.Б. (2015). «Роль эпоксиэйкозатриеновой кислоты в сердечно-сосудистой системе». Британский журнал клинической фармакологии. 80 (1): 28–44. Дои:10.1111 / bcp.12603. ЧВК 4500322. PMID 25655310.
- ^ Номер клинического исследования NCT00847899 для «Оценка ингибитора растворимой эпоксидгидролазы (s-EH) у пациентов с легкой и средней гипертензией и нарушенной толерантностью к глюкозе» ClinicalTrials.gov
- ^ Bos C, Richel D, Ritsema T, Peppelenbosch M, Versteeg H (2004). «Простаноиды и простаноидные рецепторы в передаче сигналов». Int J Biochem Cell Biol. 36 (7): 1187–205. Дои:10.1016 / j.biocel.2003.08.006. PMID 15109566.
- ^ Самуэльссон Б. (май 1983 г.). «Лейкотриены: медиаторы реакций гиперчувствительности немедленного типа и воспаления». Наука. 220 (4597): 568–575. Bibcode:1983Научный ... 220..568С. Дои:10.1126 / science.6301011. PMID 6301011.
- ^ Haeggström JZ, Funk CD (2011). «Липоксигеназные и лейкотриеновые пути: биохимия, биология и роль в заболевании». Химические обзоры. 111 (10): 5866–98. Дои:10.1021 / cr200246d. PMID 21936577.
- ^ Анвар Ю., Сабир Дж. С., Куреши М. И., Шайни К. С. (2014). «5-липоксигеназа: перспективный лекарственный препарат-мишень против воспалительных заболеваний - биохимическая и фармакологическая регуляция». Текущие цели в отношении лекарств. 15 (4): 410–22. Дои:10.2174/1389450114666131209110745. PMID 24313690.
- ^ Кар М., Алтынтопрак Н., Мулюк Н. Б., Улусой С., Бафаких С. А., Цинги С. (март 2016 г.). «Антилейкотриены при аденотонзиллярной гипертрофии: обзор литературы». Европейский архив оторино-ларингологии. 273 (12): 4111–4117. Дои:10.1007 / s00405-016-3983-8. PMID 26980339. S2CID 31311115.
- ^ Уссала А., Майорга С., Бланка М., Барбо А., Наконечна А., Сернадас Дж., Готуа М., Брокоу К., Каубет Дж. К., Бирхер А., Атанаскович М., Демоли П., К. Танно Л., Террехорст I, Лагуна Дж. Дж., Романо А., Геан JL (апрель 2016 г.). «Генетические варианты, связанные с реакциями немедленной гиперчувствительности, вызванными лекарствами: систематический обзор в соответствии с PRISMA». Аллергия. 71 (4): 443–62. Дои:10.1111 / все.12821. PMID 26678823.
- ^ Митчелл С., Балп М.М., Сэмюэл М., Макбрайд Д., Маурер М. (2015). «Систематический обзор методов лечения хронической спонтанной крапивницы с неадекватным ответом на лицензированные препараты первой линии». Международный журнал дерматологии. 54 (9): 1088–104. Дои:10.1111 / ijd.12727. PMID 25515967.
- ^ Ву Ш, Чен XQ, Лю Б., Ву Х. Дж., Дун Л. (2013). «Эффективность и безопасность 15 (R / S) -метил-липоксина A (4) при местном лечении детской экземы». Британский журнал дерматологии. 168 (1): 172–8. Дои:10.1111 / j.1365-2133.2012.11177.x. PMID 22834636.
- ^ а б Василий MC, Леви BD (2016). «Специализированные про-рассасывающиеся медиаторы: эндогенные регуляторы инфекции и воспаления». Обзоры природы. Иммунология. 16 (1): 51–67. Дои:10.1038 / нет.2015.4. ЧВК 5242505. PMID 26688348.
- ^ Фельтенмарк С., Гаутам Н., Бруннстрем А., Гриффитс В., Бэкман Л., Эдениус С., Линдбом Л., Бьеркхольм М., Клаессон Х. Э. (январь 2008 г.). «Эоксины представляют собой провоспалительные метаболиты арахидоновой кислоты, вырабатываемые путем 15-липоксигеназы-1 в человеческих эозинофилах и тучных клетках». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 105 (2): 680–685. Bibcode:2008ПНАС..105..680Ф. Дои:10.1073 / pnas.0710127105. ЧВК 2206596. PMID 18184802.
- ^ Джеймс А., Дахам К., Бэкман Л., Бруннстрём А., Тингвалл Т., Кумлин М., Эдениус К., Дален С.Е., Дальен Б., Клаессон Х.Э. (2013). «Влияние аспирина на высвобождение эоксина C4, лейкотриена C4 и 15-HETE в эозинофильных гранулоцитах, выделенных от пациентов с астмой». Int. Arch. Аллергия Иммунол. 162 (2): 135–42. Дои:10.1159/000351422. PMID 23921438. S2CID 29180895.
- ^ Клаессон HE (2009). «О биосинтезе и биологической роли эоксинов и 15-липоксигеназы-1 при воспалении дыхательных путей и лимфоме Ходжкина». Простагландины и другие липидные медиаторы. 89 (3–4): 120–5. Дои:10.1016 / j.prostaglandins.2008.12.003. PMID 19130894.
- ^ Серхан К.Н., Чианг Н., Далли Дж. (2015). «Код разрешения острого воспаления: новые способствующие разрешению липидные медиаторы в разрешении». Семинары по иммунологии. 27 (3): 200–15. Дои:10.1016 / j.smim.2015.03.004. ЧВК 4515371. PMID 25857211.
- ^ Guichardant M, Calzada C, Bernoud-Hubac N, Lagarde M, Véricel E (2015). «Омега-3 полиненасыщенные жирные кислоты и оксигенированный метаболизм при атеротромбозе». Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов. 1851 (4): 485–95. Дои:10.1016 / j.bbalip.2014.09.013. PMID 25263947.
- ^ Calder PC (2014). «Биомаркеры иммунитета и воспаления для использования в вмешательствах в области питания: работа Европейского отделения Международного института наук о жизни над критериями отбора и интерпретацией». Целевые препараты для лечения эндокринных, метаболических и иммунных расстройств. 14 (4): 236–44. Дои:10.2174/1871530314666140709091650. PMID 25008763.
- ^ а б Фриче, Кевин (август 2006 г.). «Жирные кислоты как модуляторы иммунного ответа». Ежегодный обзор питания. 26: 45–73. Дои:10.1146 / annurev.nutr.25.050304.092610. PMID 16848700.
- ^ Национальный институт здоровья (1 августа 2005 г.). «Омега-3 жирные кислоты, рыбий жир, альфа-линоленовая кислота». Архивировано из оригинал 3 мая 2006 г.. Получено 26 марта, 2006.
- ^ Burr, G.O .; Берр, М. (1930). «О природе и роли жирных кислот, незаменимых в питании» (PDF). J. Biol. Chem. 86 (587). Получено 2007-01-17.
- ^ Bergström, S .; Danielsson, H .; Самуэльссон, Б. (1964). «Ферментативное образование простагландина Е2 из арахидоновой кислоты». Биохим. Биофиз. Acta. 90 (207): 207–10. Дои:10.1016 / 0304-4165 (64) 90145-х. PMID 14201168.
- ^ Вэйн, Дж. Р. (23 июня 1971 г.). «Ингибирование синтеза простагландинов как механизм действия аспириноподобных препаратов». Природа Новая Биология. 231 (25): 232–5. Дои:10.1038 / newbio231232a0. PMID 5284360.
внешние ссылки
- Эйкозаноиды в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)

