Липоксин - Lipoxin
 | |
| Имена | |
|---|---|
| Название ИЮПАК 5S, 14R, 15S-тригидрокси-6E, 8Z, 10E, 12E -эйкозатетраеновая кислота | |
| Другие имена LXB4 | |
| Идентификаторы | |
3D модель (JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
PubChem CID | |
| |
| |
| Свойства | |
| C20ЧАС32О5 | |
| Молярная масса | 352,46508 г / моль |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |

А липоксин (LX или Lx), сокращение от липоксигеназа продукт взаимодействия, является биоактивным автакоид метаболит арахидоновая кислота сделаны различными типами клеток. Они относятся к категории неклассические эйкозаноиды и члены специализированные посредники по разрешению споров (SPM) семейство полиненасыщенная жирная кислота (ПНЖК) метаболиты. Как и другие SPM, LX формируются во время, а затем действуют для разрешения воспалительные реакции. Первоначально были идентифицированы два липоксина, липоксин А4 (LXA4) и LXB4, но более поздние исследования выявили эпимеры из этих двух LX: эпи-липоксины, 15-эпи-LXA4 и 15-эпи-LXB4 соответственно.
История
LXA4 и LXB4 были впервые описаны Серханом, Хамбергом и лауреатом Нобелевской премии. Самуэльссон в 1984 г.[1] Они сообщили, что человеческая кровь нейтрофилы, при стимуляции заставляют эти два липоксина и эти нейтрофилы при стимуляции одним из LX монтироваться супероксид анион (O2−) поколение и дегрануляция ответы. Оба ответа считаются провоспалительными в том смысле, что, хотя и направлены на нейтрализацию вторгшихся патогенов и переваривание чужеродного материала, они могут способствовать повреждению тканей хозяина и тем самым продлевать и способствовать дальнейшему воспалению. Однако последующие исследования показали, что эти липоксины, а также их эпимеры, epi-LXA4 и LXB4, действуют в первую очередь для смягчения и устранения воспаления, т. е. обладают противовоспалительным действием. клеточная сигнализация агенты.
Биохимия
Липоксины получают ферментативным путем из арахидоновая кислота, ω-6 жирная кислота. Структурно они определяются как метаболиты арахидоновой кислоты, содержащие три гидроксил остатки (также называемые гидроксильными остатками) и четыре двойные связи. Это структурное определение отличает их от других SPM, таких как резолвины, нейропротектины, и марезины, которые являются метаболитами омега-3 жирные кислоты, эйкозапентаеновая кислота или докозагексаеновая кислота, а также ряд метаболитов, полученных из других ПНЖК (см. специализированные посредники по разрешению споров ). Все эти другие SPM обладают активностью и функциями, сходными, хотя и не обязательно идентичными, с липоксинами.[2][3]
Синтез
Формирование LX сохраняется у широкого круга видов животных, от рыб до человека.[4] Биосинтез LX требует двух отдельных ферментативных атак на арахидоновую кислоту (АК). Одна атака включает присоединение остатка гидроперокси (-O-OH) к углероду 15, превращение этого соединения в 14,15-эпоксид и разделение этого эпоксида с образованием продуктов либо 14,15-дигидроксиэйкозатетраеноата, либо 15-гидроксиэйкозатетраеноата. Этот шаг катализируется ферментами с 15-липоксигеназа активность, которая у людей включает ALOX15, ALOX12, лечится аспирином циклооксигеназа 2, и цитохром P450s микросомальных, митохондриальных или бактериальных подклассов. ALOX15B может также проводить этот метабоизм. Другая точка атаки фермента образует 5,6-эпоксид который разделяется либо на 5,6-дигидроксиэйкозатетраеноат, либо на 5-гидроксиэйкозатетраеноат; этот шаг катализируется 5-липоксигеназа (ALOX5). Соответственно, эти двойные оксигенации дают либо 5,6,15-тригидрокси-, либо 5,14,15-тригидроксиэйкозатетраеноаты.[5][6] Двойная оксигенация может проводиться внутри одного типа клеток, которые обладают ALOX5 и ферментом с 15-липоксигеназной активностью, или, альтернативно, двумя разными типами клеток, каждый из которых обладает одной из этих ферментативных активностей. В последнем трансцеллюлярный биосинтетический путь, один тип клеток образует 5,6-дигидрокси-, 5-гидрокси, 14,15-дигидрокси- или 15-гидроксиэйкозатетраеноат, а затем передает этот промежуточный продукт другому типу клеток, который метаболизирует его до конечного LX товар.[7] Например, LX образуются тромбоцитами, которые в отсутствие ALOX5 не могут их синтезировать. Скорее, нейтрофилы форма, 5,6-эпоксид, лейкотриен A4 (LTA4), через ALOX5 и передавал его тромбоцитам, которые затем восстанавливали его до продукта 5,6-дигидрокси-эйкозатераэноата и далее метаболизировали его через ALOX12 с образованием 15-гидрокси продукта, LXA4.[5] Два LX различаются от эпимеров 15-epi-LTX своими структурными формулами:
- LxA4: 5S,6р,15S-тригидрокси-7E,9E,11Z,13E-эйкозатетраеновая кислота
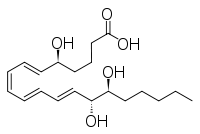
- LxB4: 5S,14р,15S-тригидрокси-6E,8Z,10E,12E-эйкозатетраеновая кислота
- 15-эпи-LxA4: 5S,6р,15р-тригидрокси-7E,9E,11Z,13E-эйкозатетраеновая кислота
- 15-эпи-LxB4: 5S,14р,15р-тригидрокси-6E,8Z,10E,12E-эйкозатриеновая кислота
Обратите внимание, что два LX имеют свои 15-гидроксильные остатки в S хиральность конфигурации, потому что все ферменты ALOX образуют 15S-гидрокси продукты АА. Напротив, 15-гидроксильные остатки двух эпи-LX составляют 15р продукты хиральности, потому что они синтезируются обработанной аспирином циклооксигеназой 2 или микросомальной, митохондриальной или бактериальной Цитохром P450s; эти ферменты почти полностью или частично образуют 15р-гидроксипродукты.[5] (15-Эпи-LTA44 и 15-эпи-LTB44 иногда называют AT-LxA4 и AT-LxB4соответственно, при подтверждении их образования обработанной аспирином циклооксигеназой 2, т.е. Аспирин-Туправляемая циклооксигеназа 2.)
В дополнение к путям, указанным выше, было показано, что другие пути трансцеллюлярного метаболизма продуцируют LX. Например, 5-липоксигеназа (т.е. (ALOX5) в нейтрофилах и 15-липоксигеназа -1 (т. Е. ALOX15) в незрелых эритроцитах и ретикулоцитах действуют последовательно, образуя LxA44 и LxB44; этот путь также происходит в последовательных взаимодействиях между нейтрофилами и эозинофилами; между эпителий или M2 Макрофаги / моноциты и нейтрофилы; и эндотелий или скелетные мышцы и нейтрофилы.[5][6][7]
Стимуляция синтеза
Липоксины обычно образуются в результате стимуляции выработки провоспалительных метаболитов арахидоновой кислоты. Однако некоторые цитокины, такие как IFN-γ и ИЛ-1β дальнейшее увеличение выработки липоксинов (а также других противовоспалительных метаболитов и белков ПНЖК, например IL4.[8]
Дальнейший метаболизм
LX быстро метаболизируются, в основном макрофагами, до неактивных продуктов за счет окисления на углероде 15 с образованием 15-кето (также называемые 15-оксо) продукты LX 15-гидроксипростагландин дегидрогеназа; 15-оксо-LXA4 может далее метаболизироваться до 13,14-дигидро-LXA4 по оксидоредуктаза. 15-эпи-LXA4 и 15-эпи-LXB4 более устойчивы к ферменту дегидрирования, чем их эпимеры LX.[4] В результате работы этого анаболический пути, LX имеют очень короткий период полураспада in vivo, у epi-LX длиннее in vivo Были получены периоды полураспада и, следовательно, более высокие активности, чем их эпимеры LX, и синтетические липоксины, которые метаболически устойчивы к этому пути, которые использовали в моделях на животных для изучения активности LX и протестировали в качестве потенциальных терапевтических агентов на животных и людях.[5][7]
Похож на различные другие метаболиты АК, такие как LTA4 и 5-оксо-эйкозатетраеновая кислота, клетки и ткани могут преобразовывать LX в 20-гидрокси продукты путем омега-окисление; также было показано, что они связывают LXA4 к глутатион формировать цистеинил-липоксины, изначально LXC4, который затем последовательно метаболизируется до LXD4 и LXE4.[9] Роль этих путей в ограничении или содействии активности LX полностью не изучена.
Эндоканнабиноидная система
Установлено, что противовоспалительный липид липоксин А4 эндогенный аллостерический усилитель CB1 каннабиноидный рецептор. Липоксин А4 усилить сродство анандамид на это рецептор оказывать каннабимиметические эффекты в мозг, аллостерически усиливая передачу сигналов AEA и тем самым усиливая эффекты этого эндоканнабиноид и то и другое in vitro и in vivo. В дополнение к этому липоксин А4 проявляют зависимый от рецептора CB1 защитный эффект против β-амилоид -индуцированный пространственная память нарушение у мышей.[10]
Аналоги липоксина
Относительно стабильные, т.е. метаболически устойчивые синтетические аналоги LXs и вызываемый аспирином 15-эпи-LXA4они могут имитировать многие из желаемых противовоспалительных действий нативных LX, «способствующих разрешению», и проходят испытания для клинического использования.[11] Структурно эти аналоги LX часто имитируют LX, будучи или очень похожими на 20-углеродную тригидроксижирную кислоту, но устойчивы к метаболической инактивации 15-гидроксипростагландиндегидрогеназы за счет наличия объемных или других структурных модификаций рядом с их 15-гидроксильными остатками.[5] Например, некоторые аналоги просто изменяют структуру LX, заменяя атом водорода атомом водорода. метил остаток на углероде 15 на LXA4 с образованием 15-метил-LXA4; замена последних 4 атомов углерода LXA4 или 15-эпи-LXA4 с остатком 1-фенокси или остатком 1-фенокси-4-фтор с образованием 16-фенокси-LX4, 15-эпи-15-фенокси-LXA4, 16- (пара-фторфенокси-LXA4, или 15-эпи-16- (пара-фторфенокси-LXA4; и образование связи между углеродом 9 и углеродом 14 LXA4 с образованием аналога внутреннего фенильного кольца, называемого ароматическим LXA4; другие, более сложные структурные аналоги, находящиеся в разработке, включают 15-epi-LXA4 аналоги называются ZK-142 и ZK994.[5]
Биологическая активность
Сотовые исследования
На начальных этапах многих острых воспалительных реакций поврежденные ткани, вторжение патогенов и другие локальные события заставляют близлежащие клетки производить и высвобождать провоспалительные метаболиты, полученные из арахидоновой кислоты, такие как: лейкотриены (LT), например LTB4, LTB4, LTC4, ООО4, и LTE4; гидроксиэйкозатетраеновые кислоты (HETE), например 5-HETE и 12-HETE; и оксоэйкозаноиды (оксо-ETE), например 5-оксо-эйкозатетраеновая кислота (5-оксо-ETE) и 12-оксо-ETE. Эти метаболиты действуют прямо или косвенно, рекрутируя циркулирующие лейкоциты, тканевые макрофаги и ткани. дендритные клетки к пораженному участку ткани. Последовательное скопление различных типов клеток способствует трансклеточным путям формирования специализированные посредники по разрешению споров (SPM), включая LX, которые затем начинают стимулировать клеточные и тканевые ответы, которые имеют тенденцию обращать вспять действие провоспалительных медиаторов, ослаблять и обращать вспять воспалительный ответ и инициировать восстановление тканей.[12]
LXA4 и 15-эпи-LXA4 имеют высокое сродство рецепторные лиганды для активаторов FPR2 рецептор. FPR2, который теперь называют рецептором ALX, ALX / FPR или ALX / FPR2, является Рецептор, связанный с G-белком первоначально идентифицированный как рецептор лейкоцитов хемотаксический фактор, N-Формилметионин-лейцил-фенилаланин (FMLP) на основании сходства его аминокислотной последовательности с известным рецептором FMLP, FPR1. У мышей обнаружено не менее шести гомологов этого рецептора. ALX / FPR представляет собой беспорядочный (т.е. взаимодействующий с различными лигандами) рецептор, который связывается и активируется другими лигандами, включая: а) различные N-формилолигопептиды, которые, как и FMLP, либо выделяются микробами, либо митохондрии или являются аналогами высвобождаемых микробами и митохондриями; б) неформильные олигопептиды микробного происхождения; в) определенные полипептиды, которые связаны с развитием хронических амилоидоз и / или воспаление, включая Сывороточный амилоид А (SAA) белки), пептидная форма из 42 аминокислот Бета-амилоид названный Aβ42, Humanin, и отщепленный растворимый фрагмент (аминокислоты 274-388) из Рецептор урокиназы; и г) другие SPM, включая Resolvins RvD1, RvD2, RvD5, AT-RvD1 и RvD3 (см. специализированные посредники по разрешению споров ).[5][7][13]
LXA4 и 15-эпи-LXA4 подавлять хемотаксис, переселение, образование супероксида, NF-κB активация и / или образование провоспалительных цитокинов (например, IL8, IL13, IL12, и IL5 ) нейтрофилами, эозинофилами, моноциты, Врожденные лимфоидные клетки, и / или макрофаги, а также подавить распространение и производство IgM и IgG антитела В-лимфоциты. Эти действия, по-видимому, включают стимуляцию противовоспалительных сигнальных путей, но также блокируют действия других лигандов ALX / FPR, которые моделируют провоспалительные пути.[5][6][12][14] Трансгенный у мышей, у которых повышена экспрессия ALX / FPR, наблюдается заметно сниженная воспалительная реакция на различные воздействия.[4] LXA4 и 15-эпи-LXA4, когда вводится Интратекальное введение на грызунов подавляют воспалительную боль; это действие может включать рецептор ALX / FPR, который, как было показано, присутствует в позвоночнике. астроциты подопытного животного и, на основании исследований с использованием 15-эпи-LXA, ингибирование NALP1 воспаление сигнальный комплекс.[6][15]
По механизмам, которые еще предстоит четко идентифицировать, два LX также: а) стимулируют способность лейкоцитов и эпителиальных клеток дыхательных путей убивать бактерии; б) блокировать выработку провоспалительных цитокинов, TNFα, увеличивая производство противовоспалительных цитокинов, CCR5 от Т-лимфоциты; в) 'повышают способность моноцитов и макрофагов к фагоцитоз (т. е. проглатывание) и тем самым удалить потенциально опасные апоптотический нейтрофилы и эозинофилы из очагов воспаления (см. Эффероцитоз ) либо путем прямого воздействия на эти клетки, либо путем стимуляции NK-клетки сделать так; г) заставляют различные типы клеток снижать выработку провоспалительных активные формы кислорода и выражение Молекулы клеточной адгезии и увеличить выработку ингибитора тромбоцитов, PGI2 и сосудорасширяющее средство, оксид азота; д) подавлять выработку провоспалительных цитокинов путем мезангиальные клетки, фибробласты и другие провоспалительные типы клеток; и е) уменьшить восприятие боли из-за воспаления.[5][6][12][14]
LXA4 и 15-epi-LTA4 также действуют путем мобилизации факторов транскрипции, которые регулируют экспрессию различных генов, регулирующих воспаление. LXA4 стимулирует различные типы клеток, чтобы способствовать проникновению Nrf2 в ядро и тем самым увеличить экспрессию генов, таких как гемоксигеназа-1 (HMOX1), который увеличивает выработку противовоспалительного газообразного сигнального агента, монооксида углерода и генов, участвующих в синтезе глутатион, продукт, нейтрализующий окислительный стресс и повреждение тканей, вызванное окислителями.[16][17] Метаболически устойчивые структурные аналоги LXB4 и 15-эпи-LXA4 препятствовать образованию Пероксинитрит (т.е. ONOO−) для ослабления мобилизации NFκB и Факторы транскрипции AP-1 за счет уменьшения их накопления в ядрах нейтрофилов, моноцитов и лимфоцитов; NFκB и AP-1 увеличивают экспрессию провоспалительных генов. Два LXB также запускают активацию супрессора сигнальных белков цитокинов (см. SOCS белков), которые, в свою очередь, ингибируют активацию STAT белок факторы транскрипции, которые активируют многие гены, вырабатывающие провоспалительные продукты.[7]
LXA4 и 15-эпи-LXA4 также высокое сродство антагонисты из Цистеиниловый рецептор лейкотриена 1 для которых лейкотриены (LT) LTC4, LTD4, и LTE4 находятся агонисты, то есть три лейкотриена связываются и, таким образом, стимулируют сокращение гладких мышц, хемотаксис эозинофилов, секрецию слизистых желез и различные другие про-аллергический ответы в клетках легких, кожи и других тканей.[4][18] (CysLT1 и ATX / FPR2 имеют идентичность аминокислотной последовательности 47%.[18]) Способность этих LX блокировать действия трех LT может способствовать их способности устранять аллергические реакции; например, LXA4 расслабляет сокращение гладких мышц, вызванное цистеиниловыми лейкотриенами у хомяка. щечный мешочек анализ и метаболически устойчивый 15-эпи-LXAA4 аналог сильно подавляет аллерген гиперчувствительность и воспаление дыхательных путей на мышиной модели.[4][18][19]
При более высоких концентрациях (> 30 нмоль / литр) LXA4 связывается с AHR рецептор арилгидроуглерода; После этого связывания AHR попадает в ядро, где соединяется с ядерным транслокатором AhR (ARNT). Комплекс AHR / ARNT связывается с ксенобиотические ответные элементы для активации транскрипции генов, большинство из которых участвует в основном в метаболизме ксенобиотиков. Эти гены включают SOCS2 (т.е. супрессор передачи сигналов цитокинов 2), CYP1A1, CYP1A2, CYP1B1, глутатион S-трансфераза Субъединица Ya, хинон оксидоредуктаза, UDP-глюкуронозилтрансфераза и Семейство альдегиддегидрогеназ 3, член A1. Это LXA4 активность была продемонстрирована только на мышиных клетках.[20][21]
LXA4 связывает и активирует рецептор эстрогена альфа. В этом качестве он имитирует молекулу эстрогена, чтобы стимулировать человеческое эндометрий эпителиальные клетки in vitro и ткани матки мыши in vivo.[22][23]
Действия LXB4 и 15-эпи-LXB4 были гораздо менее четко определены, чем их LXA4 аналоги. Их механизм (ы) стимуляции клеток-мишеней (например, рецепторов) неизвестен. Было показано, что один или оба этих аналога ингибируют рекрутирование нейтрофилов в места воспаления, ингибируют цитотоксичность NK-клетки, стимулируют привлечение моноцитов к участкам воспаления, усиливают фагоцитоз макрофагов и подавляют воспалительную боль у грызунов.[5][6][24]
Исследования на животных моделях
Неинфекционное воспаление
Было продемонстрировано, что один или несколько липоксинов или их метаболически устойчивых аналогов подавляют, ограничивают тяжесть и / или увеличивают выживаемость при широком диапазоне воспалительных и аллергических заболеваний, как было оценено в исследованиях на моделях мышей и крыс. Эти исследования включают модели экспериментально вызванных: Эндометриоз[25], колит, перитонит; панкреатит; почка воспаление и гломерулонефрит; легкое астма, кислотно-индуцированное повреждение легких, кистозный фиброз, плеврит, воспаление головного мозга и воспалительный компонент Болезнь Альцгеймера; сосудистые ишемические-реперфузионные повреждения различных органов, включая сердце и задние конечности; аллограф Отторжение трансплантата сердца, почек и Костный мозг; артрит; дерматит; пародонтит; роговица воспаление; боль, вызванная воспалением и гипералгезия.[5][7][4]
Липоксины обладают защитным действием на животных моделях инфекционного воспаления: a) LXA4 и LXA4 аналог уменьшал системное воспаление и улучшал выживаемость в моделях крыс Грамотрицательные бактерии сепсис;[12][26] б) 15-эпи-LXA4 подавил повреждение легкого (т. е. шоковое легкое или Острый респираторный дистресс-синдром ), вызванные внутрибрюшинным введением кишечная палочка у мышей; c) у трансгенных мышей наблюдается дефицит синтеза липоксина в результате удаления их Алокс5 гены были более восприимчивы к воспалительным и летальным эффектам Toxoplasma gondii и были спасены от этих дефектов LXA44;[27] г) LXA4 восстановлена функция макрофагов, вызванная респираторно-синцитиальный вирус у трансгенных мышей с дефицитом синтеза липоксина Алокс5 делеция гена;[12] д) LXA4 улучшился инфекционный пародонтит в моделях кроликов и свиней.[12] е) 15-эпи-LXA4 снижение уровня паразитов в крови, уменьшение сердечного воспаления и увеличение выживаемости в мышиной модели Trypanosoma cruzi -индуцированный Болезнь Шагаса;[27] е) '15-эпи-LXA4 длительное выживание в мышиной модели Плазмодий бергей -индуцированная церебральная малярия;[27] и г) LXA4 сокращает продолжительность аллергической реакции на паразитарную инвазию, Angiostrongylus costaricensis.[12]
Однако липоксины также имеют вредные эффекты в этих моделях: инфекция аэрозоля Микобактерии туберкулеза у трансгенных мышей с дефектом ALOX5, который способствует синтезу LX, наблюдалось гораздо менее серьезное воспаление и лучшая выживаемость, чем у контрольных мышей;[27] и лечение трансгенных мышей пероральным LXA4 отменил защитный эффект делеции ALOX5.[27]
Исследования на людях
Доклинические исследования
LX и epi-LX были обнаружены в различных тканях человека, подвергающихся широкому спектру воспалительных реакций, аллергических реакций и других состояний, например, в крови пациентов, подвергающихся коронарной ангиопластике или физических нагрузках.[5][6][24] LXA4 ингибирует бронхиальное сжимающее действие LTC4 и расслабляет предварительно сокращенные бронхи у астматиков.[4]
Вирус герпеса, связанный с саркомой Капоши (KSHV) вызывает злокачественную трансформацию клеток человека и отвечает за Саркома Капоши и первичная выпотная лимфома, два вида рака, от которых страдают, в частности, люди, инфицированные ВИЧ. Исследования на клетках саркомы Капоши и первичной эффузионной лимфомы человека показали, что: a) KSHV способствует выработке провоспалительных цитокинов, липоксигеназ, циклооксигеназы и метаболитов последних двух классов ферментов, подавляя выработку противовоспалительных сигнальных агентов, таких как LXA.4, очевидно, как стратегия повышения его латентности и способности к злокачественному преобразованию; б) клетки саркомы Карпози и первичной лимфомы выпота экспрессируют рецептор ALX / FPR; и c) обработка последних клеток LXA4 или 15-эпи-LXA4 обращает вспять этот профиль про-злокачественности провоспалительной передачи сигналов с помощью ALX / FPR-зависимого механизма. Эти исследования предполагают, что два LX или их аналоги должны быть протестированы на животных моделях, чтобы определить, могут ли они быть полезными для лечения двух злокачественных новообразований человека.[7][28]
Клинические исследования
В рандомизированное контролируемое исследование, местное применение 15-epi-LXA4 или сравнительно стабильного аналога LXB4, 15R / S-метил-LXB4, снижает выраженность экзема в исследовании 60 младенцев.[29][30]
В настоящее время BLXA4, аналог липоксина, проходит фазу 1 клинических испытаний и в настоящее время набирает добровольцев для лечения пероральных гингивит (увидеть: Безопасность и предварительная эффективность ополаскивателя для полости рта аналогом липоксина BLXA4-ME для лечения гингивита (BLXA4) в https://clinicaltrials.gov/ct2/show/NCT02342691?term=Lipoxin&rank=3 ).[7]
Смотрите также
использованная литература
- ^ Серхан К.Н., Хамберг М., Самуэльссон Б. (1984). «Тригидрокситетраены: новый ряд соединений, образованных из арахидоновой кислоты в лейкоцитах человека». Сообщения о биохимических и биофизических исследованиях. 118 (3): 943–9. Дои:10.1016 / 0006-291x (84) 91486-4. PMID 6422933.
- ^ Цюй Кью, Сюань В., Фан Г.Х. (2015). «Роль резолвинов в разрешении острого воспаления». Cell Biology International. 39 (1): 3–22. Дои:10.1002 / cbin.10345. PMID 25052386.
- ^ Вейландт KH (2016). «Метаболиты и медиаторы, производные докозапентаеновой кислоты - в двух словах, новый мир медицины липидных медиаторов». Европейский журнал фармакологии. 785: 108–15. Дои:10.1016 / j.ejphar.2015.11.002. PMID 26546723.
- ^ а б c d е ж г Леви Б.Д. (2005). «Липоксины и аналоги липоксинов при астме». Простагландины, лейкотриены и незаменимые жирные кислоты. 73 (3–4): 231–7. Дои:10.1016 / j.plefa.2005.05.010. PMID 16046112.
- ^ а б c d е ж г час я j k л м Романо М, Чианчи Э, Симиеле Ф, Реккиути А (2015). «Липоксины и липоксины, вызываемые аспирином в разрешении воспаления». Европейский журнал фармакологии. 760: 49–63. Дои:10.1016 / j.ejphar.2015.03.083. PMID 25895638.
- ^ а б c d е ж г Маркуорт Дж. Ф., Маддипати К. Р., Кэмерон-Смит Д. (2016). «Новые роли про-разрешающих липидных медиаторов в иммунологических и адаптивных реакциях на мышечное повреждение, вызванное физической нагрузкой». Обзор иммунологии упражнений. 22: 110–34. PMID 26853678.
- ^ а б c d е ж г час Чандрасекхаран Дж.А., Шарма-Валиа Н. (2015). «Липоксины: природный способ снять воспаление». Журнал исследований воспаления. 8: 181–92. Дои:10.2147 / JIR.S90380. ЧВК 4598198. PMID 26457057.
- ^ МакМэхон, Блейтин и Годсон, Кэтрин. «Липоксины: эндогенные регуляторы воспаления». Архивировано из оригинал на 25.01.2010. Получено 2006-02-07. Приглашенная обзорная статья.
- ^ Пауэлл В.С., Чанг Д., Гравий С. (1995). «5-Оксо-6,8,11,14-эйкозатетраеновая кислота является мощным стимулятором миграции эозинофилов человека». J. Immunol. 154 (8): 4123–32. PMID 7706749.
- ^ Памплона, Фабрицио А .; Феррейра, Джулиано; Менезеш де Лима, Октавио; Дуарте, Филипе Силвейра; Бенто, Аллиссон Фрейре; Форнер, Стефания; Villarinho, Jardel G .; Беллоккио, Луиджи; Вотяк, Карстен Т. (18 декабря 2012 г.). «Противовоспалительный липоксин A4 представляет собой эндогенный аллостерический усилитель каннабиноидного рецептора CB1». Труды Национальной академии наук Соединенных Штатов Америки. 109 (51): 21134–21139. Дои:10.1073 / pnas.1202906109. ISSN 0027-8424. ЧВК 3529012. PMID 23150578.
- ^ МакМахон Б., Митчелл С., Брэди Х.Р. (2001). «Липоксины: откровения о разрешении». Trends Pharmacol. Наука. 22 (8): 391–5. Дои:10.1016 / S0165-6147 (00) 01771-5. PMID 11478982.
- ^ а б c d е ж г Василий MC, Леви BD (2016). «Специализированные про-рассасывающиеся медиаторы: эндогенные регуляторы инфекции и воспаления». Обзоры природы. Иммунология. 16 (1): 51–67. Дои:10.1038 / нет.2015.4. ЧВК 5242505. PMID 26688348.
- ^ Йе Р.Д., Булай Ф., Ван Дж. М., Дальгрен С., Жерар С., Парментье М., Серхан С. Н., Мерфи П. М. (2009). "Международный союз фундаментальной и клинической фармакологии. LXXIII. Номенклатура семейства рецепторов формилпептида (FPR)". Фармакологические обзоры. 61 (2): 119–61. Дои:10.1124 / пр.109.001578. ЧВК 2745437. PMID 19498085.
- ^ а б Chiang N .; Арита М. и Серхан CN. (2005). «Противовоспалительная схема: липоксин, липоксины, запускаемые аспирином, и их рецептор ALX». Простагландины, лейкотриены и незаменимые жирные кислоты. 73 (3–4): 163–177. Дои:10.1016 / j.plefa.2005.05.003. PMID 16125378.
- ^ Ли Кью, Тиан И, Ван З.Ф., Лю С.Б., Ми В.Л., Ма ХДЖ, Ву Г.К., Ван Дж., Ю Дж, Ван ИК (2013). «Вовлечение спинальной инфламмасомы NALP1 в нейропатическую боль и анальгезию, вызванную аспирином-15-эпи-липоксином A4». Неврология. 254: 230–40. Дои:10.1016 / j.neuroscience.2013.09.028. PMID 24076348.
- ^ Chen XQ, Wu SH, Zhou Y, Tang YR (2013). «Гемоксигеназа-1, индуцированная липоксином A4, защищает кардиомиоциты от повреждения гипоксией / реоксигенацией посредством активации p38 MAPK и комплекса Nrf2 / ARE». PLOS ONE. 8 (6): e67120. Дои:10.1371 / journal.pone.0067120. ЧВК 3691153. PMID 23826208.
- ^ У Л., Ли ХХ, Ву Цюй, Мяо С., Лю З. Дж., Ву П, Йе ДЙ (2015). «Липоксин A4 активирует путь Nrf2 и уменьшает повреждение клеток в культивируемых кортикальных астроцитах, подвергшихся кислородно-глюкозной депривации / реперфузии». Журнал молекулярной неврологии. 56 (4): 848–57. Дои:10.1007 / s12031-015-0525-6. PMID 25702137.
- ^ а б c Гронерт К., Мартинссон-Нисканен Т., Раваси С., Чианг Н., Серхан К.Н. (2001). «Селективность рекомбинантных рецепторов лейкотриена D (4), лейкотриена B (4) и липоксина A (4) человека с запускаемым аспирином 15-epi-LXA (4) и регуляция сосудистых и воспалительных реакций». Американский журнал патологии. 158 (1): 3–9. Дои:10.1016 / S0002-9440 (10) 63937-5. ЧВК 1850279. PMID 11141472.
- ^ Ван К.С., Ву В.Ф. (2007). «Эйкозаноиды при астме». Acta Paediatrica Taiwanica = Тайвань Эр Ке Йи Сюэ Хуэй За Чжи. 48 (6): 299–304. PMID 18437962.
- ^ Шалдах CM, Риби Дж., Бьелданес Л.Ф. (июнь 1999 г.).«Липоксин A4: новый класс лигандов для рецептора Ah». Биохимия. 38: 7594–600. Дои:10.1021 / bi982861e. PMID 10360957.
- ^ Беннетт М, Гилрой Д.В. (2016). «Липидные медиаторы воспаления» (PDF). Микробиологический спектр. 4 (6). Дои:10.1128 / microbiolspec.MCHD-0035-2016. PMID 27837747.
- ^ Рассел Р., Гори И., Пеллегрини С., Кумар Р., Ахтари С., Canny GO (декабрь 2011 г.). «Липоксин А4 - новый модулятор рецепторов эстрогена». FASEB J. 25 (12): 4326–37. Дои:10.1096 / fj.11-187658. PMID 21885654.
- ^ Шалдах CM, Риби Дж., Бьелданес Л.Ф. (1999). «Липоксин A4: новый класс лигандов для рецептора Ah». Биохимия. 38 (23): 7594–600. Дои:10.1021 / bi982861e. PMID 10360957.
- ^ а б Эладжами Т.К., Колас Р.А., Далли Дж., Чианг Н., Серхан К.Н., Велти Ф.К. (2016). «Специализированные липидные медиаторы, прореагирующие у пациентов с ишемической болезнью сердца, и их потенциал для ремоделирования сгустка». Журнал FASEB. 30 (8): 2792–801. Дои:10.1096 / fj.201500155R. ЧВК 4970606. PMID 27121596.
- ^ Кумар Р., Клерк А.С., Гори И., Рассел Р., Пеллегрини С., Говендер Л., Висс Дж. К., Голшаян Д., Кэнни Г.О. (февраль 2014 г.). «Липоксин A4 предотвращает прогрессирование De Novo и установленного эндометриоза на модели мышей путем ослабления продукции простагландина E2 и передачи сигналов эстрогена». PLoS One. 9 (2): e89742, 1–14. Дои:10.1371 / journal.pone.0089742. ЧВК 3933674. PMID 24587003.
- ^ Ву Б., Уокер Дж., Шпора Б., Родригес А., Инь К. (2015). «Влияние липоксина A4 на антимикробное действие нейтрофилов при сепсисе». Простагландины, лейкотриены и незаменимые жирные кислоты. 94: 55–64. Дои:10.1016 / j.plefa.2014.11.005. PMID 25476955.
- ^ а б c d е Рассел CD, Шварце Дж. (2014). «Роль липидных медиаторов, способствующих разрешению инфекционных заболеваний». Иммунология. 141 (2): 166–73. Дои:10.1111 / imm.12206. ЧВК 3904237. PMID 24400794.
- ^ Чандрасекхаран Дж.А., Хуанг XM, Хван А., Шарма-Валиа Н. (2016). «Изменение противовоспалительного липоксинового микроокружения: новый взгляд на патогенез KSHV». Журнал вирусологии. 90: 11020–11031. Дои:10.1128 / JVI.01491-16. ЧВК 5126361. PMID 27681120.
- ^ Ву Ш, Чен XQ, Лю Б., Ву Х. Дж., Дун Л. (2013). «Эффективность и безопасность 15 (R / S) -метил-липоксина A (4) при местном лечении детской экземы». Британский журнал дерматологии. 168 (1): 172–8. Дои:10.1111 / j.1365-2133.2012.11177.x. PMID 22834636.
- ^ Аслам I, Сандовал LF, Feldman SR (2014). «Что нового в местном лечении аллергических заболеваний кожи». Текущее мнение в области аллергии и клинической иммунологии. 14 (5): 436–50. Дои:10.1097 / ACI.0000000000000093. PMID 25061854.
внешние ссылки
- Липоксины в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
