Активные формы кислорода - Reactive oxygen species

Активные формы кислорода (ROS) представляют собой химические молекулы с высокой реакционной способностью, образованные из-за электронной восприимчивости O2. Примеры ROS включают перекиси, супероксид, гидроксильный радикал, синглетный кислород,[3] и альфа-кислород.
Восстановление молекулярного кислорода (O2) производит супероксид (•О−
2), который является предшественником большинства других активных форм кислорода:[4]
- О2 + е− → •О−
2
Дисмутация супероксида производит пероксид водорода (ЧАС2О2):[4]
- 2 ч+ + •О−
2 + •О−
2 → H2О2 + O2
В свою очередь, перекись водорода может частично восстановиться, образуя гидроксид-ион и гидроксильный радикал (•OH), или полностью восстановлен до воды:[4]
- ЧАС2О2 + е− → HO− + •ОЙ
- 2 ч+ + 2 е− + H2О2 → 2 H2О
В биологическом контексте АФК образуются как естественный побочный продукт нормального аэробного метаболизма кислород и играть важную роль в клеточная сигнализация и гомеостаз.[5][6] АФК являются неотъемлемой частью клеточного функционирования и присутствуют на низких и стационарных уровнях в нормальных клетках. В овощах АФК участвуют в метаболических процессах, связанных с фотозащитой и толерантностью к различным типам стресса.[7] Однако АФК могут вызвать необратимое повреждение ДНК, поскольку они окисляют и модифицируют некоторые клеточные компоненты и мешают им выполнять свои первоначальные функции. Это говорит о том, что АФК играют двойную роль: будут ли они действовать как вредные, защитные или сигнальные факторы, зависит от баланса между производством АФК и их удалением в нужное время и в нужном месте.[8] Другими словами, кислородное отравление может возникать как из-за неконтролируемого производства, так и из-за неэффективного удаления АФК антиоксидантной системой во время стресса окружающей среды (например, УФ или тепловое воздействие), уровни ROS могут резко возрасти.[5] Это может привести к значительному повреждению клеточных структур. В совокупности это известно как окислительный стресс. На производство АФК сильно влияет реакция растений на стрессовые факторы, эти факторы, которые увеличивают производство АФК, включают засуху, засоление, охлаждение, защиту от патогенов, дефицит питательных веществ, токсичность металлов и УФ-В радиация. АФК также генерируются экзогенными источниками, такими как ионизирующее излучение [9] вызывает необратимые эффекты в развитии тканей как у животных, так и у растений.[10]
Источники производства АФК

Эндогенные источники
АФК образуются в результате биохимических реакций, которые происходят во время процессов дыхания и фотосинтеза в органеллах, таких как митохондрии, пероксисомы и хлоропласты.[11][12][13][14] В процессе дыхания митохондрии преобразовывают энергию клетки в пригодную для использования форму, аденозинтрифосфат (АТФ). Процесс производства АТФ в митохондриях, называемый окислительного фосфорилирования, предполагает транспортировку протоны (ионы водорода) через внутреннюю митохондриальную мембрану посредством электронная транспортная цепь. В цепи переноса электронов электроны проходят через серию белки через окислительно-восстановительные реакции с каждым акцептором белок вдоль цепочки, имеющей больший потенциал сокращения, чем предыдущая. Последним местом назначения электрона в этой цепочке является молекула кислорода. В нормальных условиях кислород восстанавливается с образованием воды; однако примерно в 0,1–2% электронов, проходящих через цепь (это число получено из исследований в изолированных митохондриях, хотя точная скорость в живых организмах еще не согласована полностью), кислород вместо этого преждевременно и не полностью восстанавливается, чтобы дать супероксидный радикал (•О−
2), наиболее хорошо документированный для Комплекс I и Комплекс III.[15]
Еще одним источником продукции АФК в клетках животных являются реакции переноса электронов, катализируемые митохондриальной P450 системы в стероидогенный ткани.[16]Эти системы P450 зависят от передачи электронов от НАДФН к P450. Во время этого процесса некоторые электроны «утекают» и реагируют с O2 производит супероксид. Чтобы справиться с этим естественным источником ROS, стероидогенные ткани, яичники и яички имеют большую концентрацию антиоксиданты такие как витамин C (аскорбат) и β-каротин и антиоксидантные ферменты.[17]
Если в митохондриях присутствует слишком много повреждений, клетка подвергается апоптоз или запрограммированная гибель клеток.[18][19]
Кроме того, ROS продуцируются в передаче сигналов иммунными клетками через NOX путь. Фагоцитарные клетки, такие как нейтрофилы, эозинофилы, и одноядерный фагоциты производить ROS при стимуляции.[20]
В хлоропласты, то карбоксилирование и реакции оксигенации, катализируемые Рубиско гарантировать, что функционирование цепи переноса электронов (ETC) происходит в среде, богатой O2. Утечка электронов в ETC неизбежно приведет к образованию ROS в хлоропластах.[21]До недавнего времени считалось, что ETC в фотосистеме I (PSI) является единственным источником ROS в хлоропластах. Согласно Huang et al.[22] поток электронов от возбужденных реакционных центров направлен к НАДФ и они уменьшаются до НАДФН, а затем попадают в Цикл Кальвина и уменьшить конечный акцептор электронов CO2. В случаях, когда есть перегрузка ETC, часть электронного потока отводится от ферредоксин тоже2, образуя свободный радикал супероксида ( Реакция Мелера ). Кроме того, утечка электронов на O2 также может происходить из кластеров 2Fe-2S и 4Fe-4S в PSI ETC. Однако PSII также предоставляет места утечки электронов (QA, QB) для O2-производство O2-.[23][24]Последние данные показывают, что O2- генерируется из PSII, а не из PSI; QB показан как место для генерации O2•-.[25]
Экзогенные источники
Формирование АФК может быть стимулировано различными агентами, такими как загрязняющие вещества, тяжелые металлы,[2] табак, дым, наркотики, ксенобиотики, или радиация. У растений, помимо действия сухих абиотические факторы, высокая температура, взаимодействие с другими живыми существами могут влиять на производство АФК.
Ионизирующее излучение может генерировать вредные промежуточные соединения при взаимодействии с водой, этот процесс называется радиолиз. Поскольку вода составляет 55–60% человеческого тела, вероятность радиолиза в присутствии ионизирующего излучения достаточно высока. При этом вода теряет электрон и становится очень реактивной. Затем посредством трехступенчатой цепной реакции вода последовательно превращается в гидроксильный радикал (•ОЙ), пероксид водорода (ЧАС2О2), супероксидный радикал (•О−
2), и в конечном итоге кислород (O2).
В гидроксильный радикал чрезвычайно реактивен и немедленно удаляет электроны из любой молекулы на своем пути, превращая эту молекулу в свободный радикал и тем самым распространяя цепную реакцию. Однако, пероксид водорода на самом деле более разрушительно для ДНК, чем гидроксильный радикал, поскольку более низкая реакционная способность перекиси водорода дает молекуле достаточно времени, чтобы проникнуть в ядро клетки, а затем вступить в реакцию с макромолекулами, такими как ДНК.[нужна цитата ]
У растений производство АФК происходит во время абиотического стресса, который приводит к снижению или прерыванию метаболической активности. Например, повышение температуры, засуха - факторы, ограничивающие доступность CO.2 из-за устьичный закрытие, увеличивая производство ROS, таких как O2·- и 1О2 в хлоропластах. [26] [27] Производство 1О2 в хлоропластах может вызывать перепрограммирование экспрессии ядерных генов, приводящее к хлороз и запрограммированная гибель клеток.[28]В случае биотического стресса генерация АФК сначала происходит быстро и слабо, а затем становится более прочной и продолжительной.[29] Первая фаза накопления АФК связана с инфицированием растений и, вероятно, не зависит от синтеза новых генерирующих АФК. ферменты. Однако вторая фаза накопления АФК связана только с инфицированием невирулентными патогенами и представляет собой индуцированный ответ, зависящий от увеличения мРНК ферменты, кодирующие транскрипцию.
Антиоксидантные ферменты
Супероксиддисмутаза
Супероксиддисмутазы (SOD) - это класс ферментов, катализирующих дисмутацию супероксида в кислород и перекись водорода. Таким образом, они являются важным антиоксидант защита почти всех клеток, подвергающихся воздействию кислорода. У млекопитающих и большинства хордовых присутствуют три формы супероксиддисмутазы. SOD1 располагается в основном в цитоплазме, SOD2 - в митохондриях, а SOD3 - внеклеточный. Первый - димер (состоит из двух звеньев), остальные - тетрамеры (четыре субъединицы). SOD1 и SOD3 содержат ионы меди и цинка, а SOD2 имеет ион марганца в своем реактивном центре. Гены расположены на 21, 6 и 4 хромосомах соответственно (21q22.1, 6q25.3 и 4p15.3-p15.1).
Катализируемый SOD дисмутация из супероксид можно записать со следующими полуреакциями:
- M(п+1)+ - СОД + О−
2 → Mп+ - СОД + О2 - Mп+ - СОД + О−
2 + 2H+ → M(п+1)+ - SOD + H2О2.
где M =Cu (п = 1); Mn (п = 2); Fe (п = 2); Ni (п = 2). В этой реакции степень окисления катиона металла колеблется между п и п + 1.
Каталаза, который сосредоточен в пероксисомы расположенный рядом с митохондриями, реагирует с перекисью водорода, катализируя образование воды и кислорода. Глутатион пероксидаза восстанавливает перекись водорода, передавая энергию реактивных перекисей очень маленькому серосодержащему белку, называемому глутатион. Сера, содержащаяся в этих ферментах, действует как реактивный центр, перенося реактивные электроны от пероксида к глутатиону. Пероксиредоксины также ухудшить H2О2внутри митохондрий, цитозоля и ядра.
- 2 ч2О2 → 2 H2О + О2 (каталаза)
- 2GSH + H2О2 → GS – SG + 2H2О (глутатионпероксидаза)
Синглетный кислород
Другой тип активных форм кислорода - это синглетный кислород (1О2), который образуется, например, как побочный продукт фотосинтез в растениях. В присутствии света и кислорода, фотосенсибилизаторы такие как хлорофилл может преобразовать триплет (3О2) в синглетный кислород:[30]
Синглетный кислород очень реактивен, особенно с органическими соединениями, содержащими двойные связи. В результате повреждения, вызванные синглетным кислородом, снижают фотосинтетическую эффективность хлоропласты. У растений, подверженных избыточному свету, повышенное производство синглетного кислорода может привести к гибели клеток.[30] Различные вещества, такие как каротиноиды, токоферолы и пластохиноны Содержащиеся в хлоропластах гасят синглетный кислород и защищают от его токсического действия. В дополнение к прямой токсичности синглетный кислород действует сигнализация молекула.[30] Окисленные продукты β-каротин возникающие из-за присутствия синглетного кислорода, действуют как вторые мессенджеры которые могут либо защитить от токсичности, вызванной синглетным кислородом, либо инициировать запрограммированную гибель клеток. Уровни жасмонат играют ключевую роль в принятии решения между акклиматизацией клеток или их гибелью в ответ на повышенные уровни этих активных форм кислорода.[30]
Повреждающие эффекты
Влияние АФК на клеточный метаболизм хорошо задокументировано у множества видов.[2] К ним относятся не только роли в апоптоз (запрограммированная гибель клеток), но также и положительные эффекты, такие как индукция защиты хозяина[31][32]гены и мобилизация ионно-транспортных систем.[нужна цитата ] Это подразумевает, что они контролируют клеточную функцию. Особенно, тромбоциты участвует в рана ремонт и кровь гомеостаз высвобождают АФК для набора дополнительных тромбоцитов на сайты травма, повреждение. Они также предоставляют ссылку на адаптивный иммунная система через набор лейкоциты.[нужна цитата ]
Активные формы кислорода участвуют в клеточной активности различных воспалительных реакций, включая сердечно-сосудистые заболевания. Они также могут быть вовлечены в нарушение слуха через кохлеарный ущерб, вызванный повышенный уровень звука, при ототоксичности таких препаратов, как цисплатин и при врожденной глухоте как у животных, так и у людей.[нужна цитата ] АФК также участвуют в посредничестве апоптоз или запрограммированной гибели клеток и ишемический травма, повреждение. Конкретные примеры включают Инсульт и острое сердечно-сосудистое заболевание.[нужна цитата ]
В целом, вредное воздействие активных форм кислорода на клетку чаще всего:[33]
- повреждение ДНК или РНК
- окисления полиненасыщенных жирных кислот в липидах (перекисное окисление липидов )
- окисление аминокислот в белках
- окислительная дезактивация определенных ферментов путем окисления кофакторов
Патогенетический ответ
Когда растение распознает атакующий патоген, одна из первых индуцированных реакций - быстрое производство супероксид (О−
2) или пероксид водорода (ЧАС
2О
2) для укрепления клеточной стенки. Это предотвращает распространение патогена на другие части растения, по существу образуя сеть вокруг патогена, ограничивающую движение и размножение.
У млекопитающего-хозяина ROS индуцируется как противомикробная защита. Чтобы подчеркнуть важность этой защиты, люди с хронической гранулематозной болезнью, у которых наблюдается дефицит в выработке АФК, очень восприимчивы к инфекции широким спектром микробов, включая Salmonella enterica, Золотистый стафилококк, Serratia marcescens, и Аспергиллы виды
Исследования по гомеостаз кишечника Drosophila melanogaster показали, что продукция АФК является ключевым компонентом иммунного ответа в кишечнике мухи. АФК действует как бактерицид, повреждая бактериальную ДНК, РНК и белки, а также как сигнальную молекулу, которая вызывает механизмы восстановления эпителий.[34] В урацил Высвобождаемый микроорганизмом, запускает производство и активность Duox, фермента, продуцирующего АФК, в кишечнике. Активность Duox индуцируется в зависимости от уровня урацила в кишечнике; в базовых условиях он подавляется протеинкиназой MkP3. Жесткое регулирование Duox позволяет избежать чрезмерного производства АФК и способствует различению доброкачественных и вызывающих повреждения микроорганизмов в кишечнике.[35]
Точный способ, которым ROS защищает хозяина от вторжения микробов, полностью не изучен. Один из наиболее вероятных способов защиты - это повреждение микробной ДНК. Исследования с использованием сальмонеллы показали, что механизмы репарации ДНК необходимы для сопротивления уничтожению с помощью ROS. Совсем недавно роль ROS в механизмах противовирусной защиты была продемонстрирована с помощью Rig-подобной геликазы-1 и митохондриального антивирусного сигнального белка. Повышенные уровни АФК усиливают передачу сигналов через этот ассоциированный с митохондриями противовирусный рецептор для активации фактора регуляции интерферона (IRF) -3, IRF-7 и ядерного фактора каппа B (NF-κB), что приводит к антивирусному состоянию.[36] Недавно было продемонстрировано, что клетки респираторного эпителия индуцируют митрохондриальные АФК в ответ на инфекцию гриппа. Эта индукция ROS привела к индукции интерферона типа III и индукции противовирусного состояния, ограничивающего репликацию вируса.[37] В защите хозяина от микобактерий определенную роль играют АФК, хотя прямое уничтожение, вероятно, не является ключевым механизмом; скорее, ROS, вероятно, влияют на ROS-зависимые регуляторы передачи сигналов, такие как продукция цитокинов, аутофагия и образование гранулем.[38]
Активные формы кислорода также участвуют в активации, анергия и апоптоз Т-клетки.[39]
Окислительное повреждение
В аэробные организмы энергия, необходимая для подпитки биологических функций, производится в митохондрии через электронная транспортная цепь. Помимо энергии, активные формы кислорода (АФК) могут вызывать Сотовая связь повреждения производятся. АФК могут повредить липиды, ДНК, РНК, и белки, которые, теоретически, способствуют физиология из старение.
АФК производятся как обычный продукт клеточный метаболизм. В частности, одним из основных факторов окислительного повреждения является пероксид водорода (ЧАС2О2), который конвертируется из супероксид что утекает из митохондрий. Каталаза и супероксиддисмутаза уменьшают разрушительное действие перекиси водорода и супероксида соответственно, превращая эти соединения в кислород и пероксид водорода (который позже превращается в воду), в результате чего образуется доброкачественный молекулы. Однако это преобразование не является эффективным на 100%, и остаточные пероксиды остаются в клетке. Хотя АФК производятся как продукт нормального функционирования клеток, чрезмерное их количество может вызывать пагубные последствия.[40]
Нарушение когнитивной функции
Возможности памяти ухудшаются с возрастом, что очевидно при дегенеративных заболеваниях человека, таких как Болезнь Альцгеймера, что сопровождается накоплением окислительного повреждения. Текущие исследования показывают, что накопление АФК может снизить фитнес потому что окислительное повреждение способствует старению. В частности, накопление окислительного повреждения может привести к когнитивной дисфункции, как показано в исследовании, в котором старым крысам давали митохондриальные метаболиты а затем дал когнитивные тесты. Результаты показали, что крысы работает лучше после приема метаболитов, что позволяет предположить, что метаболиты уменьшают окислительное повреждение и улучшают функцию митохондрий.[41] Накопление окислительного повреждения может затем повлиять на эффективность митохондрий и еще больше увеличить скорость производства АФК.[42] Накопление окислительного повреждения и его последствия для старения зависят от конкретного ткань тип, в котором происходит повреждение. Дополнительные экспериментальные результаты предполагают, что окислительное повреждение отвечает за возрастное снижение мозг функционирует. Старший песчанки было обнаружено, что уровень окисленного белка выше, чем у более молодых песчанок. Лечение старых и молодых мышей с спиновая ловушка соединение вызывало снижение уровня окисленных белков у более старых песчанок, но не влияло на более молодых песчанок. Кроме того, более старые песчанки лучше справлялись с когнитивными задачами во время лечения, но теряли функциональную способность, когда лечение было прекращено, что приводило к повышению уровня окисленного белка. Это привело исследователей к выводу, что окисление клеточных белков потенциально важно для работы мозга.[43]
Причина старения
Согласно свободнорадикальная теория старения окислительное повреждение, инициированное активными формами кислорода, является основным фактором функционального снижения, характерного для старения. В то время как исследования на моделях беспозвоночных показывают, что животные, генетически модифицированные с отсутствием специфических антиоксидантных ферментов (таких как SOD), в целом демонстрируют сокращенную продолжительность жизни (как и следовало ожидать из теории), обратная манипуляция, увеличивающая уровни антиоксидантных ферментов, имеет дали противоречивое влияние на продолжительность жизни (хотя некоторые исследования в Дрозофила действительно показывают, что продолжительность жизни может быть увеличена за счет сверхэкспрессии MnSOD или ферментов, биосинтезирующих глутатион). Также вопреки этой теории делеция митохондриальной SOD2 может увеличить продолжительность жизни в Caenorhabditis elegans.[44]
С мышами история в чем-то похожа. Удаление антиоксидантных ферментов, как правило, приводит к сокращению продолжительности жизни, хотя исследования сверхэкспрессии (за некоторыми недавними исключениями) не привели к последовательному увеличению продолжительности жизни.[45] Изучение модели недоношенных крыс старение найдено увеличенное окислительный стресс, уменьшено антиоксидант ферментативная активность и значительно больше Повреждение ДНК в мозгу неокортекс и гиппокамп у недоношенных крыс, чем у нормально стареющих контрольных крыс.[46] Повреждение ДНК 8-OHdG является продуктом взаимодействия АФК с ДНК. Многочисленные исследования показали, что 8-OHdG увеличивается с возрастом в различных органах млекопитающих[47] (увидеть Теория повреждений ДНК старения ).
Мужское бесплодие
Контакт с сперматозоиды окислительному стрессу является основным возбудителем мужское бесплодие.[48] Сперма Фрагментация ДНК, вызванный окислительным стрессом, по-видимому, является важным фактором в этиологии мужского бесплодия.[49] Высокий уровень окислительного повреждения ДНК 8-OHdG связано с аномальными сперматозоидами и мужским бесплодием.[50]
Рак
АФК постоянно генерируются и удаляются в биологической системе и необходимы для управления регуляторными путями.[51] В нормальных физиологических условиях клетки контролируют уровни АФК, уравновешивая образование АФК с их удалением системами очистки. Но в условиях окислительного стресса чрезмерное количество АФК может повредить клеточные белки, липиды и ДНК, что приведет к фатальным повреждениям в клетке, которые способствуют канцерогенезу.
Раковые клетки демонстрируют больший стресс для АФК, чем нормальные клетки, частично из-за онкогенной стимуляции, повышенной метаболической активности и митохондриальной недостаточности. ROS - палка о двух концах. С одной стороны, при низких уровнях АФК способствует выживанию раковых клеток, поскольку прогрессирование клеточного цикла, управляемое факторами роста и рецепторными тирозинкиназами (RTK), требует АФК для активации.[52] а хроническое воспаление, главный медиатор рака, регулируется АФК. С другой стороны, высокий уровень АФК может подавлять рост опухоли за счет длительной активации ингибитора клеточного цикла.[53][54] и индукция гибели клеток, а также старения за счет повреждения макромолекул. Фактически, большинство химиотерапевтических и радиотерапевтических агентов убивают раковые клетки, усиливая стресс от АФК.[55][56] Способность раковых клеток различать АФК как сигнал выживания или апоптоза контролируется дозировкой, продолжительностью, типом и местом производства АФК. Для выживания раковых клеток требуются умеренные уровни АФК, тогда как чрезмерные уровни убивают их.
Метаболическая адаптация в опухолях уравновешивает потребность клеток в энергии с не менее важной потребностью в макромолекулярных строительных блоках и более жестком контроле окислительно-восстановительного баланса. В результате производство НАДФН значительно усилен, который действует как кофактор, обеспечивая снижающую силу во многих ферментативных реакциях биосинтеза макромолекул и в то же время спасая клетки от избыточных АФК, образующихся во время быстрой пролиферации. Клетки уравновешивают пагубные эффекты ROS, производя антиоксидантные молекулы, такие как восстановленный глутатион (GSH) и тиоредоксин (TRX), которые для поддержания своей активности полагаются на восстанавливающую способность НАДФН.[57]
Большинство факторов риска, связанных с раком, взаимодействуют с клетками через образование АФК. Затем ROS активируют различные факторы транскрипции, такие как ядерный фактор, каппа-легкая цепь-энхансер активированных В-клеток (NF-κB), активаторный белок-1 (AP-1), индуцируемый гипоксией фактор-1α, а также преобразователь сигнала и активатор транскрипции. 3 (STAT3), что приводит к экспрессии белков, контролирующих воспаление; клеточная трансформация; выживаемость опухолевых клеток; пролиферация опухолевых клеток; и инвазия, агиогенез, а также метастазирование. АФК также контролируют экспрессию различных генов-супрессоров опухолей, таких как р53, ген ретинобластомы (Rb) и гомолог фосфатазы и тензина (PTEN).[58]
Канцерогенез
Окисление ДНК, связанное с АФК, является одной из основных причин мутаций, которые могут вызывать несколько типов повреждений ДНК, в том числе не объемные (8-оксогуанин и формамидопиримидин) и объемные (циклопурин и этеноаддукты) модификации оснований, базовые сайты, не - обычные одноцепочечные разрывы, аддукты белок-ДНК и внутри- и межцепочечные сшивки ДНК.[59] Было подсчитано, что эндогенные АФК, продуцируемые в результате нормального клеточного метаболизма, модифицируют приблизительно 20 000 оснований ДНК в день в одной клетке. 8-оксогуанин является наиболее распространенным среди различных наблюдаемых окисленных азотистых оснований. Во время репликации ДНК ДНК-полимераза неправильно спаривает 8-оксогуанин с аденином, что приводит к трансверсионной мутации G → T. Возникающая в результате геномная нестабильность напрямую способствует канцерогенезу. Клеточная трансформация приводит к раку, а взаимодействие атипичной изоформы PKC-ζ с p47phox контролирует продукцию ROS и трансформацию апоптотических стволовых клеток рака через программа экстренной помощи blebbishield,.[60][61]
Распространение клеток
Неконтролируемое распространение - отличительный признак раковых клеток. Было показано, что как экзогенные, так и эндогенные АФК усиливают пролиферацию раковых клеток. Роль АФК в стимулировании пролиферации опухолей дополнительно подтверждается наблюдением, что агенты с потенциалом ингибировать образование АФК могут также ингибировать пролиферацию раковых клеток.[58] Хотя АФК могут способствовать пролиферации опухолевых клеток, значительное увеличение АФК было связано со снижением пролиферации раковых клеток за счет индукции остановки клеточного цикла G2 / M; повышенное фосфорилирование атаксия, телеангиэктазия, мутировавшая (ATM), киназа контрольной точки 1 (Chk 1), Chk 2; и сокращенный цикл клеточного деления 25-го гомолога c (CDC25).[62]
Смерть клетки
Раковая клетка может умереть тремя способами: апоптоз, некроз, и аутофагия. Избыточные АФК могут вызывать апоптоз как по внешним, так и по внутренним путям.[63] На внешнем пути апоптоза АФК генерируются лигандом Fas в качестве предшествующего события для активации Fas посредством фосфорилирования, которое необходимо для последующего привлечения Fas-ассоциированного белка с доменом смерти и каспазой 8, а также для индукции апоптоза.[58] Во внутреннем пути АФК способствуют высвобождению цитохрома c за счет активации белков, стабилизирующих поры (Bcl-2 и Bcl-xL), а также ингибирования белков, дестабилизирующих поры (Bcl-2-связанный X-белок, гомологичный антагонист Bcl-2 / убийца).[64] Внутренний путь, также известный как каспазный каскад, индуцируется повреждением митохондрий, которое запускает высвобождение цитохрома c. Повреждение ДНК, окислительный стресс и потеря потенциала митохондриальной мембраны приводят к высвобождению проапоптотических белков, упомянутых выше, стимулирующих апоптоз.[65] Повреждение митохондрий тесно связано с апоптозом, и, поскольку митохондрии легко поражаются, существует потенциал для лечения рака.[66]
Цитотоксическая природа АФК является движущей силой апоптоза, но даже в более высоких количествах АФК может приводить как к апоптозу, так и к некрозу, форме неконтролируемой гибели раковых клеток.[67]
Многочисленные исследования показали пути и связи между уровнями ROS и апоптозом, но новое направление исследований связывает уровни ROS и аутофагию.[68] АФК могут также вызывать гибель клеток посредством аутофагии, которая представляет собой самокатаболический процесс, включающий секвестрацию цитоплазматического содержимого (истощенных или поврежденных органелл и белковых агрегатов) для деградации в лизосомах.[69] Следовательно, аутофагия также может регулировать здоровье клетки во время окислительного стресса. Аутофагия может быть вызвана уровнями АФК множеством различных путей в клетке в попытке избавиться от вредных органелл и предотвратить повреждение, такое как канцерогены, без индукции апоптоза.[70] Аутофагическая гибель клеток может быть вызвана чрезмерной экспрессией аутофагии, когда клетка переваривает слишком много самой себя в попытке минимизировать ущерб и больше не может выжить. Когда происходит этот тип гибели клеток, обычно наблюдается усиление или потеря контроля над генами, регулирующими аутофагию.[71] Таким образом, как только будет достигнуто более глубокое понимание аутофагической гибели клеток и ее связи с АФК, эта форма запрограммированной гибели клеток может служить в качестве будущей терапии рака. Аутофагия и апоптоз - это два разных механизма гибели клеток, вызванные высокими уровнями АФК в клетках, однако; аутофагия и апоптоз редко действуют строго независимыми путями. Существует четкая связь между АФК и аутофагией и корреляция между чрезмерным количеством АФК, приводящим к апоптозу.[70] Деполяризация митохондриальной мембраны также характерна для инициации аутофагии. Когда митохондрии повреждаются и начинают выделять АФК, инициируется аутофагия, чтобы избавиться от повреждающей органеллы. Если лекарство нацелено на митохондрии и создает АФК, аутофагия может избавиться от такого количества митохондрий и других поврежденных органелл, что клетка больше не жизнеспособна. Большое количество АФК и повреждение митохондрий также могут сигнализировать об апоптозе. Баланс аутофагии в клетке и взаимодействие между аутофагией и апоптозом, опосредованным АФК, имеет решающее значение для выживания клетки. Эти перекрестные помехи и связь между аутофагией и апоптозом могут быть механизмом, нацеленным на лечение рака или используемым в комбинированной терапии высокорезистентных видов рака.
Инвазия опухолевых клеток, ангиогенез и метастазирование
После стимуляции RTK факторами роста ROS могут запускать активацию сигнальных путей, участвующих в миграции и инвазии клеток, таких как члены семейства митоген-активированных протеинкиназ (MAPK) - внеклеточная регулируемая киназа (ERK), c-jun NH-2 -концевая киназа ( JNK) и p38 MAPK. АФК могут также способствовать миграции путем увеличения фосфорилирования киназы фокальной адгезии (FAK) p130Cas и паксилина.[72]
Как in vitro, так и in vivo, ROS, как было показано, индуцируют факторы транскрипции и модулируют сигнальные молекулы, участвующие в ангиогенезе (MMP, VEGF) и метастазировании (повышающая регуляция AP-1, CXCR4, AKT и понижающая регуляция PTEN).[58]
Хроническое воспаление и рак
Экспериментальные и эпидемиологические исследования последних нескольких лет показали тесную связь между АФК, хроническим воспалением и раком.[58] АФК вызывает хроническое воспаление за счет индукции ЦОГ-2, воспалительных цитокинов (TNFα, интерлейкин 1 (IL-1), IL-6), хемокинов (IL-8, CXCR4) и провоспалительных факторов транскрипции (NF-κB).[58] Эти хемокины и хемокиновые рецепторы, в свою очередь, способствуют инвазии и метастазированию различных типов опухолей.
Лечение рака
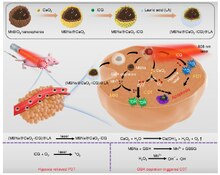
Были разработаны стратегии повышения и устранения ROS, причем преимущественно использовались первые. Раковые клетки с повышенным уровнем АФК сильно зависят от системы антиоксидантной защиты. Лекарства, повышающие содержание АФК, дополнительно увеличивают уровень клеточного стресса АФК либо путем прямого образования АФК (например, мотексафин гадолиний, элескломол), либо с помощью агентов, которые отменяют присущую ему антиоксидантную систему, такую как ингибитор SOD (например, ATN-224, 2-метоксиэстрадиол) и ингибитор GSH. (например, PEITC, бутионин сульфоксимин (BSO)). Результатом является общее увеличение эндогенных АФК, которые при превышении порога клеточной переносимости могут вызвать гибель клеток.[73] С другой стороны, нормальные клетки при более низком базальном стрессе и резерве, по-видимому, обладают большей способностью справляться с дополнительными воздействиями, генерирующими АФК, чем раковые клетки.[74] Следовательно, повышение ROS во всех клетках можно использовать для достижения селективного уничтожения раковых клеток.
Радиотерапия также основана на токсичности АФК для уничтожения опухолевых клеток. В лучевой терапии используются рентгеновские лучи, γ-лучи, а также излучение тяжелых частиц, таких как протоны и нейтроны, чтобы вызвать опосредованную ROS гибель клеток и митотический сбой.[58]
Благодаря двойной роли ROS были разработаны противораковые агенты на основе прооксидантов и антиоксидантов. Однако модуляция передачи сигналов АФК сама по себе не кажется идеальным подходом из-за адаптации раковых клеток к стрессу АФК, избыточных путей для поддержки роста рака и токсичности противораковых препаратов, генерирующих АФК. Комбинации препаратов, генерирующих АФК, с фармацевтическими препаратами, которые могут нарушить окислительно-восстановительную адаптацию, могут быть лучшей стратегией для повышения цитотоксичности раковых клеток.[58]
Джеймс Уотсон[75] и другие[76] предположили, что недостаток внутриклеточных АФК из-за недостатка физических упражнений может способствовать злокачественному прогрессированию рака, потому что для правильного сворачивания белков в эндоплазматическом ретикулуме необходимы пики АФК, а низкие уровни АФК могут, таким образом, специфически препятствовать образованию опухолевого супрессора. белки.[76] Поскольку физические упражнения вызывают временные всплески АФК, это может объяснить, почему физические упражнения полезны для прогноза больных раком.[77] Более того, высокие индукторы ROS, такие как 2-дезокси-D-глюкоза, и индукторы клеточного стресса на основе углеводов более эффективно вызывают гибель раковых клеток, поскольку они используют высокую авидность раковых клеток к сахару.[78]
Положительная роль АФК в памяти


Два отзыва[81][82] суммировать большое количество данных, полученных в основном в период с 1996 по 2011 гг., о критической и существенной роли ROS в объем памяти формирование. Недавние дополнительные данные показывают, что как формирование, так и хранение памяти зависят от эпигенетический модификации в нейронах, включая изменения в нейронах Метилирование ДНК.[83][84] Два блока информации о формировании памяти, по-видимому, были связаны в 2016 году благодаря работе Zhou et al.,[79] кто показал, что АФК играют центральную роль в эпигенетических Деметилирование ДНК.
В ядерной ДНК млекопитающих метильная группа может быть добавлена посредством ДНК-метилтрансфераза к 5-му атому углерода цитозина с образованием 5mC (см. красную метильную группу, добавленную с образованием 5mC в верхней части первого рисунка). ДНК-метилтрансферазы чаще всего образуют 5mC в динуклеотидной последовательности «цитозин-фосфат-гуанин» с образованием 5mCpG. Это дополнение является основным типом эпигенетических изменений и может молчание экспрессии гена. Метилированный цитозин также может быть деметилированный, эпигенетическое изменение, которое может увеличить экспрессию гена. Главный фермент, участвующий в деметилировании 5mCpG, - это TET1. Однако TET1 может воздействовать на 5mCpG только в том случае, если ROS сначала воздействовала на гуанин с образованием 8-гидрокси-2'-дезоксигуанозин (8-OHdG), что приводит к динуклеотиду 5mCp-8-OHdG (см. Первый рисунок).[79] Однако TET1 может действовать только на 5mC часть динуклеотида, когда базовая эксцизионная пластика фермент OGG1 связывается с поражением 8-OHdG без немедленного удаления. Приверженность OGG1 к сайту 5mCp-8-OHdG рекрутирует TET1 и TET1 затем окисляет 5mC, соседний с 8-OHdG, как показано на первом рисунке, инициируя путь деметилирования, показанный на втором рисунке.
В 2016 году Halder et al.[85] с использованием мышей, а в 2017 году Duke et al.[86] используя крыс, подвергали грызунов контекстуальному условный страх, вызывая особенно сильный Долгосрочная память формировать. Через 24 часа после кондиционирования в гиппокамп у крыс экспрессия 1048 генов подавлялась (обычно ассоциировалась с гиперметилированный промоторы генов ), а экспрессия 564 генов была повышена (часто связана с гипометилированными промоторами генов). Через 24 часа после тренировки 9,2% генов крысиного генома гиппокамп нейроны были дифференцированно метилированы. Однако, хотя гиппокамп важен для изучения новой информации, он не хранит информацию сам по себе. В экспериментах на мышах Гальдера 1206 дифференциально метилированных генов были обнаружены в гиппокампе через час после контекстуальной обусловленности страхом, но они были обращены вспять и не наблюдались через четыре недели. В отличие от отсутствия долгосрочных изменений метилирования в гиппокампе, существенное дифференциальное метилирование может быть обнаружено в корковый нейроны во время поддержания памяти. Через четыре недели после контекстуального кондиционирования страха в передней поясной коре мышей обнаружено 1223 дифференциально метилированных гена.
Тысячи сайтов CpG, деметилируемых во время формирования памяти, зависят от ROS на начальном этапе. Измененная экспрессия белка в нейронах, частично контролируемая ROS-зависимым деметилированием сайтов CpG в промоторах генов в ДНК нейрона, играет центральную роль в формировании памяти.[87]
Смотрите также
- Антиоксидантное действие полифенолов и природных фенолов
- Йодид
- Меланин
- Митохормезис
- Окислительный стресс
- Кислородная токсичность
- Прооксидант
- Активные формы азота
- Активные формы серы
- Реактивные карбонильные соединения
- Производство активных форм кислорода в морских микроводорослях
использованная литература
- ^ Ново Э, Парола М (октябрь 2008 г.). «Редокс-механизмы в печеночном заживлении хронических ран и фиброгенезе». Фиброгенез и восстановление тканей. 1 (1): 5. Дои:10.1186/1755-1536-1-5. ЧВК 2584013. PMID 19014652.
- ^ а б c Начиаппан, Васанти; Мутукумар, Каннан (декабрь 2010 г.). «Вызванный кадмием окислительный стресс у Saccharomyces cerevisiae». Индийский журнал биохимии и биофизики. 47 (6): 383–7. ISSN 0975-0959. PMID 21355423.
- ^ Хайян М., Хашим М.А., АльНашеф И.М. (март 2016 г.). «Ион супероксида: образование и химические последствия». Химические обзоры. 116 (5): 3029–85. Дои:10.1021 / acs.chemrev.5b00407. PMID 26875845.
- ^ а б c Turrens JF (октябрь 2003 г.). «Митохондриальное образование активных форм кислорода». Журнал физиологии. 552 (Чт 2): 335–44. Дои:10.1113 / jphysiol.2003.049478. ЧВК 2343396. PMID 14561818.
- ^ а б Девасагаям Т.П., Тилак Дж.С., Болур К.К., Сане К.С., Гаскадби С.С., Леле Р.Д. (октябрь 2004 г.). «Свободные радикалы и антиоксиданты в здоровье человека: текущее состояние и перспективы на будущее». Журнал Ассоциации врачей Индии. 52: 794–804. PMID 15909857.
- ^ Едрева, Аглика (2 апреля 2005 г.). «Генерация и удаление активных форм кислорода в хлоропластах: субмолекулярный подход». Сельское хозяйство, экосистемы и окружающая среда. 106 (2): 119–133. Дои:10.1016 / j.agee.2004.10.022. ISSN 0167-8809. Дата обращения 11.03.2020. Проверить значения даты в:
| дата доступа =(Помогите) - ^ Грант, Джон Дж .; Лоак, Гэри Дж. (1 сентября 2000 г.). «Роль реактивных кислородных промежуточных соединений и когнитивных сигналов окислительно-восстановительного потенциала в устойчивости к болезням». Физиология растений. 124 (1): 21–30. Дои:10.1104 / pp.124.1.21.
- ^ Едрева, Аглика (2 апреля 2005 г.). «Генерация и удаление активных форм кислорода в хлоропластах: субмолекулярный подход». Сельское хозяйство, экосистемы и окружающая среда. 106 (2): 119–133. Дои:10.1016 / j.agee.2004.10.022. ISSN 0167-8809.
- ^ Соса Торрес, ME, Сауседо-Васкес, JP, Кронек, PM (2015). "Глава 1, Раздел 3 Темная сторона двуокиси кислорода". В Kroneck PM, Torres ME (ред.). Поддержание жизни на планете Земля: металлоферменты, усваивающие кислород и другие жевательные газы. Ионы металлов в науках о жизни. 15. Springer. С. 1–12. Дои:10.1007/978-3-319-12415-5_1. PMID 25707464.
- ^ Миттлер, Рон (январь 2017 г.). "РОС хороши". Тенденции в растениеводстве. 22 (1): 11–19. Дои:10.1016 / j.tplants.2016.08.002. ISSN 1360-1385.
- ^ Едрева, Аглика (2 апреля 2005 г.). «Генерация и удаление активных форм кислорода в хлоропластах: субмолекулярный подход». Сельское хозяйство, экосистемы и окружающая среда. 106 (2): 119–133. Дои:10.1016 / j.agee.2004.10.022. ISSN 0167-8809.
- ^ http://dx.doi.org/10.14348/molcells.2016.2324. Цитировать журнал требует
| журнал =(Помогите); Отсутствует или пусто| название =(Помогите) - ^ Мюллер Ф (октябрь 2000 г.). «Природа и механизм производства супероксида в цепи переноса электронов: его значение для старения». Журнал Американской ассоциации старения. 23 (4): 227–53. Дои:10.1007 / s11357-000-0022-9. ЧВК 3455268. PMID 23604868.
- ^ Хан Д, Уильямс Э, Кадены Э (январь 2001 г.). «Митохондриальная респираторная цепь-зависимая генерация супероксид-аниона и его выброс в межмембранное пространство». Биохимический журнал. 353 (Чт 2): 411–6. Дои:10.1042/0264-6021:3530411. ЧВК 1221585. PMID 11139407.
- ^ Ли Х, Фанг П, Май Дж, Чой Э., Ван Х, Ян Х Ф (февраль 2013 г.). «Нацеленность на активные формы кислорода в митохондриях в качестве новой терапии воспалительных заболеваний и рака». Журнал гематологии и онкологии. 6 (19): 19. Дои:10.1186/1756-8722-6-19. ЧВК 3599349. PMID 23442817.
- ^ Ханукоглу И., Рапопорт Р., Вайнер Л., Склан Д. (сентябрь 1993 г.). «Утечка электронов из митохондриальной системы НАДФН-адренодоксинредуктаза-адренодоксин-P450scc (расщепление боковой цепи холестерина)». Архивы биохимии и биофизики. 305 (2): 489–98. Дои:10.1006 / abbi.1993.1452. PMID 8396893.
- ^ Ханукоглу I (2006). «Антиоксидантные защитные механизмы против активных форм кислорода (АФК), генерируемых митохондриальными системами P450 в стероидогенных клетках». Обзоры метаболизма лекарств. 38 (1–2): 171–96. Дои:10.1080/03602530600570040. PMID 16684656. S2CID 10766948.
- ^ Куртин, Джеймс Ф; Донован, Марианна; Коттер, Томас G (июль 2002 г.). «Регулирование и измерение окислительного стресса при апоптозе». Журнал иммунологических методов. 265 (1–2): 49–72. Дои:10.1016 / s0022-1759 (02) 00070-4. ISSN 0022-1759. PMID 12072178.
- ^ Альбертс, Брюс; Джонсон, Александр; Льюис, Джулиан; Морган, Дэвид; Рафф, Мартин; Робертс, Кейт; Уолтер, Питер (2014). Молекулярная биология клетки (6 изд.). Нью-Йорк: Наука Гарланд. п. 1025. ISBN 978-0-8153-4432-2.
- ^ https://www.hindawi.com/journals/omcl/2016/1580967/
- ^ Едрева, Аглика (2 апреля 2005 г.). «Генерация и удаление активных форм кислорода в хлоропластах: субмолекулярный подход». Сельское хозяйство, экосистемы и окружающая среда. 106 (2): 119–133. Дои:10.1016 / j.agee.2004.10.022. ISSN 0167-8809.
- ^ Хуанг, Хунлинь; Уллах, Фархан; Чжоу, Дао-Сю; Йи, Мин; Чжао, Ю (2019). «Механизмы АФК-регуляции развития растений и стресс-реакций». Границы растениеводства. 10. Дои:10.3389 / fpls.2019.00800. ISSN 1664-462X.
- ^ Чжан, Супин; Weng, Jun; Пан, Цзинси; Ту, Теченг; Яо, Сиде; Сюй, Чуньхэ (1 января 2003 г.). «Исследование фотогенерации супероксидных радикалов в Фотосистеме II с помощью методов захвата спина ЭПР». Фотосинтез Исследования. 75 (1): 41–48. Дои:10.1023 / А: 1022439009587. ISSN 1573-5079.
- ^ Cleland, Robyn E .; Грейс, Стивен К. (3 сентября 1999 г.). [DOI: 10.1016 / s0014-5793 (99) 01067-4. "Вольтамперометрическое определение образования супероксида фотосистемой II"] Проверьте
| url =ценность (Помогите). Письма FEBS. 457 (3): 348–352. Дои:10.1016 / S0014-5793 (99) 01067-4. - ^ Чжан, Супин; Weng, Jun; Пан, Цзинси; Ту, Теченг; Яо, Сиде; Сюй, Чуньхэ (1 января 2003 г.). «Исследование фотогенерации супероксидных радикалов в Фотосистеме II с помощью методов захвата спина ЭПР». Фотосинтез Исследования. 75 (1): 41–48. Дои:10.1023 / А: 1022439009587. ISSN 1573-5079.
- ^ Баниулис, Данас; Хасан, С. Саиф; Стофлет, Джейсон Т .; Крамер, Уильям А. (17 декабря 2013 г.). «Механизм повышенной продукции супероксида в комплексе цитохрома b6f кислородного фотосинтеза». Биохимия. 52 (50): 8975–8983. Дои:10.1021 / bi4013534. ISSN 0006-2960.
- ^ «Ретроградная сигнализация: органеллы объединяются». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1857 (8): 1313–1325. 1 августа 2016 г. Дои:10.1016 / j.bbabio.2016.03.017. ISSN 0005-2728.
- ^ «Ретроградная сигнализация: органеллы объединяются». Biochimica et Biophysica Acta (BBA) - Биоэнергетика. 1857 (8): 1313–1325. 1 августа 2016 г. Дои:10.1016 / j.bbabio.2016.03.017. ISSN 0005-2728.
- ^ Грант, Джон Дж .; Лоак, Гэри Дж. (1 сентября 2000 г.). «Роль реактивных кислородных промежуточных соединений и когнитивных сигналов окислительно-восстановительного потенциала в устойчивости к болезням». Физиология растений. 124 (1): 21–30. Дои:10.1104 / pp.124.1.21. ISSN 0032-0889.
- ^ а б c d Лалои К., Хаво М. (2015). «Ключевые участники гибели клеток растений, вызванной синглетным кислородом». Границы растениеводства. 6: 39. Дои:10.3389 / fpls.2015.00039. ЧВК 4316694. PMID 25699067.
- ^ Рада Б, Лето Т.Л. (2008). «Окислительная врожденная иммунная защита NADPH-оксидазами семейства Nox / Duox». В Egesten A, Schmidt A, Herwald H (ред.). Тенденции врожденного иммунитета. Вклад в микробиологию. 15. Базель: Каргер. С. 164–87. Дои:10.1159/000136357. ISBN 978-3-8055-8548-4. ЧВК 2776633. PMID 18511861. - Обзор
- ^ Коннер Г.Е., Салате М., Фортеза Р. (декабрь 2002 г.). «Лактопероксидаза и метаболизм перекиси водорода в дыхательных путях». Американский журнал респираторной медицины и реанимации. 166 (12, часть 2): S57-61. Дои:10.1164 / rccm.2206018. PMID 12471090.
- ^ Брукер Р.Дж. (2011). Генетика: анализ и принципы (4-е изд.). McGraw-Hill Science. ISBN 978-0-07-352528-0.
- ^ Бучон Н., Бродерик Н.А., Леметр B (сентябрь 2013 г.). «Гомеостаз кишечника в микробном мире: выводы из исследования Drosophila melanogaster». Обзоры природы. 11 (9): 615–26. Дои:10.1038 / nrmicro3074. PMID 23893105. S2CID 8129204.
- ^ Ли К.А. и др. (2013). «Урацил бактериального происхождения как модулятор иммунитета слизистых оболочек и гомеостаза кишечных микробов у дрозофилы». Ячейка. 153 (4): 797–811. Дои:10.1016 / j.cell.2013.04.009. PMID 23663779.
- ^ West AP и др., 2011 Nature Reviews Immunology 11, 389–402
- ^ Kim HJ, Kim CH, Ryu JH, Kim MJ, Park CY, Lee JM, Holtzman MJ, Yoon JH (ноябрь 2013 г.). «Реактивные формы кислорода вызывают противовирусный врожденный иммунный ответ посредством регуляции IFN-λ в эпителиальных клетках носа человека». Американский журнал респираторной клетки и молекулярной биологии. 49 (5): 855–65. Дои:10.1165 / rcmb.2013-0003OC. ЧВК 5455605. PMID 23786562.
- ^ Дефферт К., Кашат Дж., Краузе К.Х. (август 2014 г.). «НАДФН-оксидаза фагоцитов, хроническая гранулематозная болезнь и микобактериальные инфекции». Клеточная микробиология. 16 (8): 1168–78. Дои:10,1111 / см. 12322. PMID 24916152.
- ^ Беликов А.В., Шравен Б., Симеони Л. (октябрь 2015 г.). «Т-клетки и активные формы кислорода». Журнал биомедицинских наук. 22: 85. Дои:10.1186 / s12929-015-0194-3. ЧВК 4608155. PMID 26471060.
- ^ Патель Р.П., Т. Корнуэлл, Т. Дарли-Усмар, В.М. (1999). «Биохимия оксида азота и пероксинитрита: значение для митохондриальной функции». В Packer L, Cadenas E (ред.). Понимание процесса старения: роль митохондрий, свободных радикалов и антиоксидантов. Нью-Йорк, Нью-Йорк: Марсель Деккер. С. 39–56. ISBN 0-8247-1723-6.
- ^ Лю Дж., Руководитель Е., Гариб А. М., Юань В., Ингерсолл Р. Т., Хаген TM, Котман К. В., Эймс Б. Н. (февраль 2002 г.). «Потеря памяти у старых крыс связана с распадом митохондрий головного мозга и окислением РНК / ДНК: частичное обращение вспять путем кормления ацетил-L-карнитином и / или R-альфа-липоевой кислотой». Труды Национальной академии наук Соединенных Штатов Америки. 99 (4): 2356–61. Bibcode:2002PNAS ... 99.2356L. Дои:10.1073 / pnas.261709299. ЧВК 122369. PMID 11854529.
- ^ Stadtman ER (август 1992 г.). «Окисление белков и старение». Наука. 257 (5074): 1220–4. Bibcode:1992Научный ... 257.1220S. Дои:10.1126 / science.1355616. PMID 1355616.
- ^ Карни Дж. М., Старк-Рид ЧП, Оливер К. Н., Ландум Р. В., Ченг М. С., Ву Дж. Ф., Флойд Р. А. (май 1991 г.). «Обращение вспять возрастного увеличения окисления белков головного мозга, снижения активности ферментов и потери временной и пространственной памяти за счет хронического введения спин-захватывающего соединения N-трет-бутил-альфа-фенилнитрона». Труды Национальной академии наук Соединенных Штатов Америки. 88 (9): 3633–6. Bibcode:1991PNAS ... 88.3633C. Дои:10.1073 / пнас.88.9.3633. ЧВК 51506. PMID 1673789.
- ^ Ван Рамсдонк Дж. М., Хекими С. (февраль 2009 г.). «Делеция митохондриальной супероксиддисмутазы sod-2 увеличивает продолжительность жизни у Caenorhabditis elegans». PLOS Genetics. 5 (2): e1000361. Дои:10.1371 / journal.pgen.1000361. ЧВК 2628729. PMID 19197346.
- ^ Muller FL, Lustgarten MS, Jang Y, Richardson A, Van Remmen H (август 2007 г.). «Тенденции в теориях окислительного старения». Свободная радикальная биология и медицина. 43 (4): 477–503. Дои:10.1016 / j.freeradbiomed.2007.03.034. PMID 17640558.
- ^ Sinha JK, Ghosh S, Swain U, Giridharan NV, Raghunath M (июнь 2014 г.). «Повышенное повреждение макромолекул из-за окислительного стресса в неокортексе и гиппокампе WNIN / Ob, новой модели преждевременного старения на крысах». Неврология. 269: 256–64. Дои:10.1016 / j.neuroscience.2014.03.040. PMID 24709042. S2CID 9934178.
- ^ Бернштейн Х, Пейн CM, Бернштейн С, Гарвал Х, Дворак К. (2008). «Глава 1: Рак и старение как последствия неремонтированного повреждения ДНК».. В Kimura H, Suzuki A (ред.). Новое исследование повреждений ДНК. Нью-Йорк: Nova Science Publishers, Inc. С. 1–47. ISBN 978-1-60456-581-2.
 , но только для чтения.
, но только для чтения. - ^ Эйткен Р.Дж., Де Юлис Г.Н., Гибб З., Бейкер М.А. (август 2012 г.). «Лекция Симмета: новые горизонты старого ландшафта - окислительный стресс, повреждение ДНК и апоптоз в мужской зародышевой линии». Размножение домашних животных = Zuchthygiene. 47 Дополнение 4: 7–14. Дои:10.1111 / j.1439-0531.2012.02049.x. PMID 22827344.
- ^ Райт С., Милн С., Лисон Н. (июнь 2014 г.). «Повреждение ДНК сперматозоидов, вызванное окислительным стрессом: изменяемые клинические факторы, факторы образа жизни и питания при мужском бесплодии». Репродуктивная биомедицина онлайн. 28 (6): 684–703. Дои:10.1016 / j.rbmo.2014.02.004. PMID 24745838.
- ^ Guz J, Gackowski D, Foksinski M, Rozalski R, Zarakowska E, Siomek A, Szpila A, Kotzbach M, Kotzbach R, Olinski R (2013). «Сравнение окислительного стресса / повреждения ДНК в сперме и крови фертильных и бесплодных мужчин». PLOS ONE. 8 (7): e68490. Bibcode:2013PLoSO ... 868490G. Дои:10.1371 / journal.pone.0068490. ЧВК 3709910. PMID 23874641.
- ^ Дикинсон BC, Чанг CJ (июль 2011 г.). «Химия и биология активных форм кислорода в сигнальных или стрессовых реакциях». Природа Химическая Биология. 7 (8): 504–11. Дои:10.1038 / nchembio.607. ЧВК 3390228. PMID 21769097.
- ^ Ирани К., Ся Й, Цвейер Дж. Л., Соллотт С.Дж., Дер С.Дж., Ферон Э.Р., Сундаресан М., Финкель Т., Гольдшмидт-Клермон П.Дж. (март 1997 г.). «Митогенная передача сигналов, опосредованная оксидантами в Ras-трансформированных фибробластах». Наука. 275 (5306): 1649–52. Дои:10.1126 / science.275.5306.1649. PMID 9054359. S2CID 19733670.
- ^ Рэмси М.Р., Шарплес, штат Нью-Йорк (ноябрь 2006 г.). «АФК как супрессор опухолей?». Природа клеточной биологии. 8 (11): 1213–5. Дои:10.1038 / ncb1106-1213. PMID 17077852. S2CID 21104991.
- ^ Такахаши А., Отани Н., Ямакоши К., Иида С., Тахара Х, Накаяма К., Накаяма К. И., Иде Т., Сая Х., Хара Е. (ноябрь 2006 г.). «Митогенная передача сигналов и путь p16INK4a-Rb взаимодействуют для обеспечения необратимого клеточного старения». Природа клеточной биологии. 8 (11): 1291–7. Дои:10.1038 / ncb1491. PMID 17028578. S2CID 8686894.
- ^ Реншлер М.Ф. (сентябрь 2004 г.). «Возникающая роль активных форм кислорода в терапии рака». Европейский журнал рака. 40 (13): 1934–40. Дои:10.1016 / j.ejca.2004.02.031. PMID 15315800.
- ^ Толер С.М., Ноэ Д., Шарма А. (декабрь 2006 г.). «Избирательное усиление клеточного окислительного стресса хлорохином: значение для лечения мультиформной глиобластомы». Нейрохирургия. 21 (6): E10. Дои:10.3171 / foc.2006.21.6.1. PMID 17341043.
- ^ Кэрнс Р.А., Харрис И.С., Мак Т.В. (февраль 2011 г.). «Регуляция метаболизма раковых клеток». Обзоры природы. Рак. 11 (2): 85–95. Дои:10.1038 / nrc2981. PMID 21258394. S2CID 8891526.
- ^ а б c d е ж г час Gupta SC, Hevia D, Patchva S, Park B, Koh W, Aggarwal BB (июнь 2012 г.). «Преимущества и недостатки активных форм кислорода при раке: роль активных форм кислорода в онкогенезе, профилактике и терапии». Антиоксиданты и редокс-сигналы. 16 (11): 1295–322. Дои:10.1089 / ars.2011.4414. ЧВК 3324815. PMID 22117137.
- ^ Варис Г., Ахсан Х. (май 2006 г.). «Активные формы кислорода: роль в развитии рака и различных хронических состояний». Журнал канцерогенеза. 5: 14. Дои:10.1186/1477-3163-5-14. ЧВК 1479806. PMID 16689993.
- ^ Джинеш Г.Г., Таока Р., Чжан К., Горантла С., Камат А.М. (апрель 2016 г.). «Новое взаимодействие PKC-ζ с p47 phox необходимо для превращения из блеббишилдов». Научные отчеты. 6: 23965. Bibcode:2016НатСР ... 623965J. Дои:10.1038 / srep23965. ЧВК 4819220. PMID 27040869.
- ^ Джинеш GG, Камат AM. Программа экстренной помощи Блеббишилда: апоптотический путь к клеточной трансформации. Смерть клетки отличается. 2016 в прессе.
- ^ Эймс Б.Н. (сентябрь 1983 г.). «Пищевые канцерогены и антиканцерогены. Кислородные радикалы и дегенеративные заболевания». Наука. 221 (4617): 1256–64. Bibcode:1983Научный ... 221.1256A. Дои:10.1126 / science.6351251. PMID 6351251.
- ^ Озбен Т (сентябрь 2007 г.). «Окислительный стресс и апоптоз: влияние на терапию рака». Журнал фармацевтических наук. 96 (9): 2181–96. Дои:10.1002 / jps.20874. PMID 17593552.
- ^ Мартиндейл Дж. Л., Холбрук, штат Нью-Джерси (июль 2002 г.). «Клеточный ответ на окислительный стресс: сигнал к самоубийству и выживанию». Журнал клеточной физиологии. 192 (1): 1–15. Дои:10.1002 / jcp.10119. PMID 12115731.
- ^ Maiuri MC, Zalckvar E, Kimchi A, Kroemer G (сентябрь 2007 г.). «Самопоедание и самоубийство: перекрестный путь между аутофагией и апоптозом». Обзоры природы. Молекулярная клеточная биология. 8 (9): 741–52. Дои:10.1038 / nrm2239. PMID 17717517. S2CID 3912801.
- ^ Fulda S, Galluzzi L, Kroemer G (июнь 2010 г.). «Нацеливание на митохондрии для лечения рака». Обзоры природы. Открытие наркотиков. 9 (6): 447–64. Дои:10.1038 / nrd3137. PMID 20467424. S2CID 14643750.
- ^ Хэмптон МБ, Оррениус С. (сентябрь 1997 г.). «Двойная регуляция активности каспазы перекисью водорода: последствия для апоптоза». Письма FEBS. 414 (3): 552–6. Дои:10.1016 / s0014-5793 (97) 01068-5. PMID 9323034.
- ^ Гибсон SB (октябрь 2010 г.). «Вопрос баланса между жизнью и смертью: нацеливание на аутофагию, вызванную активными формами кислорода (АФК), для лечения рака». Аутофагия. 6 (7): 835–7. Дои:10.4161 / авто.6.7.13335. PMID 20818163.
- ^ Шривастава А., Кузонткоски П.М., Групман Дж. Э., Прасад А. (июль 2011 г.). «Каннабидиол вызывает запрограммированную гибель клеток в клетках рака груди, координируя перекрестные помехи между апоптозом и аутофагией». Молекулярная терапия рака. 10 (7): 1161–72. Дои:10.1158 / 1535-7163.MCT-10-1100. PMID 21566064.
- ^ а б Scherz-Shouval R, Elazar Z (сентябрь 2007 г.). «АФК, митохондрии и регуляция аутофагии». Тенденции в клеточной биологии. 17 (9): 422–7. Дои:10.1016 / j.tcb.2007.07.009. PMID 17804237.
- ^ Xie Z, Klionsky DJ (октябрь 2007 г.). «Формирование аутофагосом: основные машины и адаптации». Природа клеточной биологии. 9 (10): 1102–9. Дои:10.1038 / ncb1007-1102. PMID 17909521. S2CID 26402002.
- ^ Tochhawng L, Deng S, Pervaiz S, Yap CT (май 2013 г.). «Редокс-регуляция миграции и инвазии раковых клеток». Митохондрия. 13 (3): 246–53. Дои:10.1016 / j.mito.2012.08.002. PMID 22960576.
- ^ Schumacker PT (сентябрь 2006 г.). «Активные формы кислорода в раковых клетках: жить мечом, умереть мечом». Раковая клетка. 10 (3): 175–6. Дои:10.1016 / j.ccr.2006.08.015. PMID 16959608.
- ^ Trachootham D, Alexandre J, Huang P (июль 2009 г.). «Нацеливание на раковые клетки с помощью ROS-опосредованных механизмов: радикальный терапевтический подход?». Обзоры природы. Открытие наркотиков. 8 (7): 579–91. Дои:10.1038 / nrd2803. PMID 19478820. S2CID 20697221.
- ^ Уотсон Дж. Д. (март 2014 г.). «Диабет 2 типа как редокс-болезнь». Ланцет. 383 (9919): 841–3. Дои:10.1016 / с0140-6736 (13) 62365-х. PMID 24581668. S2CID 1076963.
- ^ а б Molenaar RJ, van Noorden CJ (сентябрь 2014 г.). «Диабет 2 типа и рак как окислительно-восстановительные заболевания?». Ланцет. 384 (9946): 853. Дои:10.1016 / с0140-6736 (14) 61485-9. PMID 25209484. S2CID 28902284.
- ^ Ирвин М.Л., Смит А.В., Мактирнан А., Баллард-Барбаш Р., Кронин К., Гиллиланд Ф. Д., Баумгартнер Р. Н., Баумгартнер КБ, Бернштейн Л. (август 2008 г.). «Влияние физической активности до и после постановки диагноза на смертность выживших после рака груди: исследование здоровья, питания, активности и образа жизни». Журнал клинической онкологии. 26 (24): 3958–64. Дои:10.1200 / jco.2007.15.9822. ЧВК 2654316. PMID 18711185.
- ^ Ндомбера FT, VanHecke GC, Nagi S, Ahn YH (март 2016 г.). «Индукторы клеточного стресса на основе углеводов для воздействия на раковые клетки». Письма по биоорганической и медицинской химии. 26 (5): 1452–6. Дои:10.1016 / j.bmcl.2016.01.063. PMID 26832785.
- ^ а б c Чжоу X, Чжуан З., Ван В., Хэ Л., Ву Х, Цао И, Пань Ф, Чжао Дж., Ху З., Секхар С., Го З. (сентябрь 2016 г.).«OGG1 необходим для деметилирования ДНК, вызванного окислительным стрессом». Cell. Сигнал. 28 (9): 1163–71. Дои:10.1016 / j.cellsig.2016.05.021. PMID 27251462.
- ^ Байрактар Г., Кройц М.Р. (2018). «Роль зависимого от активности деметилирования ДНК в мозге взрослого человека и при неврологических расстройствах». Front Mol Neurosci. 11: 169. Дои:10.3389 / fnmol.2018.00169. ЧВК 5975432. PMID 29875631.
- ^ Massaad CA, Klann E (май 2011 г.). «Активные формы кислорода в регуляции синаптической пластичности и памяти». Антиоксид. Редокс-сигнал. 14 (10): 2013–54. Дои:10.1089 / ars.2010.3208. ЧВК 3078504. PMID 20649473.
- ^ Бекхаузер Т.Ф., Франсис-Оливейра Дж., Де Паскуале Р. (2016). «Реактивные формы кислорода: физиологические и физиопатологические эффекты на синаптическую пластичность». J Exp Neurosci. 10 (Дополнение 1): 23–48. Дои:10.4137 / JEN.S39887. ЧВК 5012454. PMID 27625575.
- ^ Day JJ, Sweatt JD (январь 2011 г.). «Эпигенетические модификации нейронов необходимы для формирования и хранения поведенческой памяти». Нейропсихофармакология. 36 (1): 357–8. Дои:10.1038 / npp.2010.125. ЧВК 3055499. PMID 21116250.
- ^ Sweatt JD (октябрь 2016 г.). «Нейропластичность и поведение - шестьдесят лет концептуальных достижений». J. Neurochem. 139 Дополнение 2: 179–199. Дои:10.1111 / jnc.13580. PMID 26875778.
- ^ Хальдер Р., Хеннион М., Видал Р.О., Шомрони О., Рахман РУ, Раджпут А., Сентено Т.П., ван Беббер Ф., Капече V, Гарсия Вискайно Дж. К., Шуэц А. Л., Буркхард С., Бенито Е., Наварро Сала М., Яванский С. Б., Хаасс С. , Шмид Б., Фишер А., Бонн С. (январь 2016 г.). «Изменения метилирования ДНК в генах пластичности сопровождают формирование и поддержание памяти». Nat. Неврологи. 19 (1): 102–10. Дои:10.1038 / № 4194. ЧВК 4700510. PMID 26656643.
- ^ Duke CG, Kennedy AJ, Gavin CF, Day JJ, Sweatt JD (июль 2017 г.). «Зависящая от опыта эпигеномная реорганизация в гиппокампе». Учить. Mem. 24 (7): 278–288. Дои:10.1101 / лм. 045112.117. ЧВК 5473107. PMID 28620075.
- ^ Day JJ, Sweatt JD (ноябрь 2010 г.). «Метилирование ДНК и формирование памяти». Nat. Неврологи. 13 (11): 1319–23. Дои:10.1038 / номер 2666. ЧВК 3130618. PMID 20975755.
дальнейшее чтение
- Сен СК (2003). «Общий случай окислительно-восстановительного контроля заживления ран». Ремонт и регенерация ран. 11 (6): 431–8. Дои:10.1046 / j.1524-475X.2003.11607.x. PMID 14617282.
- Krötz F, Sohn HY, Gloe T, Zahler S, Riexinger T, Schiele TM, Becker BF, Theisen K, Klauss V, Pohl U (август 2002 г.). «НАД (Ф) Н-оксидаза-зависимое высвобождение супероксид-аниона тромбоцитов увеличивает рекрутирование тромбоцитов». Кровь. 100 (3): 917–24. Дои:10.1182 / кровь.V100.3.917. PMID 12130503.
- Pignatelli P, Pulcinelli FM, Lenti L, Gazzaniga PP, Violi F (январь 1998 г.). «Перекись водорода участвует в индуцированной коллагеном активации тромбоцитов». Кровь. 91 (2): 484–90. Дои:10.1182 / blood.V91.2.484. PMID 9427701.
- Гузик Т.Дж., Корбут Р., Адамек-Гузик Т. (декабрь 2003 г.). «Оксид и супероксид азота при воспалении и иммунной регуляции». Журнал физиологии и фармакологии. 54 (4): 469–87. PMID 14726604.

![{ displaystyle { ce {^ 3O2 -> [{ ce {свет}}] [{ ce {фотосенсибилизатор}}] ^ 1O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0a62c29558574cf534f0eaf188595d3f3c8bb29b)