Цисплатин - Cisplatin
 | |||
| |||
| Клинические данные | |||
|---|---|---|---|
| Торговые наименования | Платинол, другие | ||
| Другие имена | Цисплатин, платамин, неоплатин, цизмаплат, СНГ-диамминдихлорплатина (II) (CDDP) | ||
| AHFS /Drugs.com | Монография | ||
| MedlinePlus | a684036 | ||
| Данные лицензии | |||
| Беременность категория | |||
| Маршруты администрация | Внутривенно | ||
| Код УВД | |||
| Легальное положение | |||
| Легальное положение | |||
| Фармакокинетический данные | |||
| Биодоступность | 100% (IV) | ||
| Связывание с белками | > 95% | ||
| Устранение период полураспада | 30–100 часов | ||
| Экскреция | Почечный | ||
| Идентификаторы | |||
| |||
| Количество CAS | |||
| PubChem CID | |||
| DrugBank | |||
| ChemSpider | |||
| UNII | |||
| КЕГГ | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| Лиганд PDB | |||
| Панель управления CompTox (EPA) | |||
| ECHA InfoCard | 100.036.106 | ||
| Химические и физические данные | |||
| Формула | [Pt (NH3)2Cl2] | ||
| Молярная масса | 300.05 г · моль−1 | ||
| 3D модель (JSmol ) | |||
| |||
| |||
| | |||
Цисплатин это химиотерапевтические препараты используется для лечения ряда раки.[2] К ним относятся Рак яичек, рак яичников, рак шейки матки, рак молочной железы, Рак мочевого пузыря, рак головы и шеи, рак пищевода, рак легких, мезотелиома, опухоли головного мозга и нейробластома.[2] Это дается инъекция в вену.[2]
Общие побочные эффекты включают: подавление костного мозга, проблемы со слухом, проблемы с почками, и рвота.[2][3] Другие серьезные побочные эффекты включают онемение, проблемы с ходьбой, аллергические реакции, проблемы с электролитом, и сердечное заболевание.[2] Использование во время беременности может нанести вред ребенку.[1][2] Цисплатин находится в противоопухолевые препараты на основе платины семейство лекарств.[2] Он работает частично путем связывания с ДНК и подавления его воспроизведение.[2]
Цисплатин был открыт в 1845 году и разрешен к медицинскому применению в 1978 и 1979 годах.[4][2] Это на Список основных лекарственных средств Всемирной организации здравоохранения.[5]
Медицинское использование
Цисплатин вводят внутривенно в виде кратковременной инфузии в физиологическом растворе для лечения солидных и гематологических злокачественных новообразований. Он используется для лечения различных видов рака, в том числе саркомы, немного карциномы (например., мелкоклеточный рак легких, плоскоклеточный рак головы и шеи и рак яичников ), лимфомы, Рак мочевого пузыря, рак шейки матки,[6] и опухоли половых клеток.
Цисплатин особенно эффективен против рака яичек; его принятие увеличило процент излечения с 10% до 85%.[7]
Кроме того, цисплатин используется в Оже-терапия.[требуется медицинская цитата ]
Побочные эффекты
Цисплатин имеет ряд побочных эффектов, которые могут ограничивать его использование:
- Нефротоксичность (повреждение почек) является серьезной проблемой.[2] Дозу следует уменьшить, когда у человека функция почек нарушен. Адекватная гидратация используется для предотвращения повреждений.[2] Амифостин был изучен с целью предотвращения проблем.[8] Нефротоксичность - это побочный эффект, ограничивающий дозу.[2]
- Нейротоксичность (повреждение нерва) можно ожидать, выполнив исследования нервной проводимости до и после лечения. Общие неврологические побочные эффекты цисплатина включают нарушение зрительного восприятия и слуха, которое может возникнуть вскоре после начала лечения.[9] Хотя запуск апоптоза путем вмешательства в репликацию ДНК остается основным механизмом действия цисплатина, не было обнаружено, что он способствует развитию неврологических побочных эффектов. Недавние исследования показали, что цисплатин неконкурентно ингибирует архетипический мембраносвязанный механочувствительный переносчик ионов натрия и водорода, известный как NHE-1.[9] В первую очередь он обнаруживается на клетках периферической нервной системы, которые в большом количестве собираются вблизи глазных и слуховых центров приема раздражителей. Это неконкурентное взаимодействие было связано с гидроэлектролитным дисбалансом и изменениями цитоскелета, оба из которых были подтверждены in vitro и in vivo. Однако было обнаружено, что ингибирование NHE-1 является дозозависимым (полуингибирование = 30 мкг / мл) и обратимым.[9]
- Тошнота и рвота: цисплатин является одним из самых рвотных химиотерапевтических средств, но этот симптом лечится с помощью профилактических противорвотных средств (ондансетрон, гранисетрон и т. д.) в сочетании с кортикостероиды. Апрепитант в сочетании с ондансетрон и дексаметазон было показано, что он лучше подходит для сильно рвотной химиотерапии, чем просто ондансетрон и дексаметазон.
- Ототоксичность (потеря слуха): в настоящее время не существует эффективного лечения для предотвращения этого побочного эффекта, который может быть серьезным, хотя исследования продолжаются. ацетилцистеин инъекции в профилактических целях.[10] Аудиометрический анализ может потребоваться для оценки степени ототоксичности. Другие препараты (такие как класс аминогликозидных антибиотиков) также могут вызывать ототоксичность, и назначения этого класса антибиотиков пациентам, получающим цисплатин, обычно следует избегать. Ототоксичность как аминогликозидов, так и цисплатина может быть связана с их способностью связываться с меланин в сосудистая полоска внутреннего уха или генерации активные формы кислорода.
- Электролитное нарушение: Цисплатин может вызывать гипомагниемию, гипокалиемию и гипокальциемию. Гипокальциемия, по-видимому, возникает у пациентов с низким содержанием магния в сыворотке крови вторично по отношению к цисплатину, поэтому она не связана в первую очередь с цисплатином.
- Гемолитическая анемия может развиться после нескольких курсов цисплатина. Предполагается, что антитело, реагирующее с мембраной цисплатин-эритроцитов, отвечает за гемолиз.[11]
Фармакология
Цисплатин препятствует репликации ДНК, которая убивает наиболее быстро пролиферирующие клетки, которые теоретически являются злокачественными. После введения один хлорид-ион медленно замещается водой с образованием комплекс AQUO СНГ- [PtCl (NH3)2(ЧАС2O)]+, в процессе, называемом Аквация. Диссоциация хлорида внутри клетки благоприятствует, поскольку концентрация внутриклеточного хлорида составляет всего 3–20% от приблизительно 100 мМ концентрации хлорида во внеклеточной жидкости.[12][13]
Молекула воды в СНГ- [PtCl (NH3)2(ЧАС2O)]+ сам легко вытесняется N-гетероциклические основания на ДНК. Гуанин преимущественно связывает. После образования [PtCl (гуанин-ДНК) (NH3)2]+сшивание может происходить за счет замещения другого хлорида, обычно другим гуанином.[14] Цисплатин сшивает ДНК несколькими разными способами, препятствуя делению клеток митоз. Поврежденная ДНК вызывает Ремонт ДНК механизмы, которые в свою очередь активируют апоптоз когда ремонт оказывается невозможным. В 2008 году исследователям удалось показать, что апоптоз индуцируется цисплатином на раковых клетках толстой кишки человека, зависит от митохондриальной серин-протеазы Omi / Htra2.[15] Поскольку это было продемонстрировано только для клеток карциномы толстой кишки, остается открытым вопрос, участвует ли белок Omi / Htra2 в индуцированном цисплатином апоптозе в карциномах из других тканей.[требуется медицинская цитата ]
Наиболее заметными среди изменений в ДНК являются 1,2-внутрицепочечные поперечные связи с пурин базы. К ним относятся 1,2-внутрицепь d (Gp G) аддукты, которые образуют почти 90% аддуктов и менее распространенный 1,2-внутрицепочечный d (Ap Ж) аддукты. 1,3-внутрицепочечные аддукты d (GpXpG) встречаются, но легко удаляются нуклеотид эксцизионная пластика (NER ). Другие аддукты включают межцепочечные сшивки и нефункциональные аддукты, которые, как постулируется, вносят вклад в активность цисплатина. Взаимодействие с клеточными белками, в частности HMG доменные белки, также были развиты как механизм вмешательства в митоз, хотя, вероятно, это не его основной метод действия.[требуется медицинская цитата ]
Цисплатин резистентность
Комбинированная химиотерапия цисплатином является краеугольным камнем лечения многих видов рака. Первоначальная чувствительность к платине высока, но у большинства онкологических больных в конечном итоге рецидив заболевания устойчив к цисплатину. Было предложено множество механизмов устойчивости к цисплатину, включая изменения клеточного поглощения и оттока препарата, усиление детоксикации препарата, ингибирование апоптоз и увеличился Ремонт ДНК.[16] Оксалиплатин активен в лабораторных условиях в отношении раковых клеток с высокой устойчивостью к цисплатину; однако имеется мало доказательств его активности при клиническом лечении пациентов с цисплатин-резистентным раком.[16] Наркотик паклитаксел может быть полезным при лечении рака, устойчивого к цисплатину; механизм этой активности неизвестен.[17]
Трансплатин
Трансплатин, то транс стереоизомер цисплатина, имеет формулу транс- [PtCl2(NH3)2] и не проявляет сравнительно полезного фармакологического эффекта. Было предложено два механизма, объясняющих снижение противоопухолевого эффекта трансплатина. Во-первых, транс Предполагается, что расположение хлорлигандов наделяет трансплатин большей химической реактивностью, вызывая дезактивацию трансплатина до того, как он достигнет ДНК, где цисплатин проявляет свое фармакологическое действие. Во-вторых, стереоконформация трансплатина такова, что он не может образовывать характерные 1,2-внутрицепочечные d (GpG) аддукты, в большом количестве образованные цисплатином.[18]
Молекулярная структура
Цисплатин - это квадратный плоский координационный комплекс цис- [Pt (NH3)2Cl2].[19]:286–8[20]:689 Префикс СНГ указывает на СНГ изомер в котором два одинаковых лиганда находятся в соседних положениях.[19][20]:550 Систематическое химическое название этой молекулы: СНГ–Диамминдихлорплатина,[19]:286 куда аммин с двумя буквами m означает аммиак (NH3) лиганд, в отличие от органического амин с одним м.[19]:284
История
Состав СНГ- [Pt (NH3)2Cl2] был впервые описан Микеле Пейроне в 1845 году и долгое время был известен как соль Пейроне.[21] Структура была выведена Альфред Вернер в 1893 г.[14] В 1965 г. Барнетт Розенберг, Ван Камп и др. из Университет штата Мичиган обнаружил, что электролиз платиновых электродов образовали растворимый комплекс платины, который ингибировал бинарное деление в кишечная палочка (Кишечная палочка) бактерии. Хотя рост бактериальных клеток продолжался, деление клеток было остановлено, бактерии растут в виде нитей до 300 раз своей нормальной длины.[22] Октаэдрический комплекс Pt (IV) СНГ- [PtCl4(NH3)2], но не транс изомер, оказался эффективным при форсировании нитчатого роста Кишечная палочка клетки. Квадратно-плоский комплекс Pt (II), СНГ- [PtCl2(NH3)2] оказался даже более эффективным в форсировании роста нитей.[23][24] Это открытие привело к наблюдению, что СНГ- [PtCl2(NH3)2] действительно был очень эффективен при регрессии массы саркомы в крысы.[25] Подтверждение этого открытия и распространение тестирования на другие линии опухолевых клеток положило начало медицинскому применению цисплатина. Цисплатин был одобрен для использования при раке яичка и яичников Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США 19 декабря 1978 г.,[14][26][27] и в Великобритании (и в некоторых других европейских странах) в 1979 году.[28] Недавно некоторые исследователи на доклиническом уровне исследовали новые формы цисплатина. пролекарства в комбинации с наноматериалы с целью локализации выпуска препарат, средство, медикамент в мишени.[29][30]
Синтез
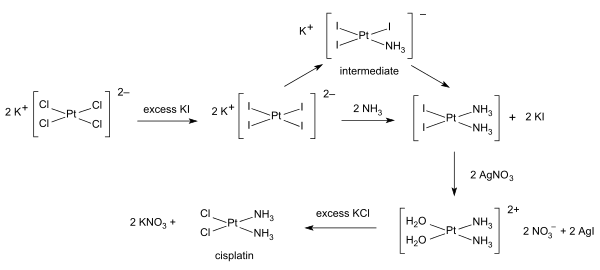
Синтезы цисплатина начинаются с тетрахлороплатинат калия. Доступно несколько процедур. Одно из препятствий - легкое формирование Зеленая соль Магнуса (MGS), имеющий ту же эмпирическую формулу, что и цисплатин. Традиционный способ избежать MGS включает преобразование K2PtCl4 к K2PtI4, как первоначально описал Дхара.[31][32] Реакция с аммиак формы PtI2(NH3)2 который выделяется в виде желтого соединения. Когда нитрат серебра в воду добавляется нерастворимый йодид серебра осаждается и [Pt (OH2)2(NH3)2](НЕТ3)2 остается в растворе. Добавление хлорид калия образует конечный продукт, который осаждается [32] В трийод-промежуточном соединении добавление второго аммиачного лиганда регулируется транс эффект.[32]
А однокамерный синтез цисплатина из K2PtCl4 была разработана. Он основан на медленном выделении аммиака из ацетата аммония.[33]
Смотрите также
Рекомендации
- ^ а б c d «Использование цисплатина во время беременности». Drugs.com. 12 сентября 2019 г.. Получено 25 февраля 2020.
- ^ а б c d е ж грамм час я j k л «Цисплатин». Американское общество фармацевтов систем здравоохранения. В архиве из оригинала 21 декабря 2016 г.. Получено 8 декабря 2016.
- ^ Оун Р., Мусса Й.Е., Уит Нью-Джерси (май 2018 г.). «Побочные эффекты химиотерапевтических препаратов на основе платины: обзор для химиков». Dalton Transactions. 47 (19): 6645–6653. Дои:10.1039 / c8dt00838h. PMID 29632935.
- ^ Фишер Дж, Ганеллин ЧР (2006). Открытие лекарств на основе аналогов. Джон Вили и сыновья. п. 513. ISBN 9783527607495. В архиве из оригинала от 20 декабря 2016 г.
- ^ Всемирная организация здоровья (2019). Типовой список основных лекарственных средств Всемирной организации здравоохранения: 21-й список 2019 г.. Женева: Всемирная организация здравоохранения. HDL:10665/325771. WHO / MVP / EMP / IAU / 2019.06. Лицензия: CC BY-NC-SA 3.0 IGO.
- ^ «Цисплатин». Национальный институт рака. В архиве из оригинала 8 октября 2014 г.. Получено 13 ноября 2014.
- ^ Эйнхорн LH (ноябрь 1990 г.). «Лечение рака яичек: новая улучшенная модель». Журнал клинической онкологии. 8 (11): 1777–81. Дои:10.1200 / JCO.1990.8.11.1777. PMID 1700077.
- ^ Аван А., Постма Т. Дж., Цереза С., Аван А., Кавалетти Дж., Джованнетти Е., Петерс Дж. Дж. (Апрель 2015 г.). «Вызванная платиной нейротоксичность и превентивные стратегии: прошлое, настоящее и будущее». Онколог. 20 (4): 411–32. Дои:10.1634 / теонколог.2014-0044. ЧВК 4391771. PMID 25765877.
- ^ а б c Милосавлевич Н., Дюрантон С., Джерби Н., Пуэх PH, Гунон П., Лагадич-Госсманн Д. и др. (Октябрь 2010 г.). «Негеномные эффекты цисплатина: острое ингибирование механочувствительных транспортеров и каналов без ремоделирования актина». Исследования рака. 70 (19): 7514–22. Дои:10.1158 / 0008-5472.CAN-10-1253. PMID 20841472. Сложить резюме – ScienceDaily.
- ^ Сарафраз, Захра; Ахмади, Аслан; Данеши, Ахмад (2018). «Транстимпанические инъекции N-ацетилцистеина и дексаметазона для предотвращения ототоксичности, вызванной цисплатином: двойное слепое рандомизированное клиническое испытание». Международный журнал тиннитуса. 22 (1): 40–45. Дои:10.5935/0946-5448.20180007. PMID 29993216.
- ^ Леви Дж. А., Арони Р. С., Далли Д. Н. (июнь 1981 г.). «Гемолитическая анемия после лечения цисплатином». Британский медицинский журнал. 282 (6281): 2003–4. Дои:10.1136 / bmj.282.6281.2003. ЧВК 1505958. PMID 6788166.
- ^ Ван Д., Липпард С.Дж. (апрель 2005 г.). «Клеточная переработка платиновых противоопухолевых препаратов». Обзоры природы. Открытие наркотиков. 4 (4): 307–20. Дои:10.1038 / nrd1691. PMID 15789122. S2CID 31357727.
- ^ Johnstone TC, Suntharalingam K, Lippard SJ (март 2016 г.). «Следующее поколение платиновых препаратов: целевые агенты Pt (II), доставка наночастиц и пролекарства Pt (IV)». Химические обзоры. 116 (5): 3436–86. Дои:10.1021 / acs.chemrev.5b00597. ЧВК 4792284. PMID 26865551.
- ^ а б c Trzaska S (20 июня 2005 г.). «Цисплатин». Новости химии и машиностроения. 83 (25): 52. Дои:10.1021 / cen-v083n025.p052.
- ^ Прюфер Ф.Г., Лизаррага Ф., Мальдонадо В., Мелендес-Зайгла Дж. (Июнь 2008 г.). «Участие активности серин-протеазы Omi Htra2 в апоптозе, индуцированном цисплатином на раковых клетках толстой кишки SW480». Журнал химиотерапии. 20 (3): 348–54. Дои:10.1179 / joc.2008.20.3.348. PMID 18606591. S2CID 11052459.
- ^ а б Стордал Б., Дэйви М. (ноябрь 2007 г.). «Понимание устойчивости к цисплатину с использованием клеточных моделей» (PDF). IUBMB Life. 59 (11): 696–9. Дои:10.1080/15216540701636287. PMID 17885832. S2CID 30879019.
- ^ Стордал Б., Павлакис Н., Дэйви Р. (декабрь 2007 г.). «Систематический обзор устойчивости к платине и таксану от лаборатории к клинике: обратная зависимость» (PDF). Отзывы о лечении рака. 33 (8): 688–703. Дои:10.1016 / j.ctrv.2007.07.013. HDL:2123/4068. PMID 17881133.
- ^ Coluccia M, Natile G (январь 2007 г.). «Трансплатиновые комплексы в терапии рака». Противораковые средства в медицинской химии. 7 (1): 111–23. Дои:10.2174/187152007779314080. PMID 17266508.
- ^ а б c d Miessler GL, Tarr DA (1999). Неорганическая химия (2-е изд.). Прентис Холл. ISBN 978-0-13-841891-5.
- ^ а б Housecroft CE, Sharpe AG (2005). Неорганическая химия (2-е изд.). Пирсон Прентис Холл. ISBN 978-0-130-39913-7.
- ^ Пейрон М (1844 г.). "Ueber die Einwirkung des Ammoniaks auf Platinchlorür" [О действии аммиака на хлорид платины]. Анна. Chem. Фарм. 51 (1): 1–29. Дои:10.1002 / jlac.18440510102.
- ^ Розенберг Б., Ванкамп Л., Кригас Т. (февраль 1965 г.). «Ингибирование деления клеток Escherichia coli продуктами электролиза с платинового электрода». Природа. 205 (4972): 698–9. Bibcode:1965Натура.205..698R. Дои:10.1038 / 205698a0. PMID 14287410. S2CID 9543916.
- ^ Розенберг Б., Ван Кэмп Л., Гримли Э. Б., Томсон А. Дж. (Март 1967 г.). «Подавление роста или деления клеток в Escherichia coli различными ионными видами комплексов платины (IV)». Журнал биологической химии. 242 (6): 1347–52. PMID 5337590.
- ^ Кристи Д.А., Тэнси Э.М., Томсон А.Дж., ред. (2007). Открытие, использование и влияние солей платины в качестве химиотерапевтического агента при раке. Wellcome Trust Свидетели медицины двадцатого века. 30. С. 6–15. ISBN 978-0-85484-112-7.
- ^ Розенберг Б., ВанКэмп Л., Троско Дж. Э., Мансур В. Х. (апрель 1969 г.). «Соединения платины: новый класс сильнодействующих противоопухолевых средств». Природа. 222 (5191): 385–6. Bibcode:1969Натура.222..385R. Дои:10.1038 / 222385a0. PMID 5782119. S2CID 32398470.
- ^ Карпентер Д.П. (2010). Репутация и власть: имидж организации и фармацевтическое регулирование в FDA. Принстон, Нью-Джерси: Издательство Принстонского университета. ISBN 978-0-691-14180-0.
- ^ «Резюме одобрения цисплатина для лечения метастатических опухолей яичников». Инструменты для онкологии FDA. Управление по контролю за продуктами и лекарствами, Центр оценки лекарственных средств и исследований. 19 декабря 1978 г. Архивировано из оригинал 8 февраля 2008 г.. Получено 15 июля 2009.
- ^ Уилтшоу Э (1979). «Цисплатин в лечении рака». Обзор платиновых металлов. 23 (3): 90–8.
- ^ Дхар С., Даниэль В.Л., Гилджоханн Д.А., Миркин К.А., Липпард С.Дж. (октябрь 2009 г.). «Конъюгаты поливалентных олигонуклеотидных наночастиц золота в качестве средств доставки для платиновых (IV) боеголовок». Журнал Американского химического общества. 131 (41): 14652–3. Дои:10.1021 / ja9071282. ЧВК 2761975. PMID 19778015.
- ^ Санти М., Мапанао А.К., Кассано Д., Вламидис Ю., Каппелло В., Волиани В. (апрель 2020 г.). «Эндогенно-активированные сверхмалые в нано-терапии: оценка плоскоклеточного рака головы и шеи в 3D». Рак. 12 (5): 1063. Дои:10.3390 / раки12051063. ЧВК 7281743. PMID 32344838.
- ^ Дхара SC (1970). «Цисплатин». Индиан Дж. Хим. 8: 123–134.
- ^ а б c Олдерден Р.А., Холл, Мэриленд, Хэмбли Т.В. (2006). «Открытие и разработка цисплатина». J. Chem. Educ. 83 (5): 728. Bibcode:2006JChEd..83..728A. Дои:10.1021 / ed083p728. S2CID 29546931.
- ^ Кукушикин В.Ю., Оскарссон Å, Элдинг Л.И., Фаррелл Н. (2007). Легкий синтез изомерно чистого цис-дихлордиамминплатины (II), цисплатина. Неорганические синтезы. 32. С. 141–144. Дои:10.1002 / 9780470132630.ch23. ISBN 9780470132630.
дальнейшее чтение
- Ридделл И.А., Липпард С.Дж. (2018). «Цисплатин и оксалиплатин: наше текущее понимание их действий». В Sigel A, Sigel H, Freisinger E, Sigel RK (ред.). Металло-препараты: разработка и действие противоопухолевых средств. Ионы металлов в науках о жизни. 18. Берлин: de Gruyter GmbH. С. 1–42. Дои:10.1515/9783110470734-007. ISBN 978-3-11-046984-4. PMID 29394020.
внешняя ссылка
- «Цисплатин». Портал информации о наркотиках. Национальная медицинская библиотека США.
- Монография МАИР: «Цисплатин»